MENU
極性(分子の形との関係・見分け方・例・打ち消しなど)
はじめに
【プロ講師解説】このページでは『極性(分子の形との関係・見分け方・例・打ち消しなど)』について解説しています。
分子の形
- 分子の形を考える際に重要なのは次の2ポイントである。
- 電子対同士は出来るだけ離れようとする
- 非共有電子対も共有電子対と同様に扱う
- 具体例を用いて解説する。
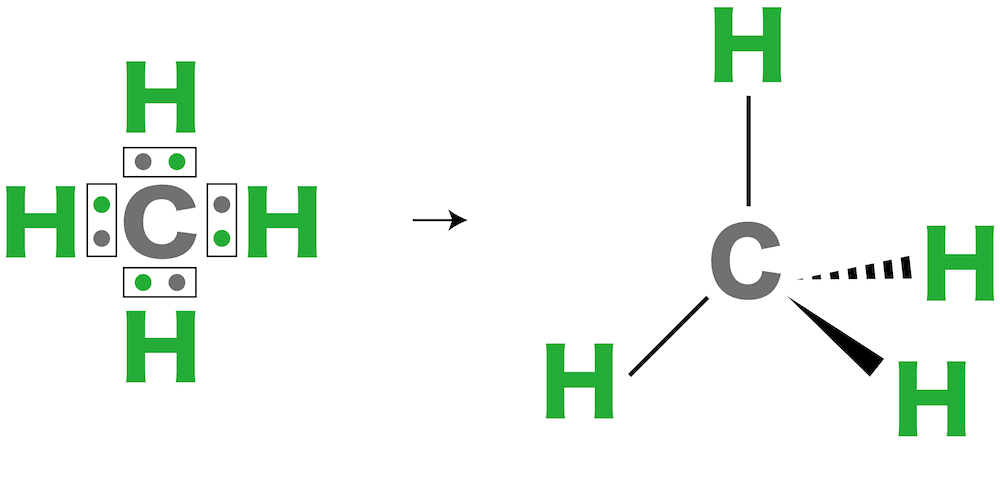
メタン
- メタンCH4は中心の炭素C原子が4対の電子対をもつ。
- これらができるだけ離れようとするため、分子の形は正四面体形となる。
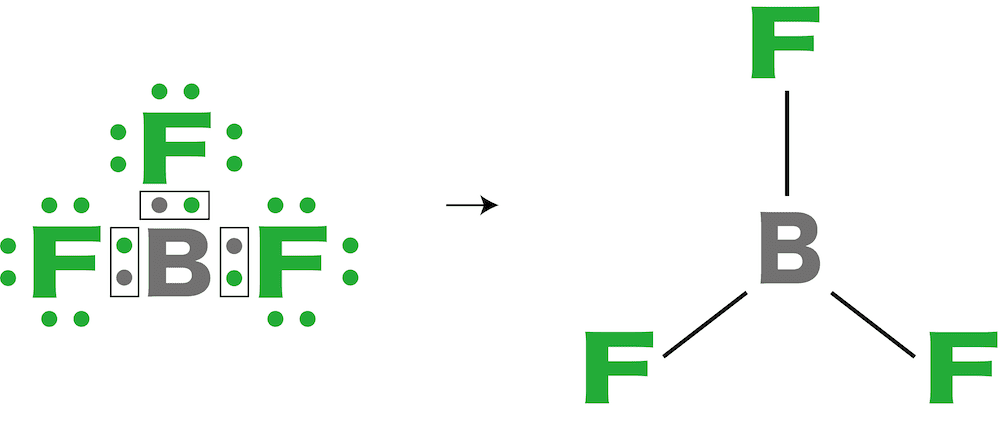
三フッ化ホウ素
- 三フッ化ホウ素BF3は中心のホウ素B原子が3対の電子対をもつ。
- これらができるだけ離れようとするため、分子の形は正三角形になる。
二酸化炭素
- 二酸化炭素CO2は中心の炭素C原子が2組の電子対をもつ。(二重結合や三重結合も1組と考える)
- これらが出来るだけ離れようとするため、分子の形は直線形になる。

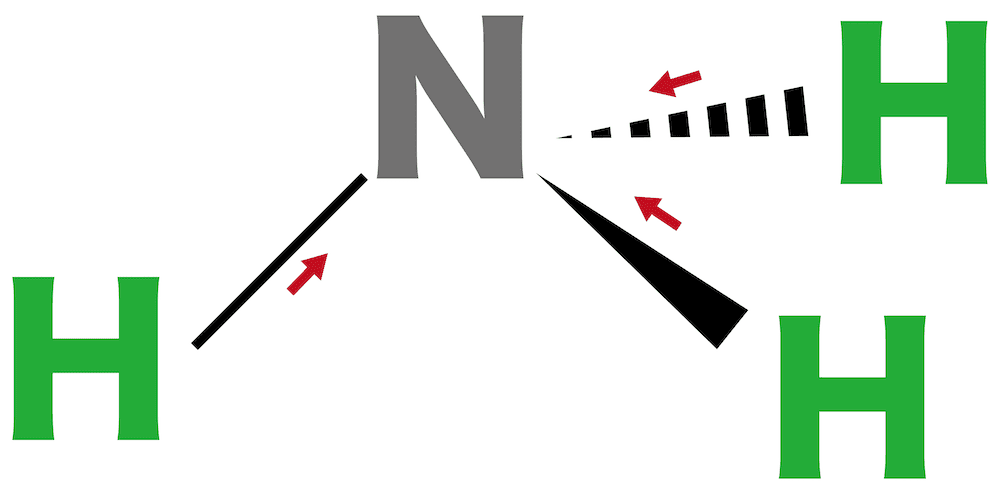
アンモニア
- アンモニアNH3は中心の窒素N原子がHとの間に3組の電子対をもつ。また1組の非共有電子対をもつ。
- これらが出来るだけ離れようとするため、全体が正四面体形になる。ただし、分子の形はあくまでNとHの位置関係で考えるため、分子の形は三角錐形となる。

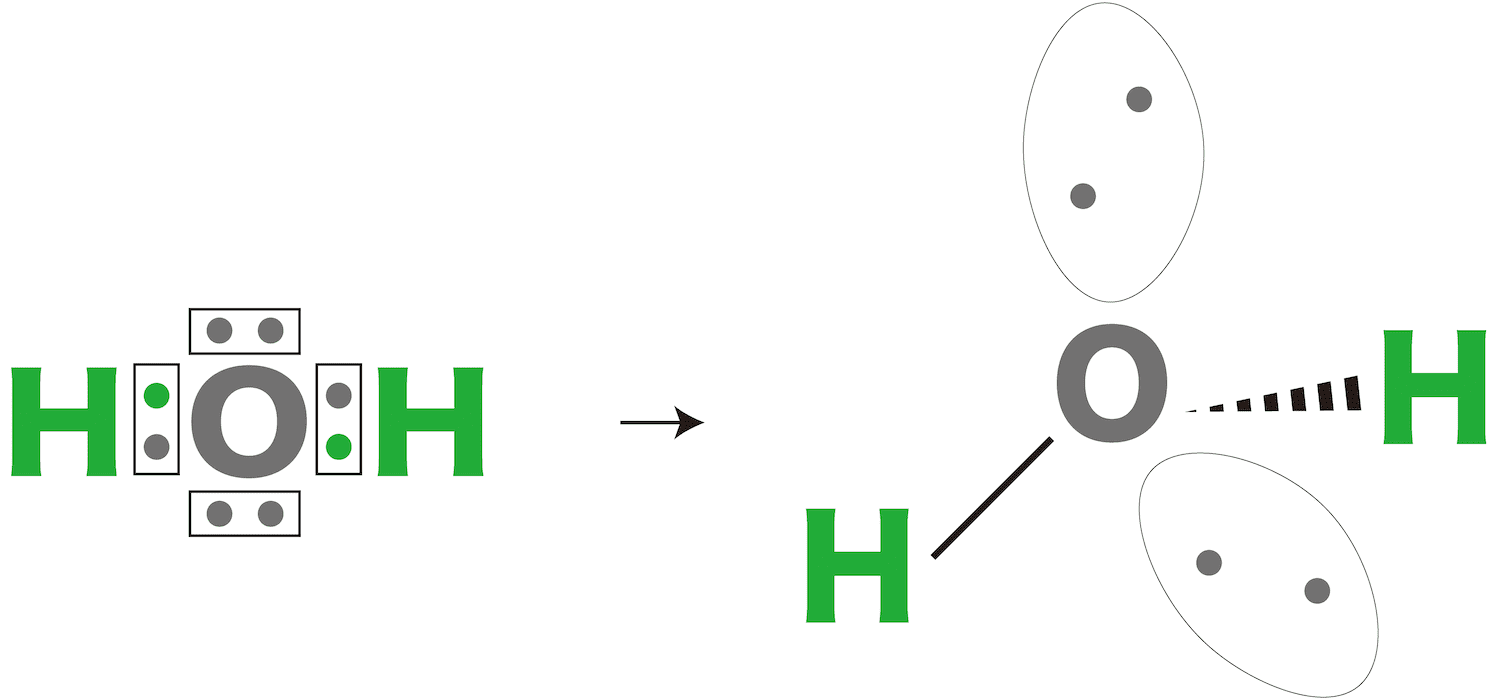
水
- 水H2Oは中心の酸素O原子がHとの間に2組の電子対をもつ。また2組の非共有電子対をもつ。
- これらが出来るだけ離れようとするため、全体が正四面体形になる。ただし、アンモニア同様、分子の形はあくまでOとHの位置関係で考えるため、分子の形は折れ線形となる。
極性と電気陰性度
- 異なる種類の原子が共有結合すると、共有電子対は電気陰性度が大きい原子の方へ引きつけられる。
- 塩化水素HClの場合、共有電子対は電気陰性度のより大きなCl原子の方へ引きつけられる。その結果、Cl原子は負(δー)に、H原子は正(δ+)に帯電する。
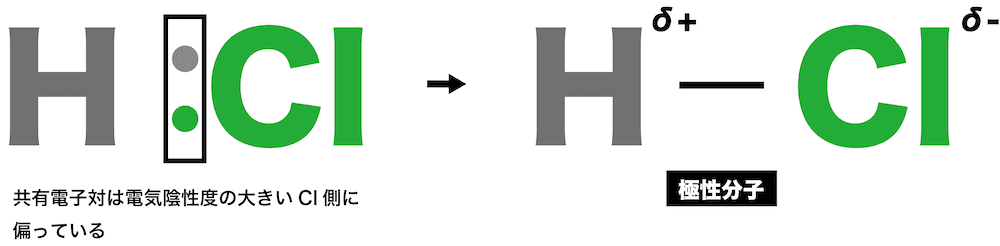
- このように、原子間の電気陰性度の差によって生じる電荷の偏りを極性といい、極性をもつ分子を極性分子という。
- 一方、塩素分子Cl2のように同じ種類の原子同士が結合すると、電気陰性度に差がないため共有電子対は2つのCl原子のちょうど真ん中に存在する。
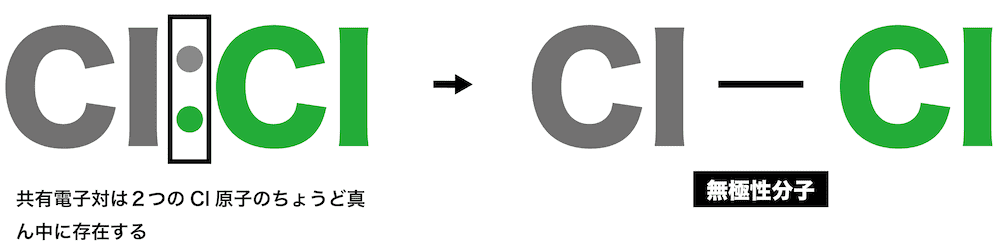
- そのため極性は生じておらず、このように極性をもたない分子を無極性分子という。
極性の打ち消し
- ここまでの説明を読んでこのように思った人がいるかもしれない。
「極性の理由が電気陰性度なら、ほとんど全ての分子に極性が生じているんじゃない?」 - だいたいの分子は違う原子同士がつながっているため、こう思う人が多いのは当然である。しかし「ある2つの原子間で極性が生じていても、分子全体でみたら極性がない」という場合(いわゆる極性の打ち消し)が存在する。
- 具体例を用いて解説する。
二酸化炭素
- 二酸化炭素の「C」と「O」の電気陰性度には差があるため、2原子間で極性が生じるのは間違いない。
- しかし、二酸化炭素の分子中にC=O結合が2つ存在する。
- したがって、同じ結合が左右対称に存在するため、電気的な偏りが左右で打ち消される。
- その結果、CとOの間に極性は生じるものの、分子全体では無極性となる。

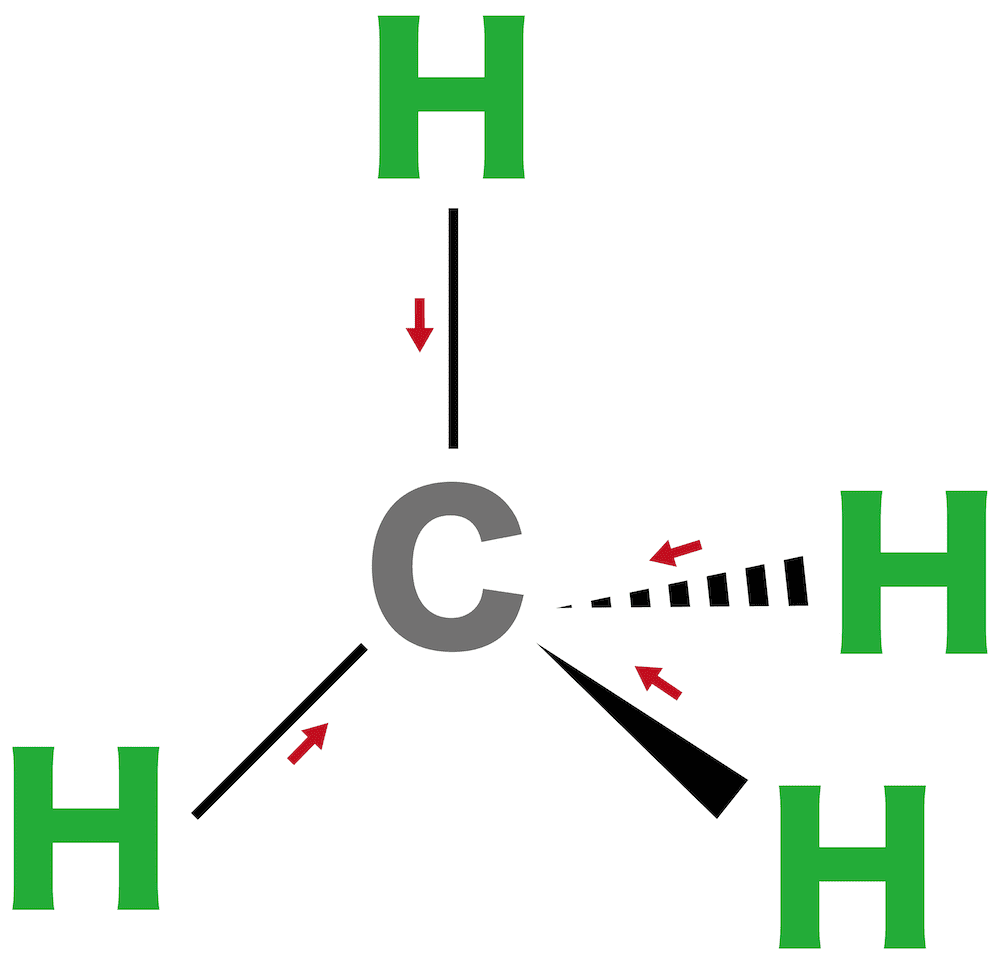
メタン
- CとHの電気陰性度を比較するとCの方が大きいため原子間で極性が生じる。
- しかし、CH4の形は正四面体形であり、したがって分子全体では無極性となる。
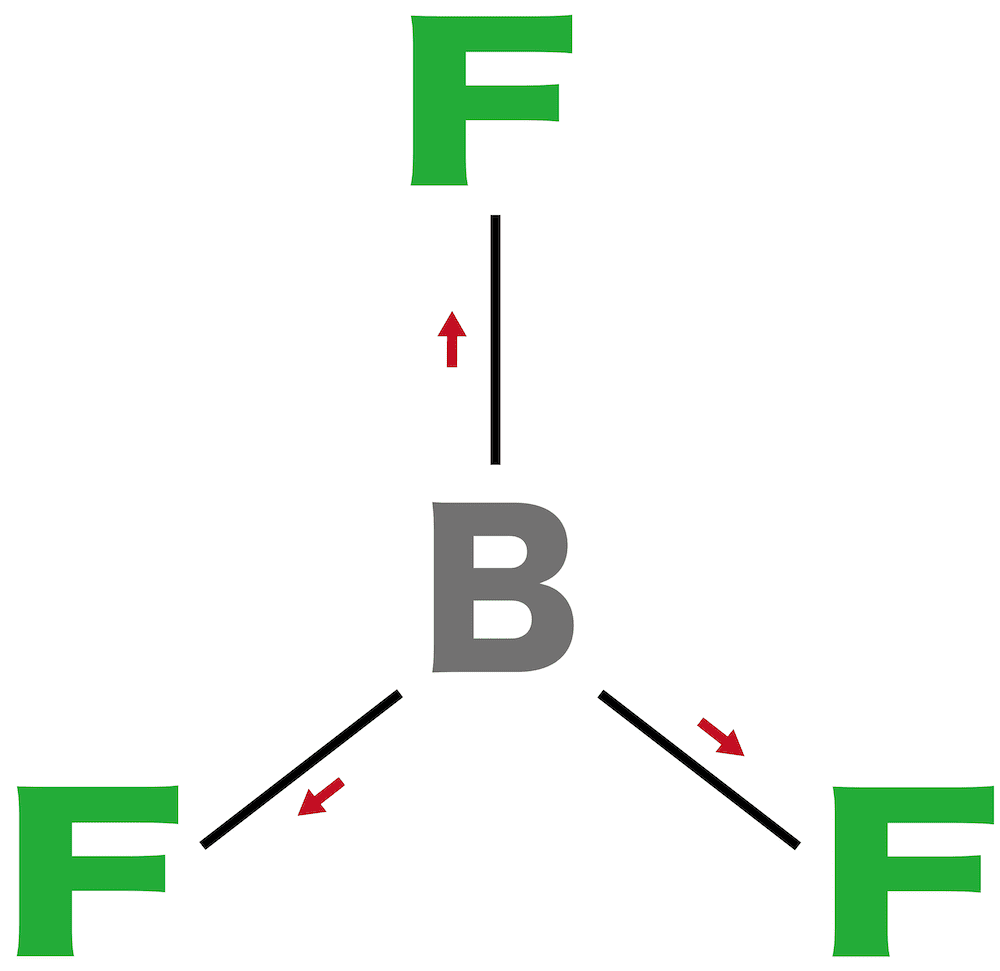
三フッ化ホウ素
- BとFの電気陰性度を比較するとFの方が大きいため原子間で極性が生じる。
- しかし、BF3の形は正三角形であり、したがって分子全体では無極性となる。
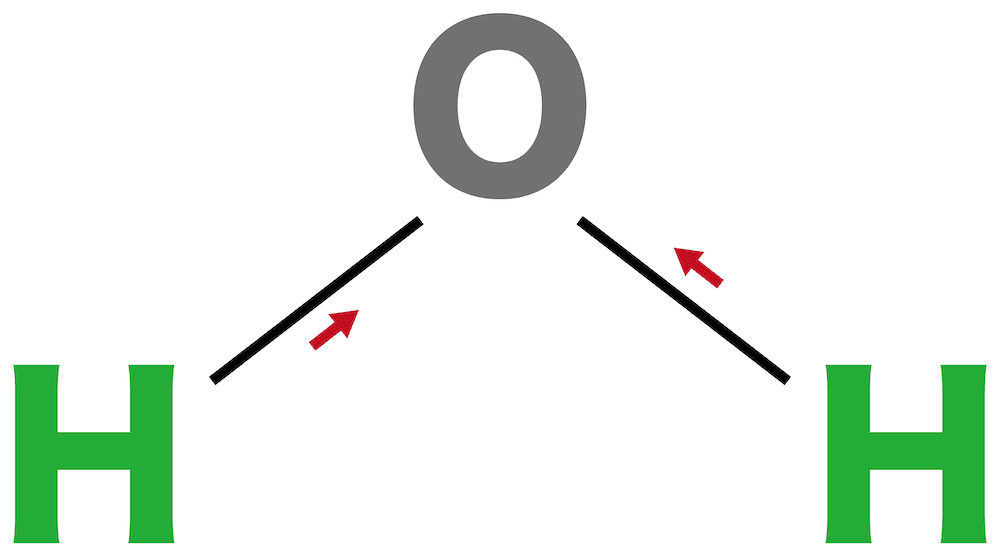
水
- H原子とO原子の電気陰性度を比較すると、Oの方が大きい。したがって、原子間に極性を生じている。
- また、H2Oは分子の形が折れ線形のため、分子全体で極性を打ち消すことができない。したがって、H2Oは極性分子である。
アンモニア
- N原子とH原子の電気陰性度を比較すると、Nの方が大きいため原子間に極性が生じている。
- NH3の形は三角錐形のため極性を打ち消すことはできない。したがってNH3も極性分子である。
分子の形・極性まとめ
- 代表的な化合物の分子の形・極性は次の通りである。
| 化合物 | 形 | 極性 |
|---|---|---|
| 二酸化炭素 | 直線形 | なし |
| メタン | 正四面体形 | なし |
| 三フッ化ホウ素 | 正三角形 | なし |
| 水 | 折れ線形 | あり |
| アンモニア | 三角錐形 | あり |
分子の形・極性まとめ
この『極性(分子の形との関係・見分け方・例・打ち消しなど)』のページで解説した内容をまとめる。
- 分子の形を考える際に重要なのは次の2ポイントである。
❶ 電子対同士は出来るだけ離れようとする
❷ 非共有電子対も共有電子対と同様に扱う - 原子間の電気陰性度の差によって生じる電荷の偏りを極性という。
- 極性をもつ分子を極性分子、極性をもたない分子を無極性分子という。
- 代表的な化合物の分子の形・極性は次の通りである。
| 化合物 | 形 | 極性 |
|---|---|---|
| 二酸化炭素 | 直線形 | なし |
| メタン | 正四面体形 | なし |
| 三フッ化ホウ素 | 正三角形 | なし |
| 水 | 折れ線形 | あり |
| アンモニア | 三角錐形 | あり |
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
異なる種類の原子が共有結合すると、共有電子対は電気陰性度が【1(大き or 小さ)】い原子の方へ引きつけられる。
解答/解説:タップで表示
解答:【1】大き
異なる種類の原子が共有結合すると、共有電子対は電気陰性度が大きい原子の方へ引きつけられる。
原子間の電気陰性度の差によって生じる電荷の偏りを【1】という。
解答/解説:タップで表示
解答:【1】極性
原子間の電気陰性度の差によって生じる電荷の偏りを極性という。
極性をもつ分子を【1】という。
解答/解説:タップで表示
解答:【1】極性分子
極性をもつ分子を極性分子という。
極性をもたない分子を【1】という。
解答/解説:タップで表示
解答:【1】無極性分子
極性をもたない分子を無極性分子という。
二酸化炭素の分子の形は【1】形である。
解答/解説:タップで表示
解答:【1】直線
二酸化炭素の分子の形は直線形である。

二酸化炭素は【1(極性 or 無極性)】分子である。
解答/解説:タップで表示
解答:【1】無極性
二酸化炭素は無極性分子である。

メタンの分子の形は【1】形である。
解答/解説:タップで表示
解答:【1】正四面体
メタンの分子の形は正四面体形である。

メタンは【1(極性 or 無極性)】分子である。
解答/解説:タップで表示
解答:【1】無極性
メタンは無極性分子である。

三フッ化ホウ素の分子の形は【1】形である。
解答/解説:タップで表示
解答:【1】正三角
三フッ化ホウ素の分子の形は正三角形である。

三フッ化ホウ素は【1(極性 or 無極性)】分子である。
解答/解説:タップで表示
解答:【1】無極性
三フッ化ホウ素は無極性分子である。

水の分子の形は【1】形である。
解答/解説:タップで表示
解答:【1】折れ線
水の分子の形は折れ線形である。

水は【1(極性 or 無極性)】分子である。
解答/解説:タップで表示
解答:【1】極性
水は極性分子である。

アンモニアの分子の形は【1】形である。
解答/解説:タップで表示
解答:【1】三角錐
アンモニアの分子の形は三角錐形である。

アンモニアは【1(極性 or 無極性)】分子である。
解答/解説:タップで表示
解答:【1】極性
アンモニアは極性分子である。















