MENU
凝固点降下(定義・公式・計算問題の解き方など)
はじめに
【プロ講師解説】このページでは『凝固点降下(定義・公式・計算問題の解き方など)』について解説しています。
凝固点降下とは
- 溶媒に溶質が加わると、凝固点が下がる。この現象を凝固点降下という。
- 凝固点降下の仕組みについて解説する。
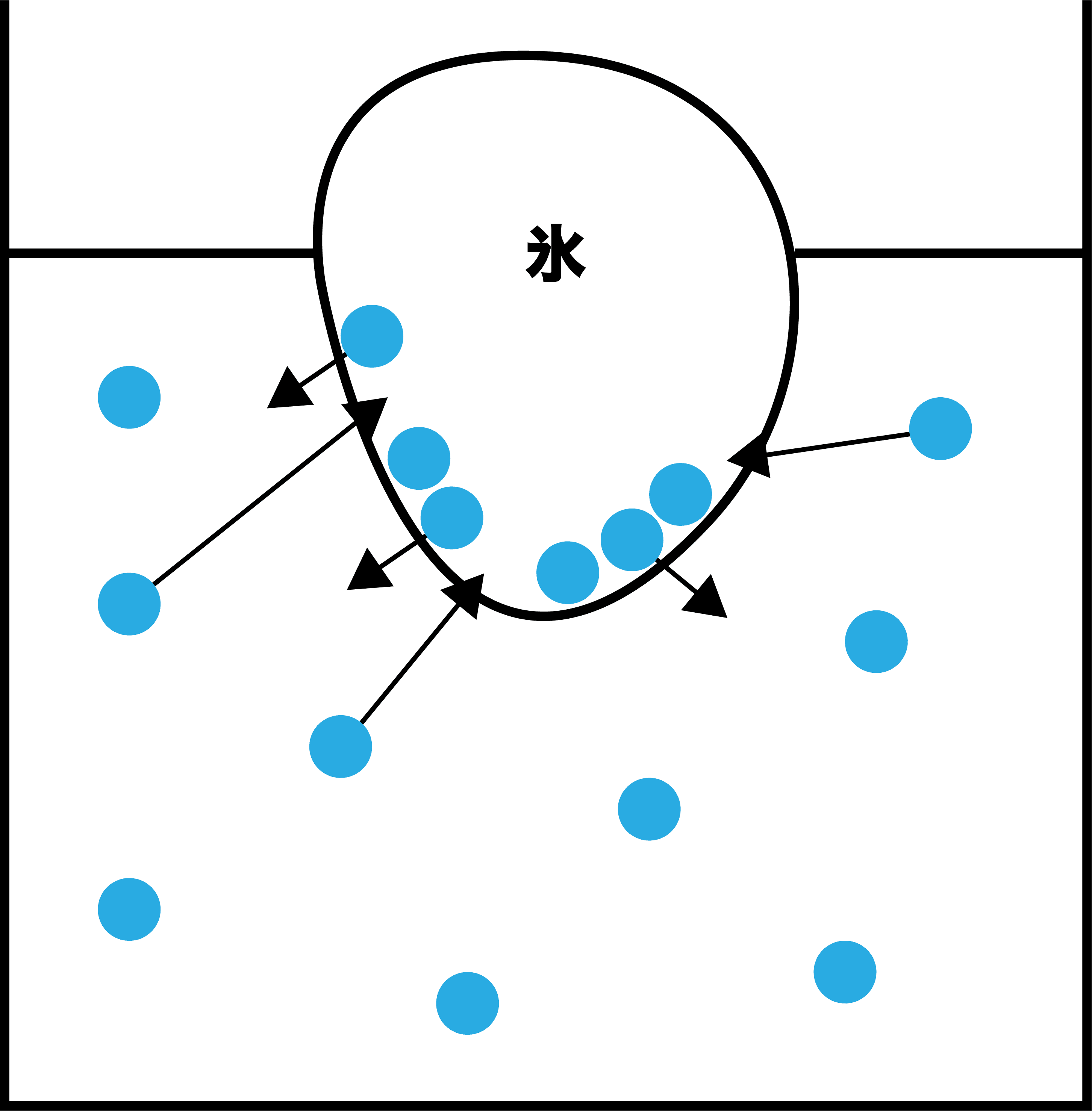
水(溶媒)のみの場合
- 溶質がないときは融解速度=凝固速度であり、いわゆる固液平衡(融解平衡)の状態である。
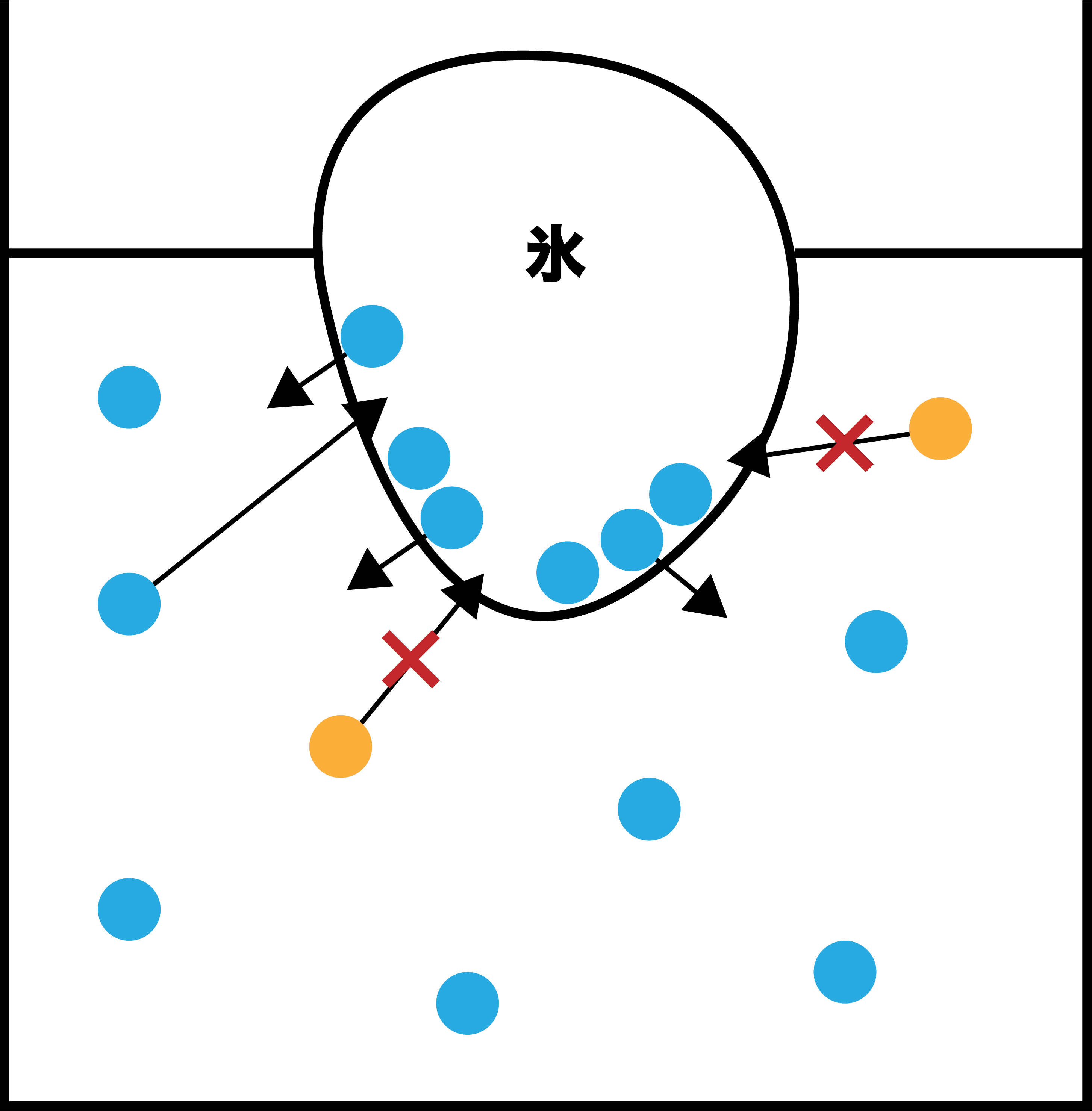
水(溶媒)+溶質の場合
- 溶質があるときは(溶質がジャマで凝固しにくいため)融解速度≧凝固速度であり、ひたすら氷が融解していく。
- したがって、非常に温度を低くしないと凝固しないため凝固点が下がる(凝固点降下)。
凝固点降下のグラフ
- 水の状態図は次の通りである。

- 水にブドウ糖などの溶質を溶解させると次のようになる。
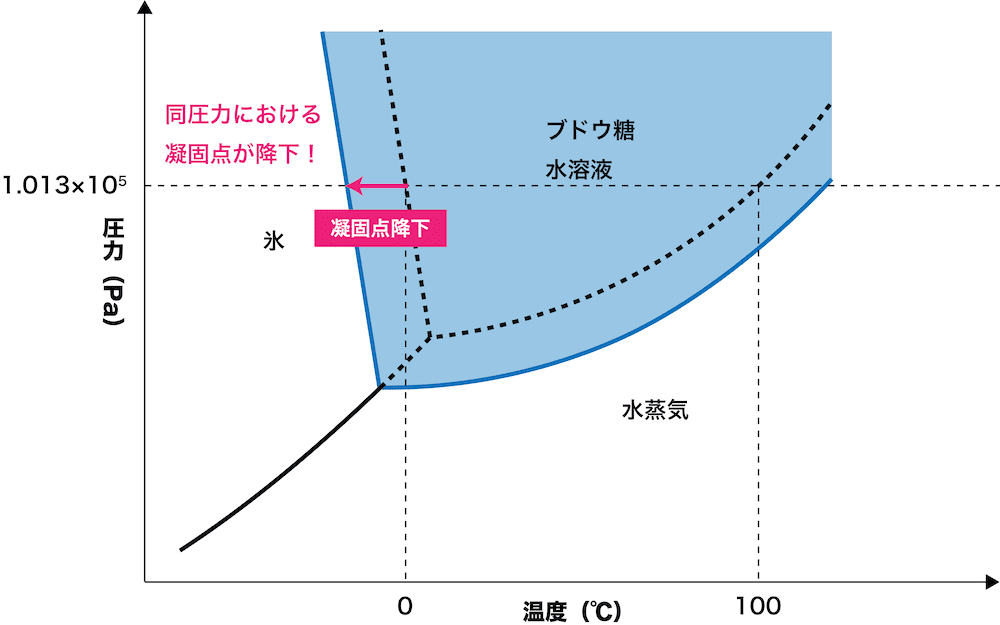
- グラフをみると、凝固点は水よりもブドウ糖水溶液の方が低くなっていることが確認できる。
凝固点降下の公式
- 凝固点降下に関連した有名な公式を紹介する。
●凝固点降下の公式
ΔTf = Kf・m
ΔTf:凝固点降下度
Kf:モル凝固点降下(K・kg/mol)(定数:溶媒に固有)
m:質量モル濃度(mol/kg)
- ΔTfは凝固点降下度といい、モル凝固点降下Kf(溶媒によって決まる値)と質量モル濃度をかけたものである。
凝固点降下の計算問題
- ここでは、入試で頻出の「スクロース(ショ糖)の沸点上昇度を求める問題」と「塩化カルシウムの凝固点を求める問題」の解き方を紹介する。
塩化ナトリウムの凝固点降下度を求める問題
質量モル濃度が0.100(mol/kg)である塩化ナトリウム水溶液の凝固点降下度はいくつか。ただし、水のモル凝固点降下は1.85(K・kg/mol)とする。
- 先ほど紹介した沸点上昇の公式を用いると、次のような式をたてることができる。
\[ \begin{align} ΔT_{f} &= K_{f}・m \\
&= 1.85×0.100 \\
&= 0.185 \end{align} \]
塩化カルシウムの凝固点を求める問題
1.11gの塩化カルシウムCaCl2を300gの水に溶かして塩化カルシウム水溶液を調製した。この溶液の凝固点は何℃か。ただし、水のモル凝固点降下は1.85(K・kg/mol)、各原子の原子量はCa=40、Cl=35.5とする。
- 先ほど紹介した凝固点降下の公式を用いると、次のような式をたてることができる。
\[ \begin{align} ΔT_{f} &= K_{f}・m \\
&= 1.85×\frac{ \frac{ 1.11\cancel{(\mathrm{g})} }{ 111(\cancel{\mathrm{g}}/\mathrm{mol}) }×3 }{ \frac{ 300 }{ 1000 }(\mathrm{kg}) } \\
&= 0.185 \end{align} \]
- よって、凝固点はー0.185(℃)となる。
- 分子に3をかけているのは、CaCl2が電離した結果、CaCl21molがイオン3mol分(Ca2+が1mol、Clーが2mol)になるからである。
\[ \mathrm{CaCl_{2}→Ca^{2+}+2Cl^{-}} \]
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
溶媒に不揮発性物質(=溶質)を溶かして溶液にすると、溶媒だけのときよりも凝固点が低下する。これを【1】という。
解答/解説:タップで表示
解答:【1】凝固点降下
溶媒に溶質が加わると、凝固点が下がる。この現象を凝固点降下という。

モル凝固点降下は【1(溶質 or 溶媒)】の種類によって決まる。
解答/解説:タップで表示
解答:【1】溶媒
●凝固点降下の公式
ΔTf = Kf・m
ΔTf:凝固点降下度
Kf:モル凝固点降下(K・kg/mol)(定数:溶媒に固有)
m:質量モル濃度(mol/kg)
1.11gの塩化カルシウムCaCl2を600gの水に溶かして塩化カルシウム水溶液を調製した。この溶液の凝固点は何℃か。ただし、水のモル凝固点降下は1.85(K・kg/mol)、各原子の原子量はCa=40、Cl=35.5とする。
解答/解説:タップで表示
解答:ー0.0925℃
凝固点降下の公式を用いて式をたてる。
\[ \begin{align} ΔT_{f} &= K_{f}・m \\
&= 1.85×\frac{ \frac{ 1.11\cancel{(\mathrm{g})} }{ 111(\cancel{\mathrm{g}}/\mathrm{mol}) }×3 }{ \frac{ 600 }{ 1000 }(\mathrm{kg}) } \\
&= 0.0925 \end{align} \]
よって、凝固点はー0.0925(℃)となる。
分子に3をかけているのは、CaCl2が電離した結果、CaCl21molがイオン3mol分(Ca2+が1mol、Clーが2mol)になるからである。
\[ \mathrm{CaCl_{2}→Ca^{2+}+2Cl^{-}} \]














