MENU
沸点上昇(理由・グラフ・計算問題の解き方など)
はじめに
【プロ講師解説】このページでは『沸点上昇(理由・グラフ・計算問題の解き方など)』について解説しています。
沸点上昇とは
- 純溶媒に溶質を溶かすと、気体に変わる溶媒分子数が減少する。
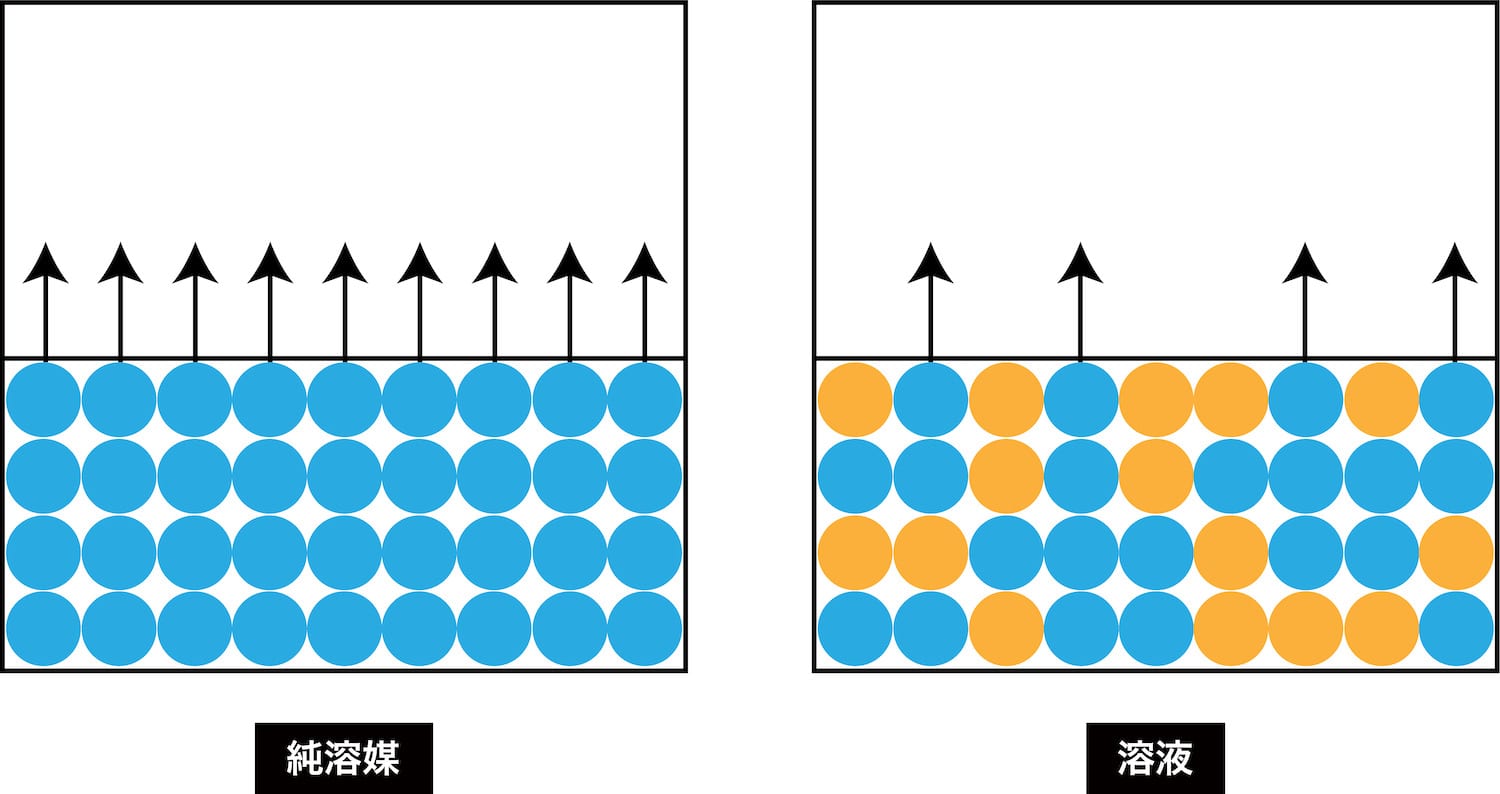
- つまり、沸点が上がることになり、これを沸点上昇という。
沸点上昇のグラフ
水の状態図は次の通りである。

- 水にブドウ糖などの溶質を溶解させると状態図は次のようになる。
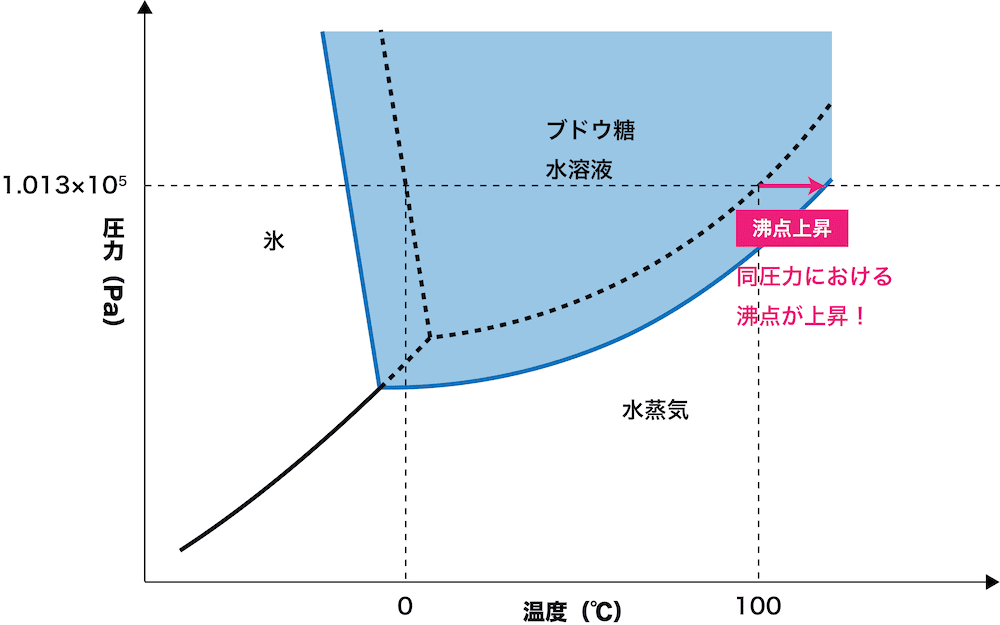
- グラフより、沸点は純水よりもブドウ糖水溶液の方が高いことが確認できる。
沸点が上がる理由
- 沸点とは蒸気圧が外圧(大気圧)を上回る温度である。
- 溶質があることで蒸気圧が下がるため(蒸気圧降下)、蒸気圧が外圧以上になるためにはより多くの加熱が必要になる。その結果、沸点が上昇する。
沸点上昇の公式
- 沸点上昇に関連した有名な公式を紹介する。
●沸点上昇の公式
ΔTb = Kb・m
ΔTb:沸点上昇度
Kb:モル沸点上昇(K・kg/mol)(定数:溶媒に固有)
m:質量モル濃度(mol/kg)
- ΔTbは沸点上昇度といい、モル沸点上昇Kb(溶媒によって決まる値)と質量モル濃度mをかけたものである。
沸点上昇の計算問題
- ここでは、入試で頻出の「スクロース(ショ糖)の沸点上昇度を求める問題」と「スクロース(ショ糖)の沸点を求める問題」の解き方を紹介する。
スクロース(ショ糖)の沸点上昇度を求める問題
質量モル濃度が0.10(mol/kg)であるスクロース水溶液の沸点上昇度はいくつか。ただし、水のモル沸点上昇は0.52(K・kg/mol)とする。
- 先ほど紹介した沸点上昇の公式を用いると、次のような式をたてることができる。
\[ \begin{align} ΔT_{b}&=K_{b}・m \\
&= 0.52×0.10\\
&= 0.052 \end{align} \]
スクロース(ショ糖)の沸点を求める問題
スクロースC12H22O1168.4gを400gの水に溶かしてできたスクロース水溶液の沸点は何℃か。ただし、水のモル沸点上昇は0.52(K・kg/mol)で、原子量はH=1,C=12、O=16とする。
- 先ほど紹介した沸点上昇の公式を用いると、次のような式をたてることができる。
\[ \begin{align} ΔT_{b}&=K_{b}・m \\
&= 0.52×\frac{ \frac{ 68.4 }{ 342 } }{ \frac{ 400 }{ 1000 } }\\
&= 0.26 \end{align} \]
- よって、沸点は100.26(℃)となる。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
溶媒に溶質を加えると、一般に沸騰する温度(=沸点)は上昇する。これを【1】という。
解答/解説:タップで表示
解答:【1】沸点上昇
純溶媒に溶質を溶かすと、気体に変わる溶媒分子数が減少する。

つまり、沸点が上がることになり、これを沸点上昇という。
スクロースC12H22O1168.4gを200gの水に溶かしてできた水溶液の沸点は何℃か。
解答/解説:タップで表示
解答:100.52℃
\[ \begin{align} ΔT_{b}&=K_{b}・m \\
&= 0.52×\frac{ \frac{ 68.4 }{ 342 } }{ \frac{ 200 }{ 1000 } }\\
&= 0.52 \end{align} \]
グルコースC6H12O690gを200gの水に溶かしてできた水溶液の沸点は何℃か。
解答/解説:タップで表示
解答:101.3℃
\[ \begin{align} ΔT_{b}&=K_{b}・m \\
&= 0.52×\frac{ \frac{ 68.4 }{ 342 } }{ \frac{ 200 }{ 1000 } }\\
&= 0.52 \end{align} \]
尿素CO(NH2)212gを400gの水に溶かしてできた水溶液の沸点は何℃か。
解答/解説:タップで表示
解答:100.26℃
\[ \begin{align} ΔT_{b}&=K_{b}・m \\
&= 0.52×\frac{ \frac{ 12 }{ 60 } }{ \frac{ 400 }{ 1000 } }\\
&= 0.26 \end{align} \]
ある非電解質3.0gを測りとり100gの水に溶かした。水溶液が100.26℃で沸騰したとすると、この非電解質の分子量はいくつと考えられるか。
解答/解説:タップで表示
解答:60
沸点が100.26℃ということは沸点上昇度は0.26なので、分子量をx(g/mol)とおくと次のような式をたてることができる。
\[ \begin{align} &ΔT_{b}=K_{b}・m \\
↔︎&0.26= 0.52×\frac{ \frac{ 3.0 }{ x } }{ \frac{ 100 }{ 1000 } }\\
↔︎&x= 60 \end{align} \]
ある非電解質6.0gを測りとり100gの水に溶かした。水溶液が101.04℃で沸騰したとすると、この非電解質の分子量はいくつと考えられるか。
解答/解説:タップで表示
解答:30
沸点が101.04℃ということは沸点上昇度は1.04なので、分子量をx(g/mol)とおくと次のような式をたてることができる。
\[ \begin{align} &ΔT_{b}=K_{b}・m \\
↔︎&1.04= 0.52×\frac{ \frac{ 6.0 }{ x } }{ \frac{ 100 }{ 1000 } }\\
↔︎&x= 30 \end{align} \]