MENU
アルミニウムの工業的製法「ボーキサイトの精錬・融解塩電解」(仕組み・氷晶石を入れる理由など)
はじめに
【プロ講師解説】このページでは『アルミニウムの工業的製法「ボーキサイトの精錬・融解塩電解」(仕組み・氷晶石を入れる理由など)』について解説しています。
アルミニウムの製法概要
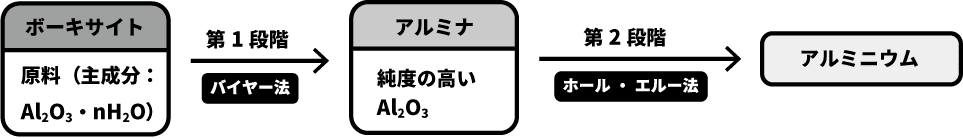
- アルミニウム Alの製法は大きく2段階に分けることができる。
- 1段階では、原料のボーキサイトから純度の高い酸化アルミニウムAl2O3(アルミナ)を得る。これをバイヤー法という。
- 2段階では、アルミナの電気分解によりアルミニウムを得る。これをホール・エール法という。
- このページでは、バイヤー法およびホール・エール法について、順を追って解説する。
バイヤー法(アルミの製法 第1段階)
- 原料鉱石のボーキサイト(主成分:Al2O3・nH2O)から純度の高い酸化アルミニウムAl2O3(アルミナ)を得る方法をバイヤー法という。
- バイヤー法について、次の3STEPで解説する。
●STEP1
ボーキサイトを濃水酸化ナトリウム水溶液に溶かして[Al(OH)4]-を得る
●STEP2
STEP1でつくった溶液のろ液を大量の水で薄め、Al(OH)3の沈殿を得る
●STEP3
Al(OH)3を強熱し、純度の高いAl2O3(アルミナ)を得る
まずは、原料鉱石のボーキサイト(主成分:Al2O3・nH2O)を濃水酸化ナトリウムNaOH水溶液に溶かすことで[Al(OH)4]-を得る。
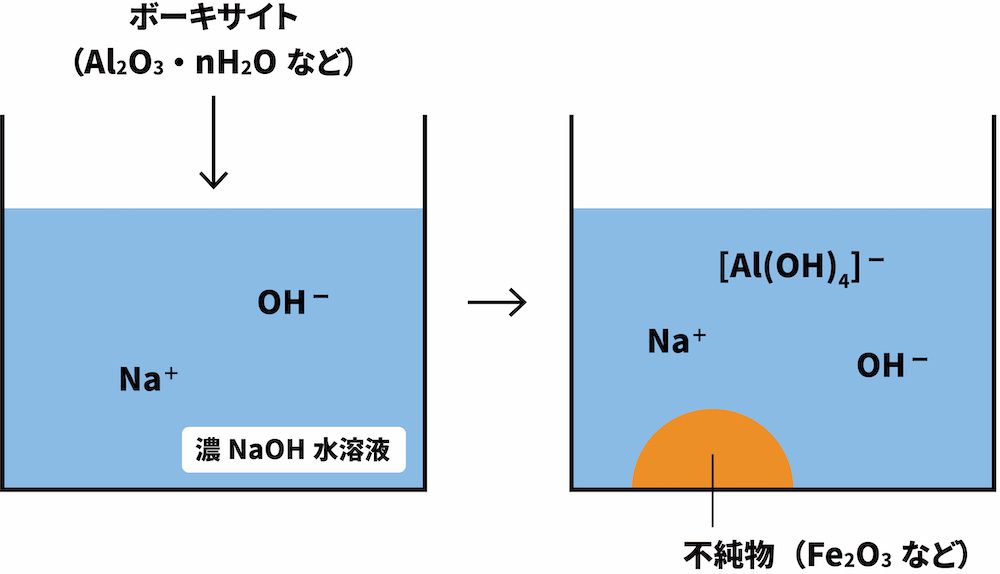
\[ \mathrm{Al_{2}O_{3}+2NaOH+3H_{2}O →2Na[Al(OH)_{4}]} \]
この反応は代表的な両性酸化物と塩基の反応である。詳しくは次のページを参照のこと。
なお、ボーキサイト中の反応しなかった不純物(酸化鉄(Ⅲ)Fe2O3など)は沈殿するため、ろ過により除去する。
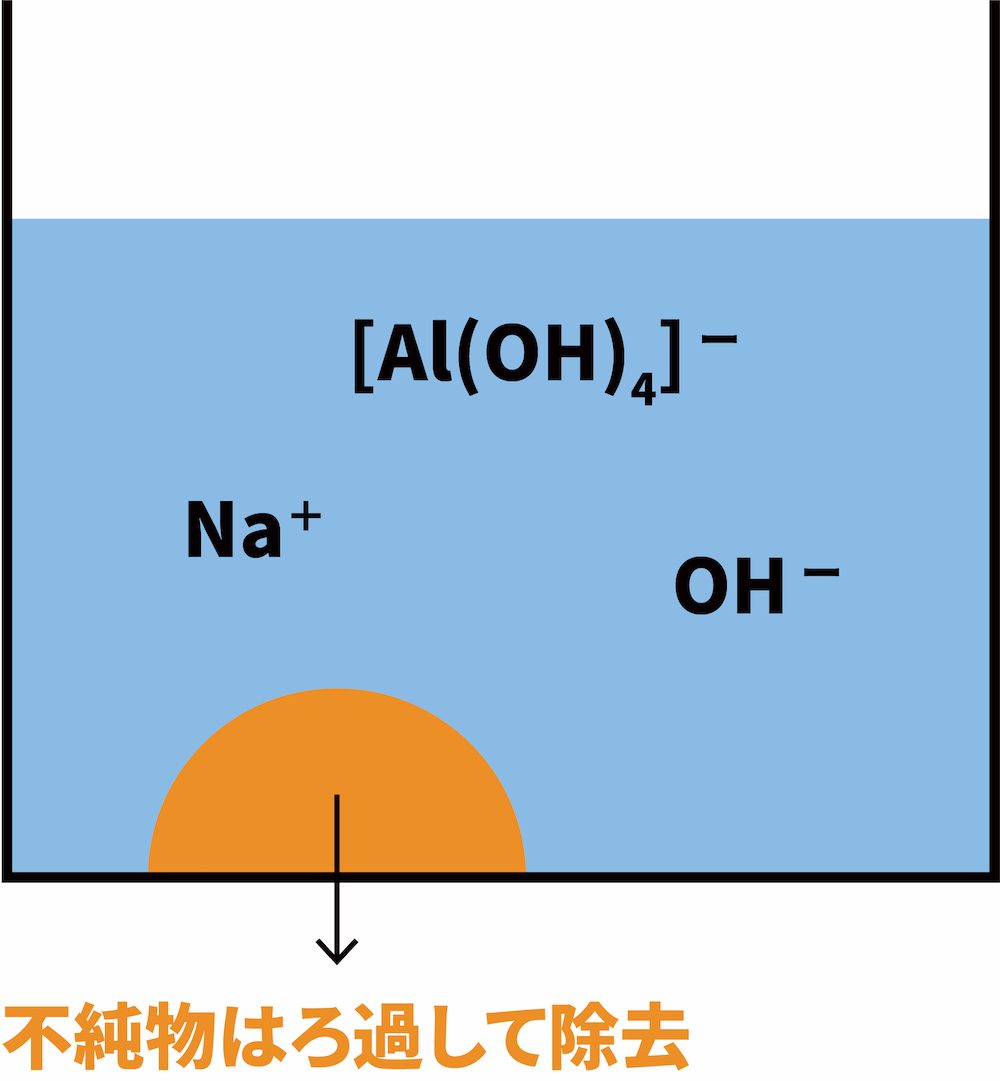
STEP1の溶液を大量の水で薄めてpHを下げる。
pHを下げるとルシャトリエの原理により、次の平衡が右に移動して水酸化アルミニウムAl(OH)3の白色沈殿ができる。
\[ \mathrm{[Al(OH)_{4}]^{-}⇄Al(OH)_{3}↓+OH^{-}} \]
最後に、Al(OH)3を強熱し、純度の高いAl2O3(アルミナ)を得る。
\[ \mathrm{2Al(OH)_{3}→Al_{2}O_{3}+3H_{2}O} \]
この反応は、水酸化物の熱分解反応である。熱分解反応について詳しくは次のページを参照のこと。
ホール・エール法(アルミの製法 第2段階)
- アルミナの電気分解(融解塩電解)によりアルミニウムを得る方法をホール・エール法という。
- ホール・エール法について、次のSTEPで解説する。
●STEP1
氷晶石を用いてアルミナAl2O3を融解させる
●STEP2
陽極でO2-がe-を離し、COやCO2が発生する
●STEP3
陰極でAl3+がe-を受け取り、純粋なアルミニウムを得る
アルミナAl2O3の融点は2000℃と非常に高く、ここまで加熱するにはコストが多くかかる。
したがって、融点降下剤である氷晶石を加えることで1000℃以下まで融点を下げ、Al2O3を効率よく融解させる。
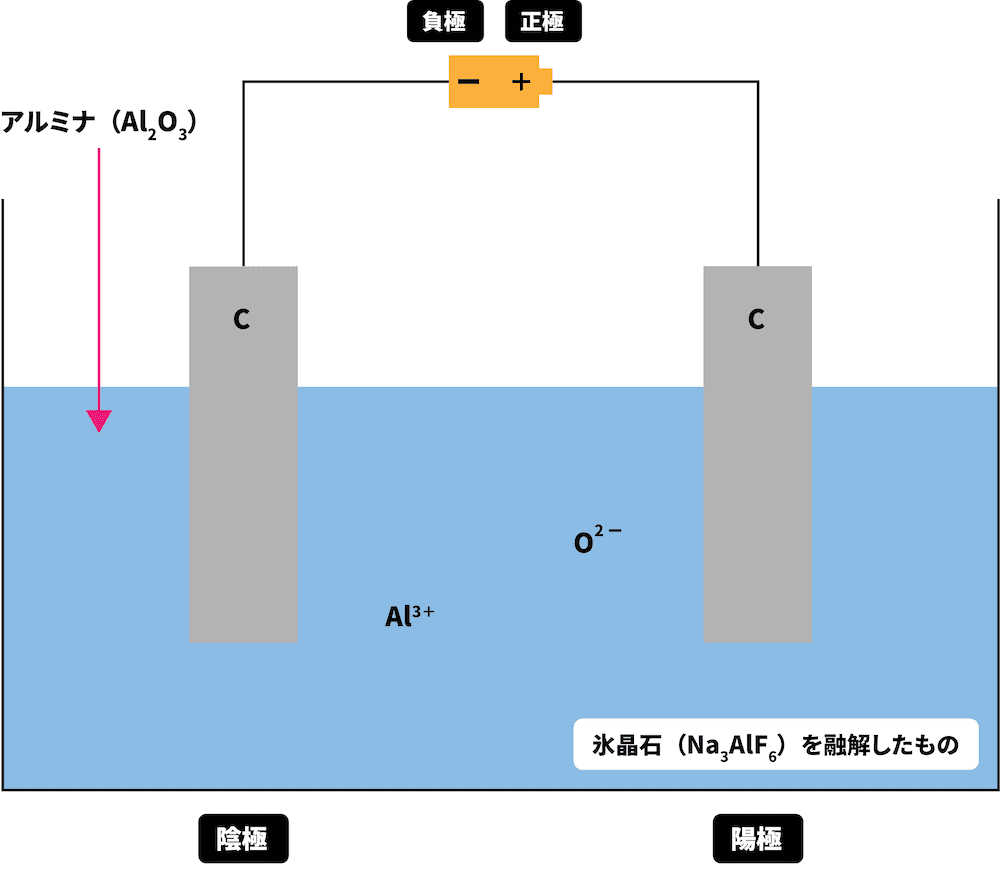
この溶液中には、 Al3+とO2-が存在する。
\[ \mathrm{Al_{2}O_{3} → 2Al^{3+} + 3O^{2-}} \]
次に、溶液中のO2-が陽極でe-を離し、COやCO2が発生する。
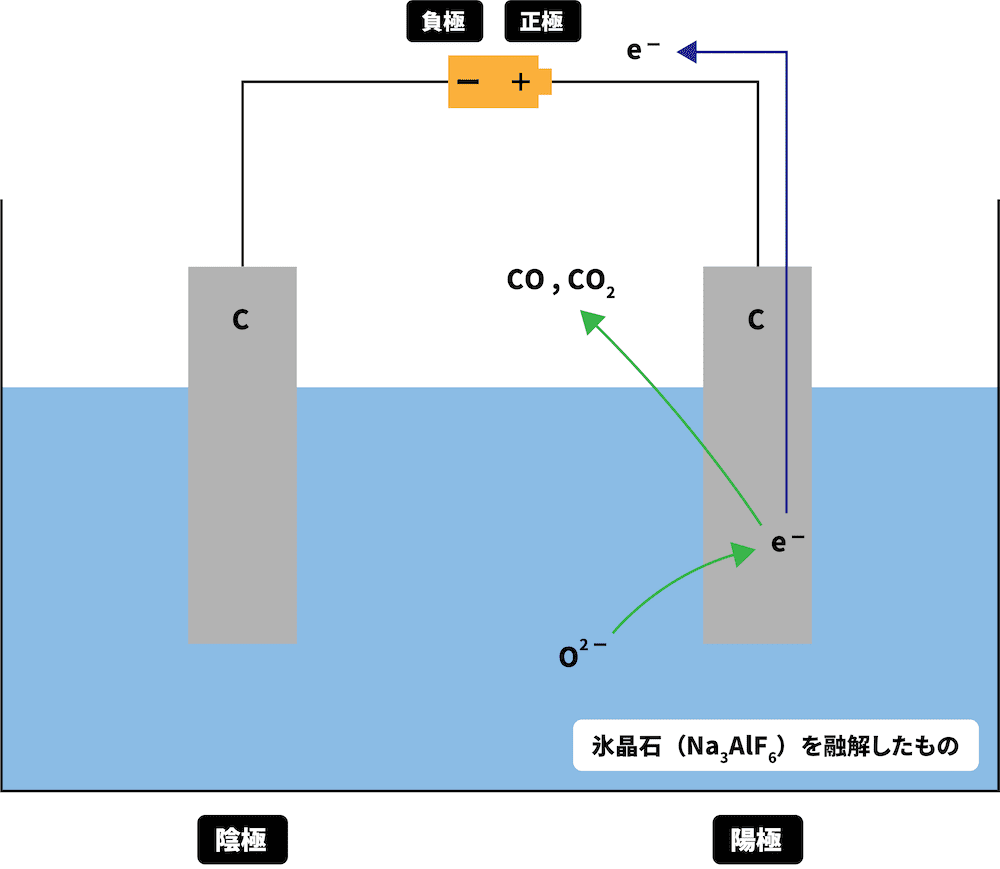
\[ \mathrm{C + O^{2-} → CO + 2e^{-}}\\
\mathrm{C + 2O^{2-} → CO_{2} + 4e^{-}} \]
このとき電極に渡されたe-は陰極側へと移動する。
最後に、陽極側から流れてきたe-を、陰極でAl3+が受け取り、純粋なアルミニウムを得る。
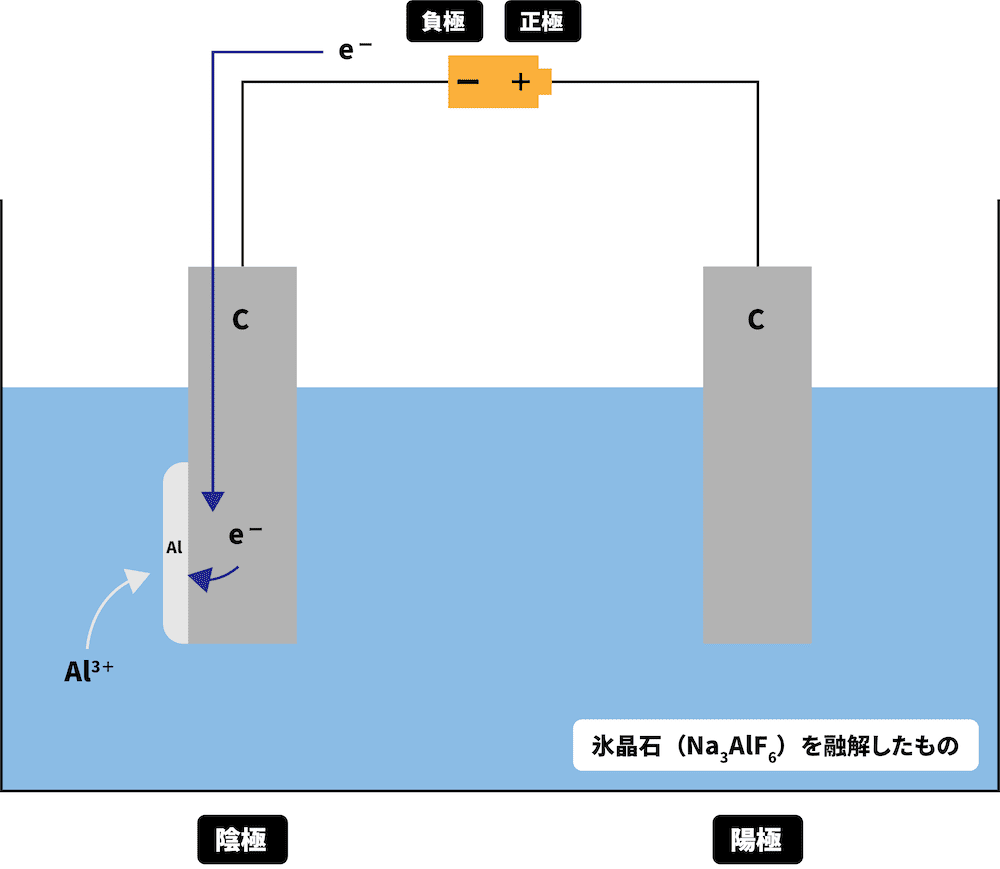
\[ \mathrm{Al^{3+} + 3e^{-} → Al} \]
なぜAl3+水溶液の電気分解ではダメなのか
- 次のような疑問をもつ人は非常に多い。
「融解塩電解なんて面倒なことせずに、普通にAl3+の入った水溶液を電気分解すればいいんじゃないの?」
- これはイオン化傾向の知識を元に説明することができる。
- Al3+とH+のイオン化傾向を比べると、Al3+の方が高い。
- したがって、H2Oから電離したH+が存在する”水溶液”の場合、負極からきたeーを受け取って(イオンから)単体になるのはH+の方になり、結果的に目的であるAlの単体を得ることが難しくなる。
- これが、アルミニウムの製法としてAl3+を含む水溶液の電気分解ではなく、融解塩電解が使われる理由である。














