MENU
ルシャトリエの原理(温度・圧力変化・希ガスを加えた場合など)
はじめに
【プロ講師解説】このページでは『ルシャトリエの原理(温度・圧力変化・希ガスを加えた場合など)』について解説しています。
ルシャトリエの原理とは
- 平衡状態にある可逆反応の条件を変化させると、その変化を和らげる方向に平衡が移動する。これをルシャトリエの原理という。
\[ \mathrm{N_{2}+3H_{2}⇄2NH_{3}+92kJ} \]
- この反応が平衡状態に達しているとき、次の操作を行うとどのような変化が起こるかを考える。
操作1「窒素(N2)を加える」
- 繰り返すが、ルシャトリエの原理によると「条件を変化させるとその変化を和らげる方向に平衡が移動」する。したがって、N2を加えるという操作を行うと、「N2を減らす方向」に平衡が移動する。
\[ \mathrm{N_{2}+3H_{2}\textcolor{#dc143c}{ → }2NH_{3}+92kJ} \]
- この反応だと式の左側にN2があるので、N2を減らす方向、つまり「右向き」に平衡が移動する。
操作2「水素(H2)を除去する」
- H2を除去すると、「H2を増やす方向」に平衡が移動する。
\[ \mathrm{N_{2}+3H_{2}\textcolor{#dc143c}{ ← }2NH_{3}+92kJ} \]
- この反応だと、左向きに移動する。
条件による平衡の移動
- 上で紹介した2つ以外にも、いろいろなパターンを考えてみよう。ここからも引き続きこの反応を例に説明していく。
\[ \mathrm{N_{2}+3H_{2}⇄2NH_{3}+92kJ} \]
温度変化
- 温度が変化すると、平衡が移動する。
温度を上げる
- 温度を上げると、ルシャトリエの原理にしたがい「温度を下げる方向」に平衡が移動する。
\[ \mathrm{N_{2}+3H_{2}⇄2NH_{3}\textcolor{#dc143c}{ +92kJ }} \]
- この反応は、反応式の後ろに「+92kJ」が付いている。「+」ということは「発熱反応」なので、「右側に行く反応(→)=温度を上げる反応」ということになる。
- したがって、温度を下げる反応は、逆の左側に行く反応(←)なので、温度を上げると平衡は左側に移動する。
\[ \mathrm{N_{2}+3H_{2}\textcolor{#dc143c}{ ← }2NH_{3}+92kJ} \]
温度を下げる
- 温度を下げると、ルシャトリエの原理に従い「温度を上げる方向」に平衡が移動する。
- 上で説明したように、この反応は右側に行く反応(→)が発熱反応(温度を上げる反応)なので、平衡は右方向に移動する。
\[ \mathrm{N_{2}+3H_{2}\textcolor{#dc143c}{ → }2NH_{3}+92kJ} \]
圧力変化
- 圧力が変化すると、平衡が移動する。
圧力を上げる
- 圧力を上げると、ルシャトリエの原理に従い「圧力を下げる方向」に平衡が移動する。

- 圧力は気体分子数が多いほど高くなる。
- 今回の反応では、左側の方が気体分子数が多く圧力が高い。したがって、圧力を上げた場合、圧力の低い右側の方に平衡が移動する。
\[ \mathrm{N_{2}+3H_{2}\textcolor{#dc143c}{ → }2NH_{3}+92kJ} \]
圧力を下げる
- 圧力を下げると、ルシャトリエの原理に従い「圧力を上げる方向」に反応が進行する。
\[ \mathrm{N_{2}+3H_{2}\textcolor{#dc143c}{ ← }2NH_{3}+92kJ} \]
- 先ほど説明したように、左側の方が気体分子数が多く圧力が高いので、圧力を下げた場合、左方向へ平衡が移動する。
触媒を加える
- 触媒を加えると、「正反応と逆反応のスピードがともにUP」する。
- しかし、スピードが上がるだけでどちらかに平衡が移動することはない。
反応に関与しない物質を加えた場合
- 希ガスなどの「反応に直接関与しない物質」を加えた場合、少し注意が必要である。
- 「反応に直接関与しない物質は基本ムシ」という視点で考えていこう。
圧力一定で希ガスを加える
- 圧力一定で希ガスを入れたとき、希ガスの分だけ体積が増加する。
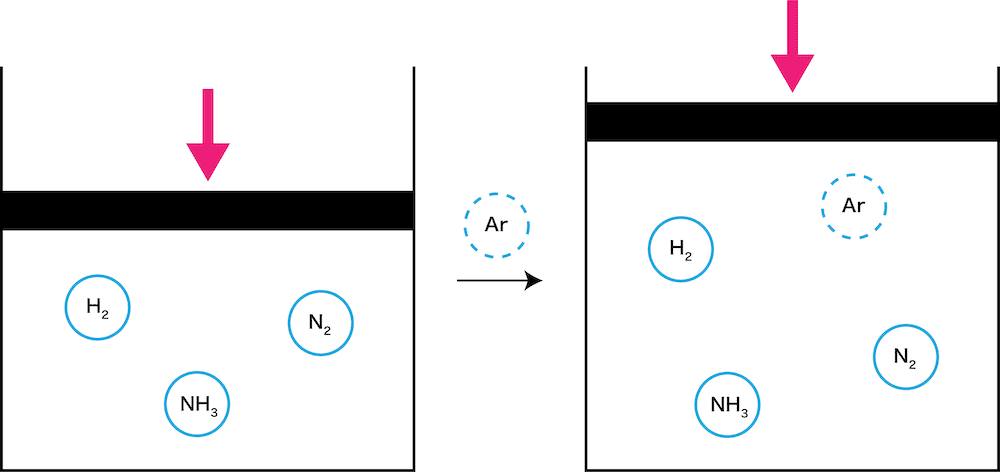
- 容器内にある希ガスArはムシするが、希ガスによって大きくなった体積はムシすることができない。
- 体積が増加したということは、「体積に対する気体の量が少なくなった」と考えることができるので、この反応は、気体分子を増やす方向、つまり左方向に反応が進む。
\[ \mathrm{N_{2}+3H_{2}\textcolor{#dc143c}{ ← }2NH_{3}+92kJ} \]
体積一定で希ガスを加える
- 体積一定で希ガスを加えると、当然体積変化は起こらない。
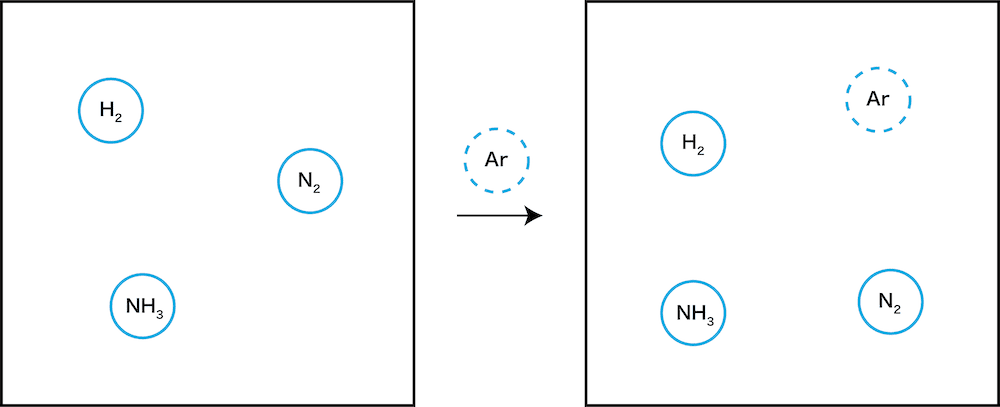
- 体積になんの変化もなく、(最初に述べたように)希ガスは”ムシ”できるので、この場合は「なにも起きていないのと同じ」ということになる。”何も起きていない”ので、当然平衡の移動も起こらない。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
次の可逆反応は平衡状態にある。()内の操作を行ったとき、平衡はどちらに移動するか。「右」「左」「どちらにも移動しない」のいずれかで解答すること。
H2+I2=2HI+92kJ(I2を加える)
解答/解説:タップで表示
解答:右
I2を加えると、ルシャトリエの原理により「I2を減らす方向」に平衡が移動する。したがって、右(→)。
\[ \mathrm{H_{2}+I_{2}\textcolor{#dc143c}{ → }2HI+92kJ} \]
次の可逆反応は平衡状態にある。()内の操作を行ったとき、平衡はどちらに移動するか。「右」「左」「どちらにも移動しない」のいずれかで解答すること。
N2+3H2=2NH3+92kJ(温度を下げる)
解答/解説:タップで表示
解答:右
温度を下げると、ルシャトリエの原理により「温度を上げる方向」に平衡が移動する。この反応は発熱反応なので、右に行くほど熱が出る(=温度が上がる)。したがって、右(→)。
\[ \mathrm{N_{2}+3H_{2}\textcolor{#dc143c}{ → }2NH_{3}+92kJ} \]
次の可逆反応は平衡状態にある。()内の操作を行ったとき、平衡はどちらに移動するか。「右」「左」「どちらにも移動しない」のいずれかで解答すること。
4NH3+5O2=4NO+6H2O+906kJ(加圧する)
解答/解説:タップで表示
解答:左
加圧する(圧力を加える)と、ルシャトリエの原理により「圧力を減らす方向」に平衡が移動する。この反応の左側は気体分子が9コ、右側は10コなので、左側の方が圧力が低い。したがって、左(←)
\[ \mathrm{4NH_{3}+5O_{2}\textcolor{#dc143c}{ ← }4NO+6H_{2}O+906kJ} \]
次の可逆反応は平衡状態にある。()内の操作を行ったとき、平衡はどちらに移動するか。「右」「左」「どちらにも移動しない」のいずれかで解答すること。
N2+O2=2NO+181kJ(NOを加える)
解答/解説:タップで表示
解答:左
NOを加えると、ルシャトリエの原理により「NOを減らす方向」に平衡が移動する。したがって、左(←)。
\[ \mathrm{N_{2}+O_{2}\textcolor{#dc143c}{ ← }2NO+181kJ }\]
次の可逆反応は平衡状態にある。()内の操作を行ったとき、平衡はどちらに移動するか。「右」「左」「どちらにも移動しない」のいずれかで解答すること。
2SO2+O2=2SO3+197kJ(体積一定でArを加える)
解答/解説:タップで表示
解答:どちらにも移動しない
体積一定でAr(アルゴン/希ガスの1つ)を加えても、(希ガスは基本的にムシするので)平衡は移動しない。
\[ \mathrm{2SO_{2}+O_{2}=2SO_{3}+197kJ} \]














