MENU
物質の三態と状態図
目次
はじめに
【プロ講師解説】このページでは『物質の三態と状態図』について解説しています。
物質の三態とは
- 全ての物質には固体・液体・気体の3つの状態が存在し、これらのことを物質の三態という。(例:氷・水・水蒸気)
- また、物質の状態は温度と圧力によって変化し、この変化のことを状態変化という。
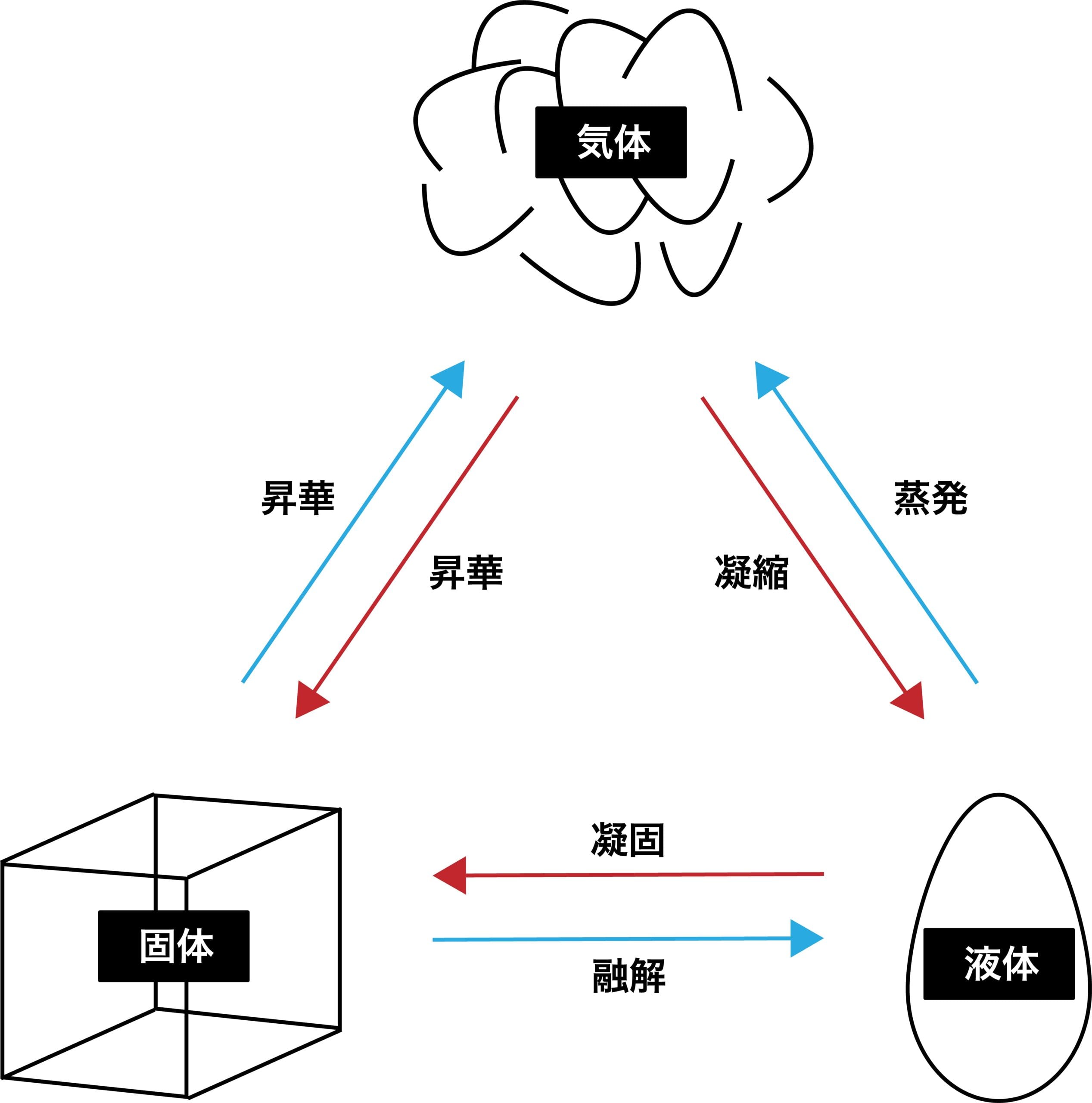
- 固体が液体になることを融解、液体が固体になることを凝固、液体が気体になることを蒸発、気体が液体になることを凝縮、固体が気体になることを昇華、気体が固体になることを凝華という。
- また、状態変化が起こる温度を表す次の用語は覚えておこう。
| 融点 | 固体が融解して液体になる温度 |
| 凝固点 | 液体が凝固して固体になる温度 |
| 沸点 | 液体が沸騰して気体になる温度 |
物質の三態とは
- 温度による物質の状態変化を表した次の図を状態図という。
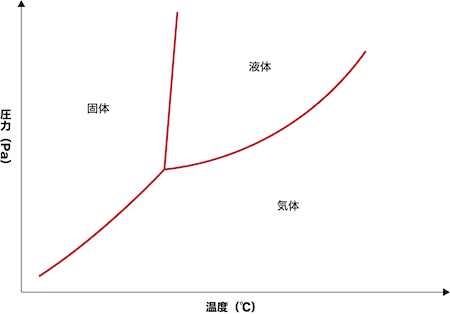
二酸化炭素の状態図
- 次の図は二酸化炭素の状態図である。各領域の境界線は2つの状態が共存している状態、点Xは三重点という3つの状態が共存している状態である。
- 点Zは臨界点、領域Yは液体・気体の区別ができない状態であり超臨界状態とよばれる。
- また、超臨界状態にある物質を超臨界流体という。

水の状態図
- 水の状態図は二酸化炭素のものとは異なる。
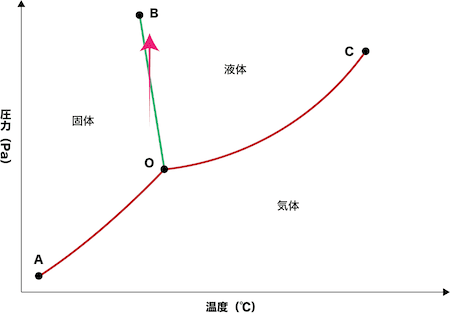
- 氷と水の構造〜水素結合・密度の違いなど〜にあるように、氷は水分子が水素結合で配列した隙間の多い構造が長距離にわたって続くため、液体の水より体積が大きい。水の状態図のOBの境界線が左上がりになっているのは、温度一定で圧力をかけていくと、どこかで氷の隙間の多い構造が破壊され、より隙間の少ない液体の水になるからである。
状態変化のグラフ
- 固体に熱を加えていくと、固体→液体→気体という流れで状態変化していく。状態変化している間は温度は下がらず一定となる。
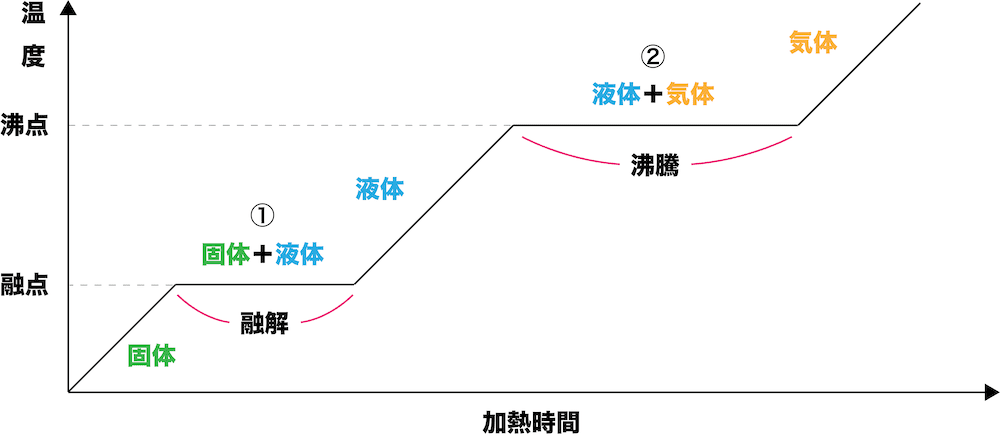
①(固体→液体、液体→固体)
- 固体に熱を加えていくと固体の温度が上昇するが、ある温度に達すると液体に変化し始め、温度が一定に保たれる。これは加えた熱が全て状態変化に使われるためである。この段階を経て、固体は完全に液体となる。
- 固体が液体になる変化を融解、融解が始まる温度を融点という。
- 一方、液体を冷却していくと液体の温度が降下し、ある温度に達すると固体に変化し始める。このように、液体が固体になる変化を凝固、凝固が始まる温度を凝固点という。融点と凝固点は一致する。
②(液体→気体、気体→液体)
- 液体が気体になる変化を蒸発という。
- 物質によるが、蒸発は常温でも見ることができる。例えば、水滴をしばらく放っておけばいつの間にか無くなる。これは水が常温でも蒸発しているからである。蒸発は液面付近で運動エネルギーの大きい粒子が粒子間の引力を振り切って飛び出していくために起こる。
- 液体に熱を加えていくと液体の温度が上昇し、液体内部からも気体が発生する現象が起こる。これを沸騰といい、沸騰が始まる温度を沸点という。融解同様、沸騰が起こっている間、温度は一定に保たれる。
- 一方、気体を冷却すると気体の温度が低下し、液体に変化する。このように、気体が液体になる変化を凝縮、凝縮が始まる温度を凝縮点という。沸点と凝縮点は一致する。
③(固体→気体、気体→固体)
- 通常、固体の結合が一部切れて液体へ、残りの結合が全て切れて気体へ状態変化するが、引力の小さい物質は一気に全ての結合が切れて固体から直接気体に変化する。このように、固体が直接気体になる変化を昇華という。また、気体→固体の変化も同様に昇華という。
- 昇華性をもつ物質として覚えておくべきものは「ドライアイス・ヨウ素・ナフタレン」の3つである。














