MENU
揮発性酸遊離反応(原理・例・濃硫酸を使う理由など)
目次
はじめに
【プロ講師解説】このページでは『揮発性酸遊離反応(原理・例・濃硫酸を使う理由など)』について解説しています。
揮発性酸遊離反応とは
- 揮発性の酸(蒸発しやすい酸)を含む塩に、不揮発性の酸(蒸発しにくい酸)を加えて加熱することで、揮発性の酸を取り出す反応を不揮発性酸遊離反応という。
\[
揮発性の酸を含む塩+不揮発性の酸→揮発性の酸+不揮発性の酸を含む塩
\]
- 揮発性酸遊離反応の例として「塩化ナトリウムNaClと濃硫酸H2SO4の反応」を紹介する。
\[
\mathrm{NaCl+H_{2}SO_{4}\overset{加熱}{→}HCl+NaHSO_{4}}
\]
- NaClは揮発性の酸を含む塩、H2SO4は不揮発性の酸である。
- これらを加熱により反応させると、揮発性の酸である塩化水素HClと、不揮発性の酸を含む塩である硫酸水素ナトリウムNaHSO4が生じる。
揮発性酸遊離反応の原理
- 揮発性酸遊離反応の原理について、先ほどの「塩化ナトリウムNaClと濃硫酸H2SO4の反応」を用いて詳しく解説する。
\[
\mathrm{NaCl+H_{2}SO_{4}\overset{加熱}{→}HCl+NaHSO_{4}}
\]
- H2SO4が不揮発性の酸であるのに対し、HClは揮発性の酸である。したがって、加熱することにより、HClのみが蒸発し、外に逃げる。
●STEP1
揮発性の酸を含む塩が電離する。
●STEP2
不揮発性の酸を含む塩が電離する。
●STEP3
加熱により揮発性の酸が遊離する。
STEP
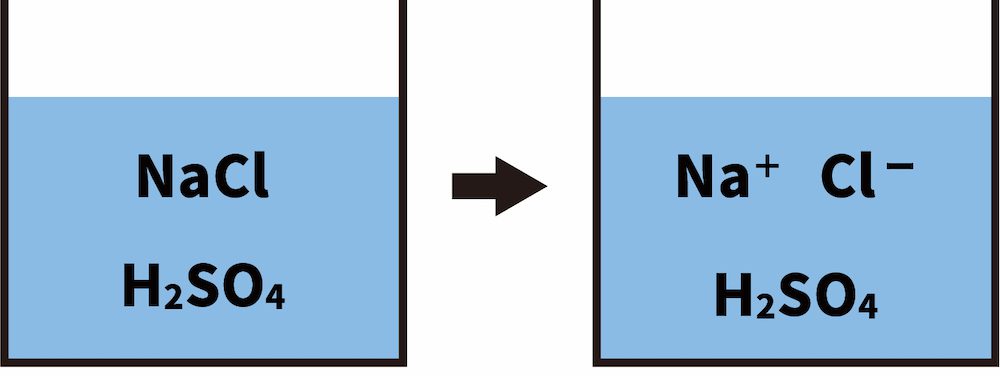
揮発性の酸を含む塩が電離する。
まず、揮発性の酸を含む塩であるNaClが電離する。
STEP
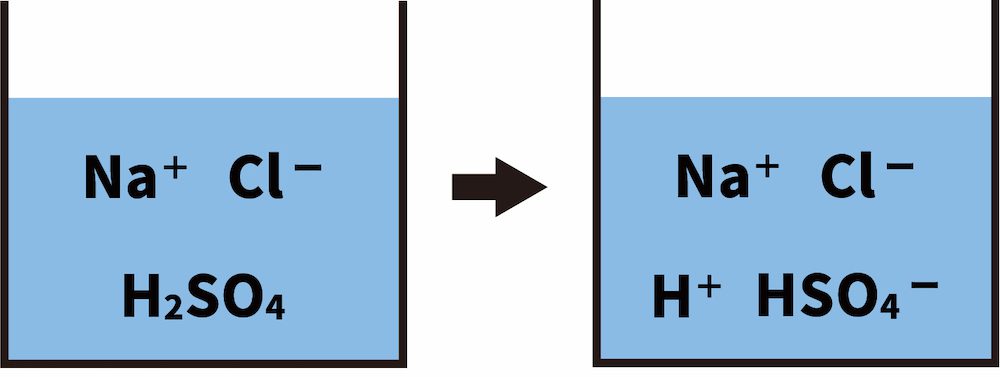
不揮発性の酸を含む塩が電離する。
次に、不揮発性の酸であるH2SO4を含む塩が電離する。
STEP
加熱により揮発性の酸が遊離する。
次に、加熱により揮発性の酸であるHClが遊離する。
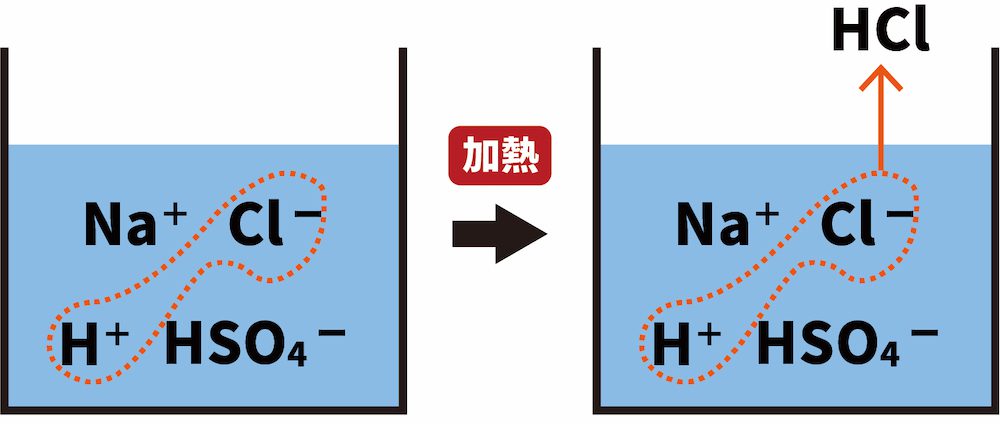
この結果、ルシャトリエの原理により反応が右に進み、多量のHClが得られる。
H2SO4の沸点は非常に高い(300℃台)ため、加熱しても蒸発しません。
揮発性酸遊離反応に加熱は不要?
- 揮発性酸遊離反応は、実は加熱せずとも起こる。
- これは、この反応は酸・塩基反応と捉えることもできるためである。次の反応を用いて説明する。
例)塩化ナトリウムNaCl+濃硫酸H2SO4
\[
\mathrm{NaCl+H_{2}SO_{4}\overset{加熱}{→}HCl+NaHSO_{4}}
\]
- 水溶液中において、HClとH2SO4はともに強酸性を示す。しかし、強酸の中にも強弱が存在し、HClとH2SO4で比較するとH2SO4の方が強い。したがって、弱酸遊離反応により、H2SO4は塩化ナトリウムNaClに水素イオンH+を与えようとする。
- その結果、加熱をせずとも上記の反応は積極的に右に進むことになる。
揮発性酸遊離反応のポイント
- 揮発性酸遊離反応について疑問に感じやすいポイントをまとめる。
●揮発性酸遊離反応のポイント
- 濃硫酸を用いる理由
- NaHSO4で止まる理由
- 濃硫酸は弱酸ではないのか
- 不揮発性の酸の具体例は何か
❶ 濃硫酸を用いる理由
- 揮発性酸遊離反応では、希硫酸ではなく濃硫酸を用いる。
- この理由について考えるため、まず希硫酸(濃”硫酸”を水で”希”釈したもの)を用いた場合にどうなるのかを検討する。
- 塩酸と硫酸はともに強酸だが、強酸の中にも強弱が存在し、塩酸と硫酸で比較すると硫酸の方が強い。したがって、弱酸遊離反応により希硫酸がもつ水素イオンH+を塩化物イオンCl-に押し付けようとする。
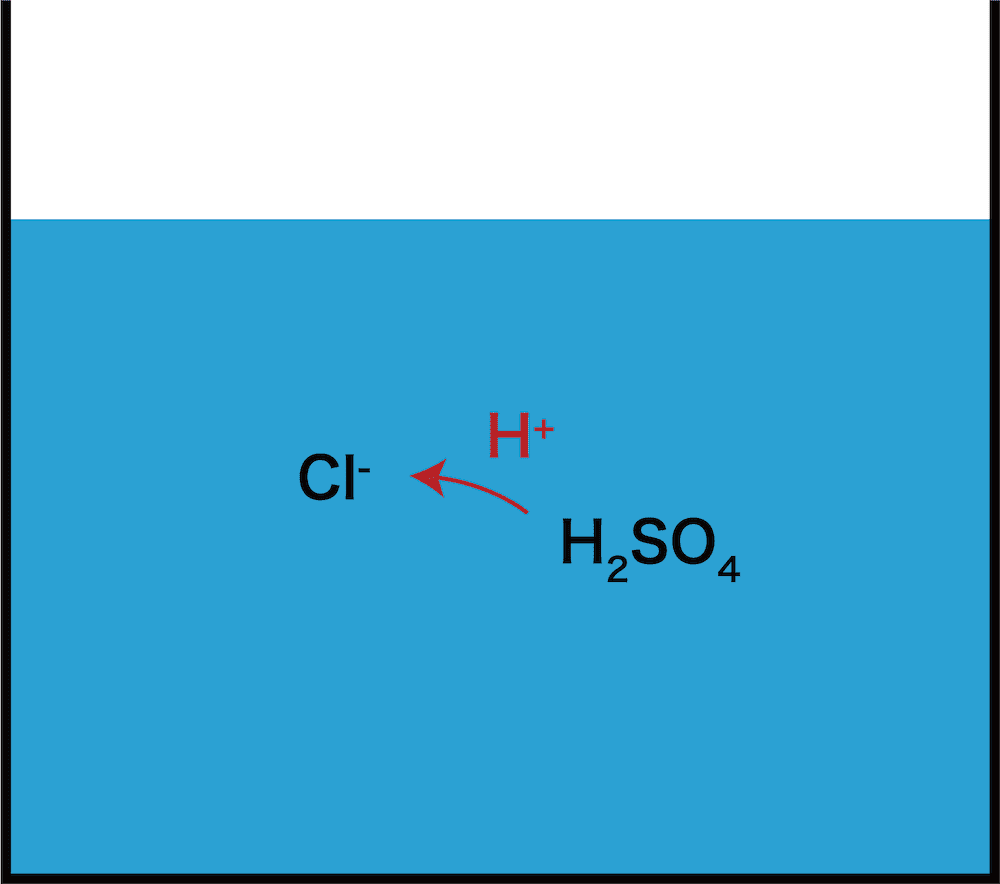
- しかし、希硫酸の場合、溶液中に水H2Oが多く存在する。塩酸も、硫酸より劣るものの強酸なので、酸としてH+を投げる力は十分に強い。したがって、希硫酸から来たH+をH2Oに押し付ける。
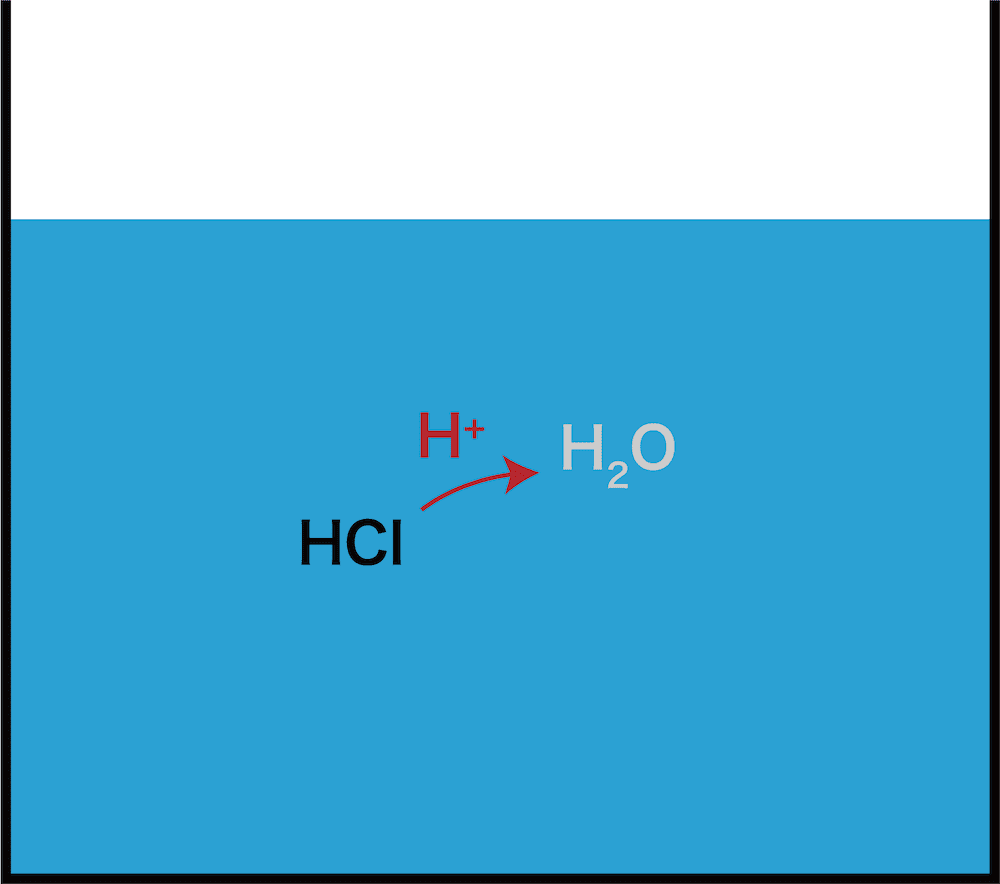
- その結果、塩化ナトリウムに希硫酸を加えた場合、イオンに分かれて普通に溶けるという結果になる。
- 次に、濃硫酸の場合を考える。まず希硫酸と同様に濃硫酸が自身のH+を塩化物イオンCl-に押し付ける。

- 希硫酸であればこの後塩酸はH2OにH+を押し付けようとするが、濃硫酸だと(水で希釈されていないため)溶液中にH2Oがほぼ存在しない。したがって、塩酸はH+を押し付ける相手がいない。
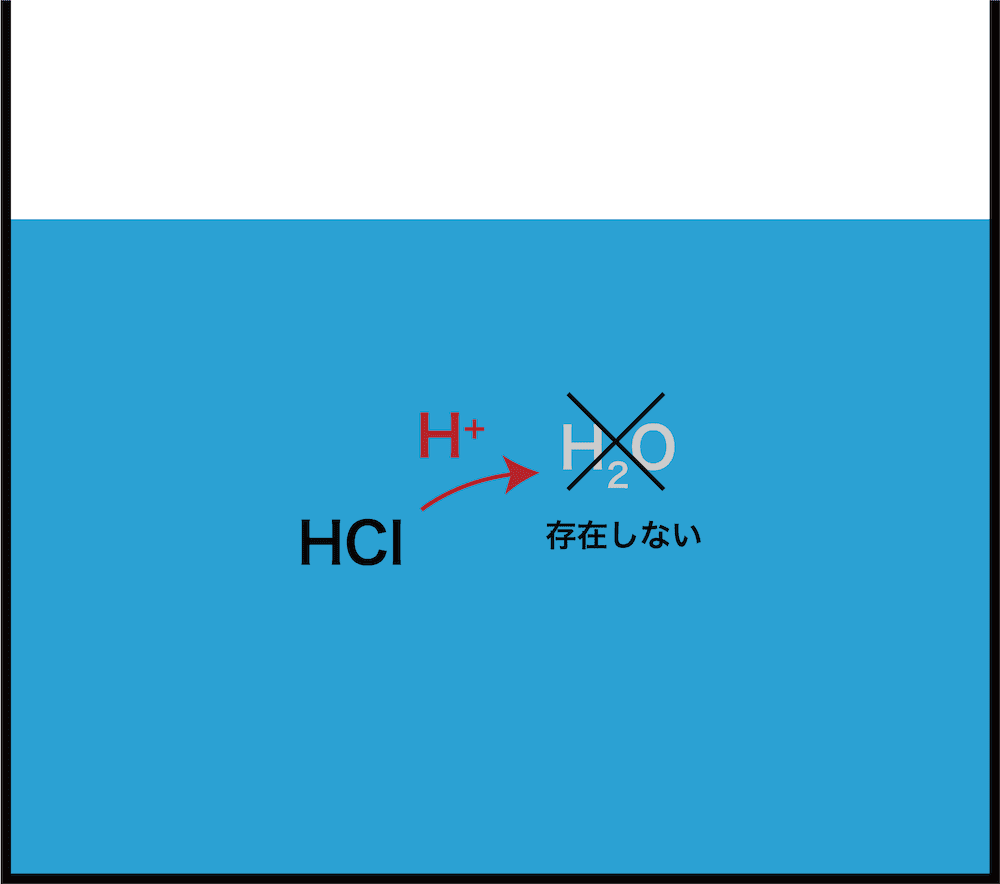
- この状態で加熱をすると、塩酸は揮発性の酸なので蒸発する。
❷ NaHSO4で止まる理由
\[
\mathrm{NaCl+H_{2}SO_{4}\overset{加熱}{→}NaHSO_{4}+HCl}
\]
- この反応式において、H2SO4はNa2SO4までいかずNaHSO4で止まっているが、これは酸の強さの観点から説明できる。
- 硫酸は次のような二段階で電離する。
\[
\mathrm{H_{2}SO_{4}→H^{+}+HSO_{4}^{-}}\\
\mathrm{HSO_{4}^{-}→H^{+}+SO_{4}^{2-}}
\]
- 酸としての強さ(H+の放出しやすさ)はH2SO4(第一電離)>HCl>HSO4ー(第二電離)である。
- HClの方がHSO4ーよりも酸として強力なので、HClがある状態でHSO4ーがH+を放出することはない。
- したがって、H2SO4がNa2SO4までいくことはなく、NaHSO4で止まる。
❸ 濃硫酸は弱酸ではないのか
- 高校化学において、濃硫酸を弱酸と説明される場合があるが、正確には強酸である。
- 濃硫酸が弱酸だという考え方は、「濃硫酸中には水分子がほとんど存在しない」ことからきている。
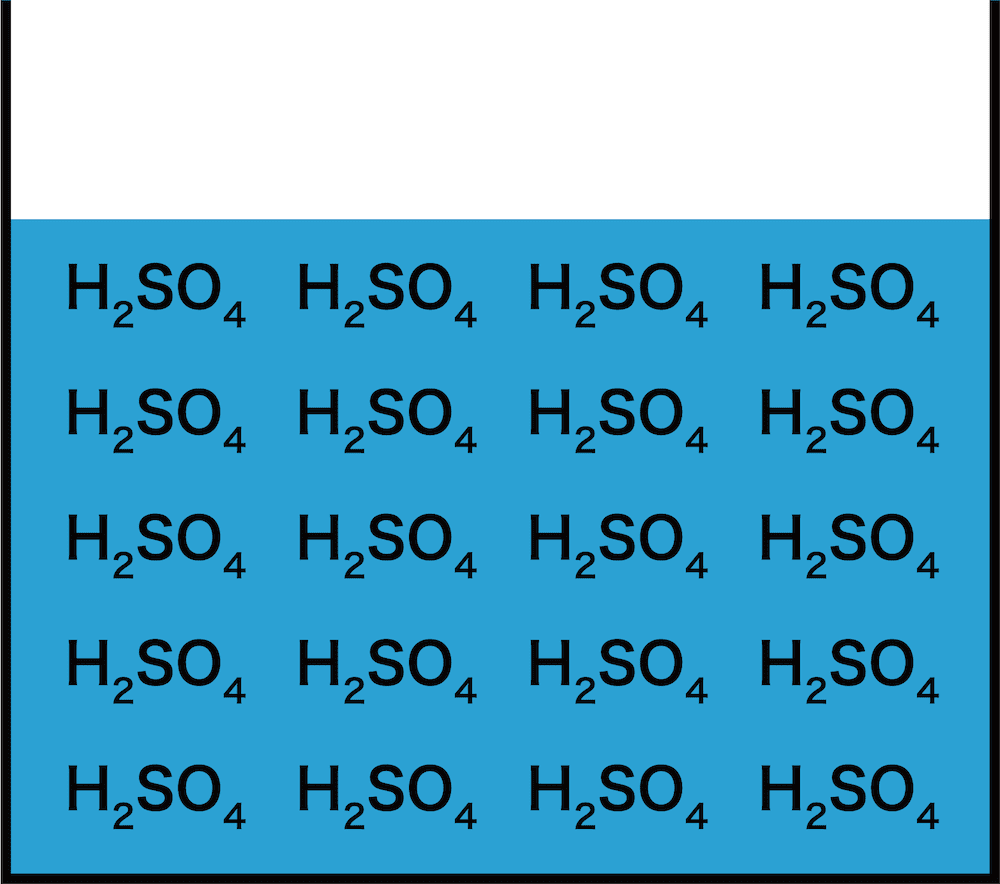
- 濃硫酸の濃度は約98%のため、H+を放出したときに、それを受け取るH2Oがほとんど存在しない。したがって、H+を放出しにくく、事実上弱酸と考えることができる。
- 濃硫酸は決してH+を放出する力そのものが弱いわけではなく、めちゃくちゃ電離したいのに電離できない、言わば欲求不満状態ということである。H+を受け取る相手がいれば、当然H+をたくさん放出する強酸としてはたらく(これが希硫酸)。
❹ 不揮発性の酸の具体例は何か
- 高校化学を学習する上で、不揮発性の酸として覚えておくべきは濃硫酸のみである。
- そのほか、リン酸、過塩素酸なども不揮発性の酸である。
不揮発性酸遊離反応まとめ
この『揮発性酸遊離反応(原理・例・濃硫酸を使う理由など)』のページで解説した内容をまとめる。
- 揮発性の酸(蒸発しやすい酸)を含む塩に、不揮発性の酸(蒸発しにくい酸)を加えて加熱することで、揮発性の酸を取り出す反応を不揮発性酸遊離反応という。
- 代表的な不揮発性の酸は濃硫酸である。














