MENU
遷移元素「銀・金・白金・クロム・マンガン・コバルト・チタン」の単体・化合物の性質や製法など
はじめに
【プロ講師解説】このページでは『遷移元素「銀・金・白金・クロム・マンガン・コバルト・チタン」の単体・化合物の性質や製法など』について解説しています。
銀Ag
- 銀Agの性質・特徴について解説する。
単体
- 銀Agは、全ての金属単体の中で熱・電気伝導性が最大である。
酸化銀
- 酸化銀Ag2Oに過剰のNH3aqを反応させると、錯イオンであるジアンミン銀(Ⅰ)イオン[Ag(NH3)2]+が生成する。
\[ \mathrm{Ag_{2}O(褐色)\overset{過剰のNH_{3}aq}{→} [Ag(NH_{3})_{2}]^{+}} \]
- また、Ag2Oが生成するときの反応は次の通りである。
\[ \mathrm{Ag^{+} \underset{少量のNH_{3}aq}{\overset{NaOHaq}{\longrightarrow}} Ag_{2}O(褐色)} \]
- 銀イオンAg+に少量の塩基を加えると、褐色のAg2Oの沈殿が生成する。
- 具体例として、硝酸銀AgNO3と水酸化ナトリウムNaOHの反応を確認する。
\[ \mathrm{2AgNO_{3} + 2NaOH → Ag_{2}O + 2NaNO_{3} + H_{2}O} \]
硝酸銀AgNO3・臭化銀AgBr
- 銀を含む塩で押さえておくべきは、硝酸銀AgNO3とハロゲン化銀(臭化銀AgBr・塩化銀AgClなど)である。
- AgNO3水溶液は光で分解してしまうため褐色ビンに入れて保存する。
- AgBrやAgClなどのハロゲン化銀は感光性をもち、写真のフィルムなどに用いられる。ハロゲン化銀を利用した写真の現像について詳しくは次のページを参照のこと。
金Au
- 金Auの性質・特徴について解説する。
化学的性質
- 金Auの単体は、イオン化傾向が非常に小さく、化学的に安定である。
- したがって、王水(濃HNO3:濃HCl=1:3)でしか溶かすことができない。
物理的性質
- 金Auは全ての金属単体の中で展性・延性が最大である。
- したがって、加工しやすいため多くの装飾品に使われている。
- 展性・延性について詳しくは次のページを参照のこと。
白金Pt
- 白金Ptは金Auと同様、イオン化傾向が小さく安定している。
- したがって、Ptの単体を溶かすときにもAu同様、王水が必要となる。
- また、Ptは工業用の触媒として用いられることがある。特にオストワルト法の第一段階で利用されていることは頻出である。
クロムCr
- クロムCrの性質・特徴について解説する。
単体
- クロムCrの単体は、不動態をつくりやすく濃硝酸HNO3で溶かすことができない。
- また、Crを含む合金としてステンレス鋼が知られている。ステンレス鋼には Crの他に鉄Fe・ニッケルNiが含まれており、さびにくいためキッチンなどに利用されている。
参考:めっき・合金一覧
化合物
- クロムの化合物として有名なのは、クロム酸カリウムK2CrO4と二クロム酸カリウムK2Cr2O7である。
クロム酸カリウムK2CrO4
- クロム酸カリウム K2CrO4は黄色の結晶で、水溶液の色(=K2CrO4が電離して発生したCrO42-の色)も黄色である。
二クロム酸カリウムK2Cr2O7
- 二クロム酸カリウムK2Cr2O7は赤橙色の結晶で、水溶液の色(=K2Cr2O7が電離して発生したCr2O72-の色)も赤橙色である。
- K2Cr2O7は強力な酸化剤としてはたらく。
\[ \mathrm{Cr_{2}O_{7}^{2-}(赤橙) + 14H^{+} + 6e^{-} → 2Cr^{3+}(緑) + 7H_{2}O} \]
- Cr2O72-は赤橙色であるのに対し、このとき生成するCr3+は緑色である。
- ちなみにこのイオン反応式は”半反応式”とよばれるものであり、次のページの手順にしたがってつくることができる。知らなければ確認しておこう。
参考:半反応式・酸化還元反応式(作り方・覚え方・問題演習など)
CrO42-とCr2O72-の平衡反応
- 水溶液の液性が酸性に傾くと、CrO42-がCr2O72-に、塩基性に傾くとCr2O72-がCrO42-になる。
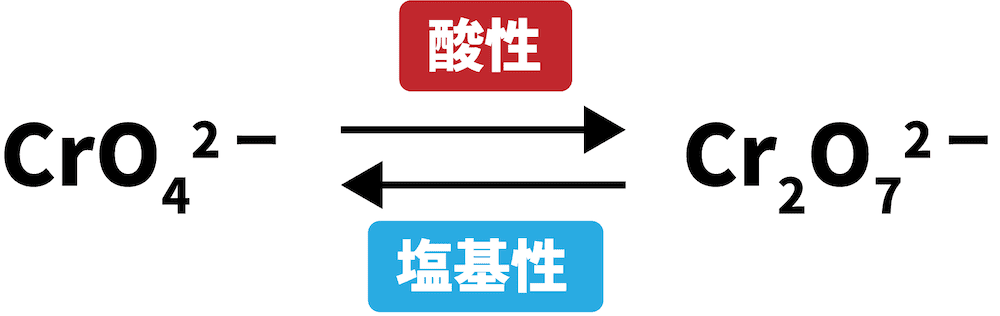
- これは、ルシャトリエの原理によって説明することができる。
\[ \mathrm{CrO_{4}^{2-}(黄)+ H^{+} ⇄ Cr_{2}O_{7}^{2-}(赤橙) + OH^{-}} \]
- 水溶液を酸性にするということは上の式のH+が増えるということ。H+が増えると(ルシャトリエの原理により)H+を減らす方向に平衡が移動する。
\[ \mathrm{CrO_{4}^{2-}(黄) + H^{+} \textcolor{red}{→} Cr_{2}O_{7}^{2-}(赤橙) + OH^{-} }\]
- 結果的にCr2O72-が増えることになる。
- また、Cr2O72-の色は赤橙色なので水溶液の色も当然赤橙色に変化する。
- 一方、水溶液の液性を塩基性にしていくとOH-が増えるので平衡は左側に移動する。
\[ \mathrm{CrO_{4}^{2-}(黄) + H^{+} \textcolor{red}{←} Cr_{2}O_{7}^{2-}(赤橙) + OH^{-}} \]
- 結果として、 CrO42-が増えるため水溶液の色は黄色となる。
マンガンMn
- マンガンを含む化合物として、過マンガン酸カリウムKMnO4と酸化マンガン(Ⅳ)MnO2が有名である。
過マンガン酸カリウムKMnO4
- 過マンガン酸カリウムKMnO4の水溶液は赤紫色で、強力な酸化剤としてはたらく。
- ただし、酸性下では淡桃色(薄ピンク色)のMn2+になるのに対して、中性・塩基性下では黒色のMnO2が生成する。
\[ \begin{align}&\mathrm{酸性下:MnO_{4}^{-} + 8H^{+} + 5e^{-} → Mn^{2+} + 4H_{2}O}\\
&\mathrm{中性・塩基性下:MnO_{4}^{-} + 4H^{+} + 3e^{-} → MnO_{2} + 2H_{2}O} \end{align}\]
中性・塩基性下における過マンガン酸カリウムの半反応式
- 半反応式・酸化還元反応式(作り方・覚え方・問題演習など)にある手順にしたがうと、中性・塩基性下における過マンガン酸カリウムKMnO4の半反応式は次のようになる。
\[ \begin{align}&\mathrm{酸性下:MnO_{4}^{-} + 8H^{+} + 5e^{-} → Mn^{2+} + 4H_{2}O}\\
&\mathrm{中性・塩基性下:MnO_{4}^{-} + 4H^{+} + 3e^{-} → MnO_{2} + 2H_{2}O} \end{align}\]
- このとき、左辺に水素イオンH+があるが、条件は”中性・塩基性下”のため、酸は加えていない。
- したがって、両辺に水酸化物イオンOH-を加えることでH+を水H2Oに変換する。
\[ \mathrm{MnO_{4}^{-}+4H_{2}O+3e^{-}→MnO_{2}+2H_{2}O+4OH^{-}} \]
- 両辺を-2H2Oすると、次のようになる。
\[ \mathrm{MnO4^{-}+2H_{2}O+3e^{-}→MnO_{2}+4OH^{-}} \]
- これが中性・塩基性下におけるKMnO4の正確な半反応式である。
酸化マンガン(Ⅳ)MnO2
- 酸化マンガン(Ⅳ)MnO2は酸化剤や触媒としてはたらく。
酸化剤
- 酸性下において、酸化マンガン(Ⅳ)MnO2は酸化剤としてはたらく。
- 例として、MnO2と塩酸HClによる塩素Cl2の発生反応を確認する。
\[ \mathrm{MnO_{2} + 4HCl → MnCl_{2} + Cl_{2} + 2H_{2}O} \]
参考:塩素の製法(洗気びんの順番の理由・覚え方など)
参考:酸化剤・還元剤(違い・見分け方・例・一覧など)
触媒
- 酸化マンガン(Ⅳ)MnO2は、”触媒”として過酸化水素H2O2や塩素酸カリウムKClO3の分解を促進する。
\[ \begin{align}&\mathrm{2H_{2}O_{2} → O_{2} + 2H_{2}O}\\
&\mathrm{2KClO_{3} → 3O_{2} + 2KCl} \end{align}\]
- その結果、酸素O2が発生するため、これらの反応はO2の製法として知られている。
コバルトCo
- 塩化コバルト(Ⅱ)CoCl2無水物は水分を吸収すると青色から淡赤色に変化する。
\[ \mathrm{CoCl_{2}(青色)\overset{水}{→}CoCl_{2}・6H_{2}O(淡赤色)} \]
- この性質を利用して、硫酸銅と同様に水分の検出に用いられる。
チタンTi
- 光を吸収して触媒作用を示す物質を光触媒という。
- チタンの酸化物である酸化チタン(Ⅳ)TiO2は有名な光触媒である。
- TiO2は紫外線を吸収すると表面に付着した水分子を酸化し、反応性の高いヒドロキシラジカルとよばれる粒子が生じる。
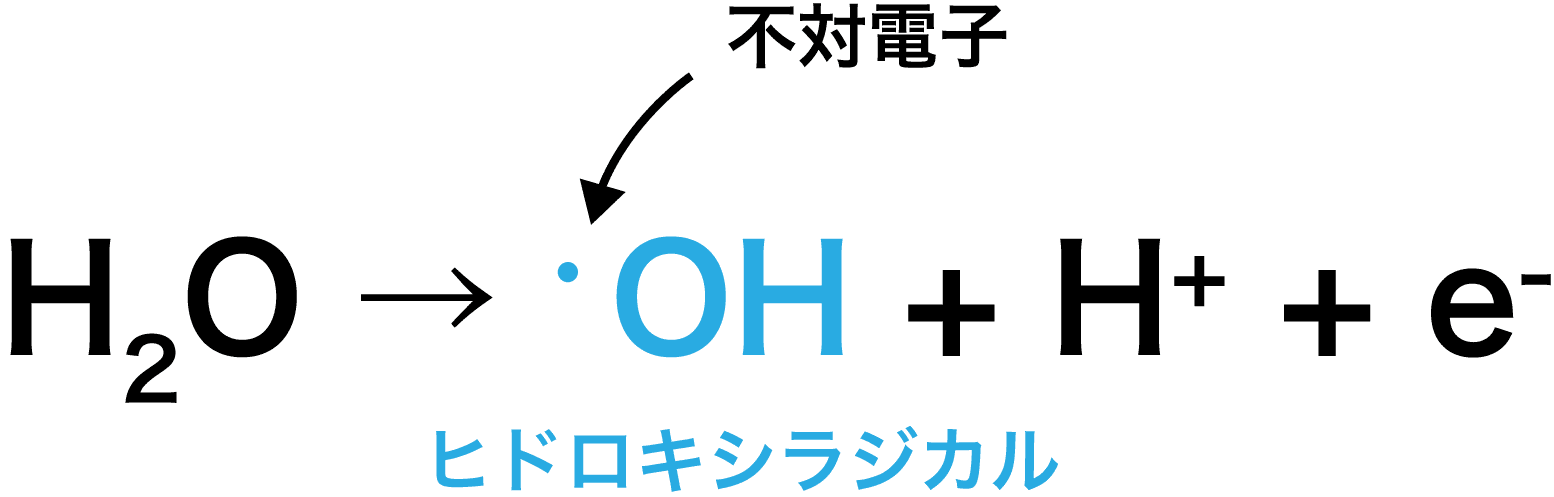
- ヒドロキシラジカルは汚れの原因となる有機物を酸化分解するため、TiO2の表面は汚れることなく綺麗な状態に保たれる。
- この性質を利用して、屋根のコーティングなどに利用されている。
- また、TiO2は白色顔料として有名であり、塗料などに含まれることがある。














