MENU
酵素(一覧・酵素基質複合体・基質特異性・最適温度・最適pHなど)
目次
はじめに
【プロ講師解説】このページでは『酵素(一覧・酵素基質複合体・基質特異性・最適温度・最適pHなど)』について解説しています。
酵素とは
- 生体内の反応を触媒する(反応をスムーズに進めるのを助ける)タンパク質を酵素という。
- 酵素はタンパク質の約80%を占めており、比較的分子量の小さな球状タンパク質なので、体液に溶けている。
酵素一覧
- 代表的な酵素を次に示す。
| 分類 | 酵素 | 触媒する反応や働き[所在] |
|---|---|---|
| 酸化還元酵素 | カタラーゼ | 2H2O2→2H2O+O2[血液] |
| デヒドロゲナーゼ | H原子を奪って酸化する | |
| 転移酵素 (トランスフェラーゼ) | ホスホリラーゼ | リン酸化する 過リン酸分解する |
| 加水分解酵素 (ヒドロラーゼ) | アミラーゼ | デンプン→マルトース[唾液] |
| マルターゼ | マルトース→グルコース[腸液] | |
| スクラーゼ (インベルターゼ) | スクロース→転化糖[腸液] | |
| ラクターゼ | ラクトース→グルコース+ガラクトース | |
| ペプシン | タンパク質→ペプチド[胃液] | |
| トリプシン | タンパク質→ペプチド[すい液] | |
| エレプシン | ペプチド→アミノ酸[腸液] | |
| リパーゼ | 油脂→高級脂肪酸+グリセリン[すい液] | |
| ATPアーゼ | ATPのリン酸結合を加水分解 | |
| ウレアーゼ | 尿素→アンモニア+二酸化炭素 | |
| セルラーゼ | セルロース→セロビオース (草食動物の腸内) | |
| セロビアーゼ | セロビオース→グルコース (草食動物の腸内) | |
| 脱離酵素 (リアーゼ) | 脱炭酸酵素 (デカルボキシラーゼ) | カルボン酸RCOOHから二酸化炭素CO2を脱離させる |
| 異性化酵素 (イソメラーゼ) | シス-トランス異性化酵素 | シス体とトランス体を相互変換する |
| 合成酵素 (リガーゼ) | DNAリガーゼ | DNAの合成を行う |
| その他 | チマーゼ | グルコース→エタノール+二酸化炭素(酵母菌) |
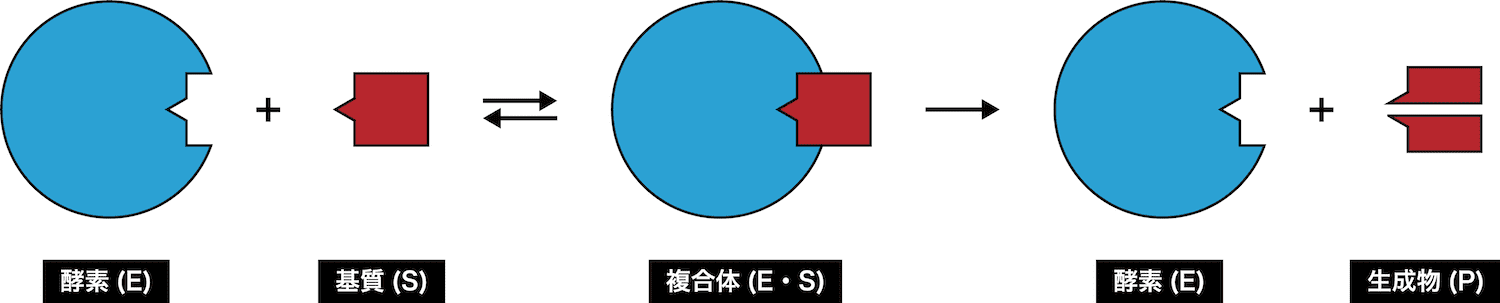
酵素基質複合体
- 酵素(E)の特定部位(活性部位、活性中心)は、適合する基質(S)を取り込み酵素-基質複合体(E・S)を形成する。
- その後、酵素の活性部位で基質が生成物に変化する。
基質特異性
- 酵素は触媒作用を行うために、複雑な立体構造の中に特定の反応物だけをうまく吸着する穴(活性部位)をもっている。
- この穴に入り込んだ(酵素と一時的に結合した)反応物は素早く構造変化を受けて生成物となり酵素から離れる。
- このように、酵素は触媒作用を行う相手(基質)が決まっており、それ以外に対しては作用しない。これを基質特異性といい、反応物と酵素は鍵と鍵穴の関係に相当する。
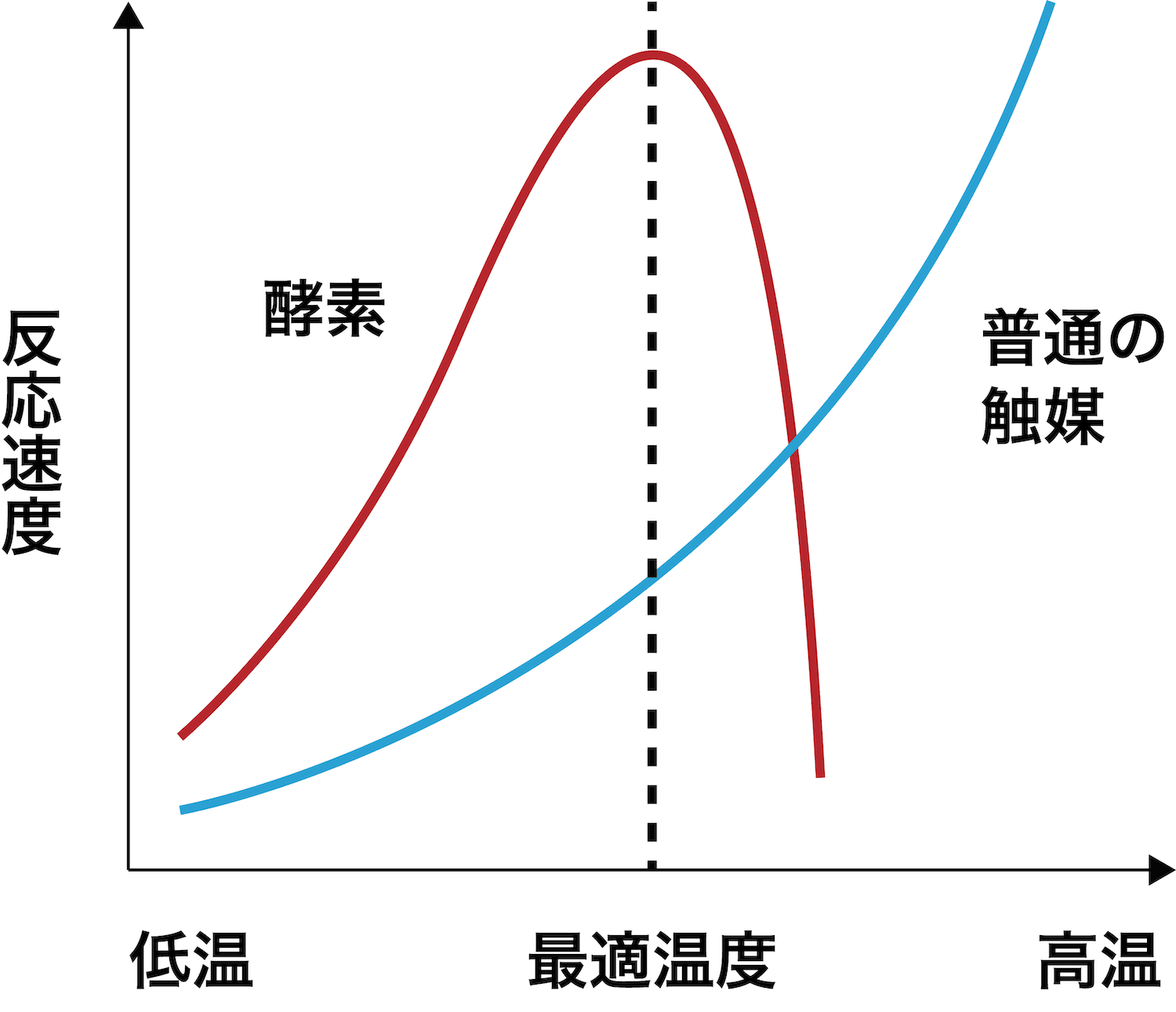
最適温度
- 一般的に、温度を上昇させると活性化エネルギー以上の粒子の割合が増加するため、反応速度は大きくなる。
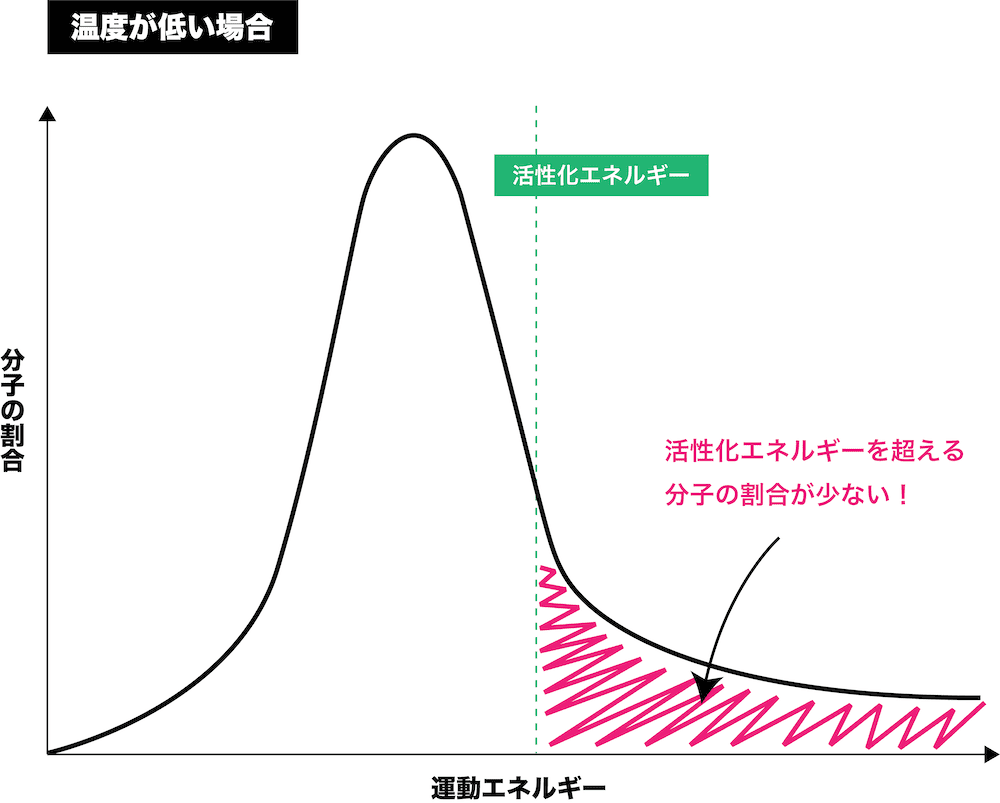
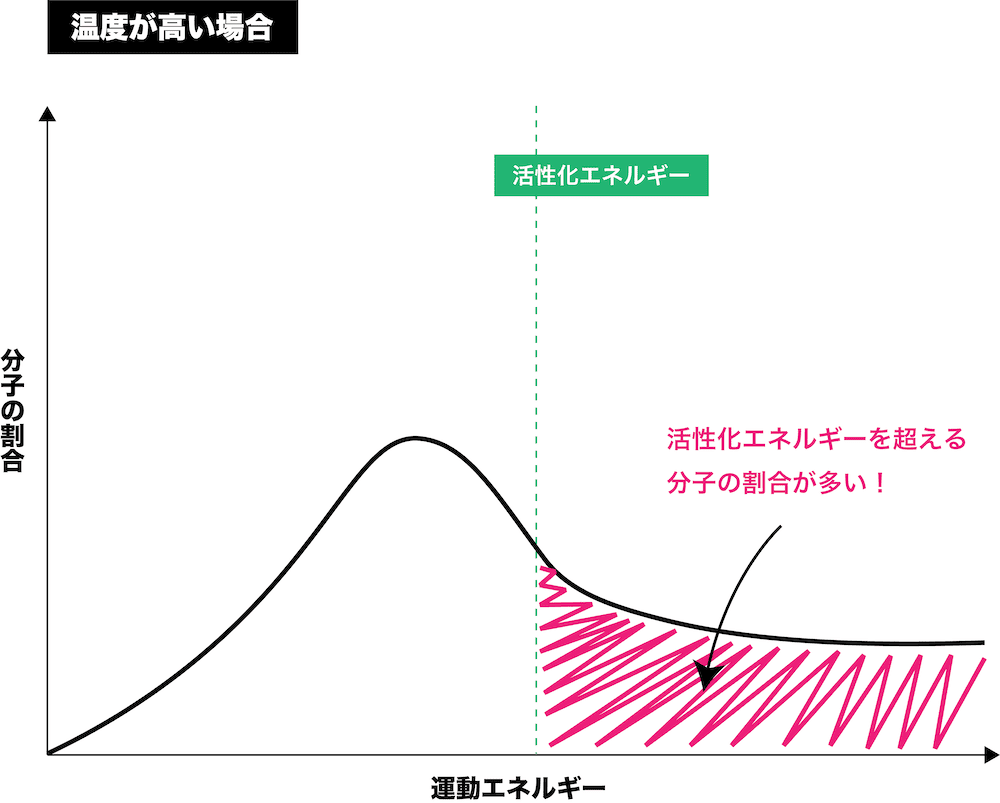
参考:活性化エネルギーと反応熱
- 一方、酵素の優れた触媒作用は、その立体構造に依存している。温度を上昇させると、酵素自身の分子運動が激しくなり、その構造が歪むため、分子を吸着する力や触媒機能が低下し、反応速度が小さくなる。
- したがって、これらがうまく折り合う温度が酵素が最も強く作用する温度であり、その温度は各酵素により決まっている。それを最適温度という。最適温度は多くの場合35〜50℃程度である。
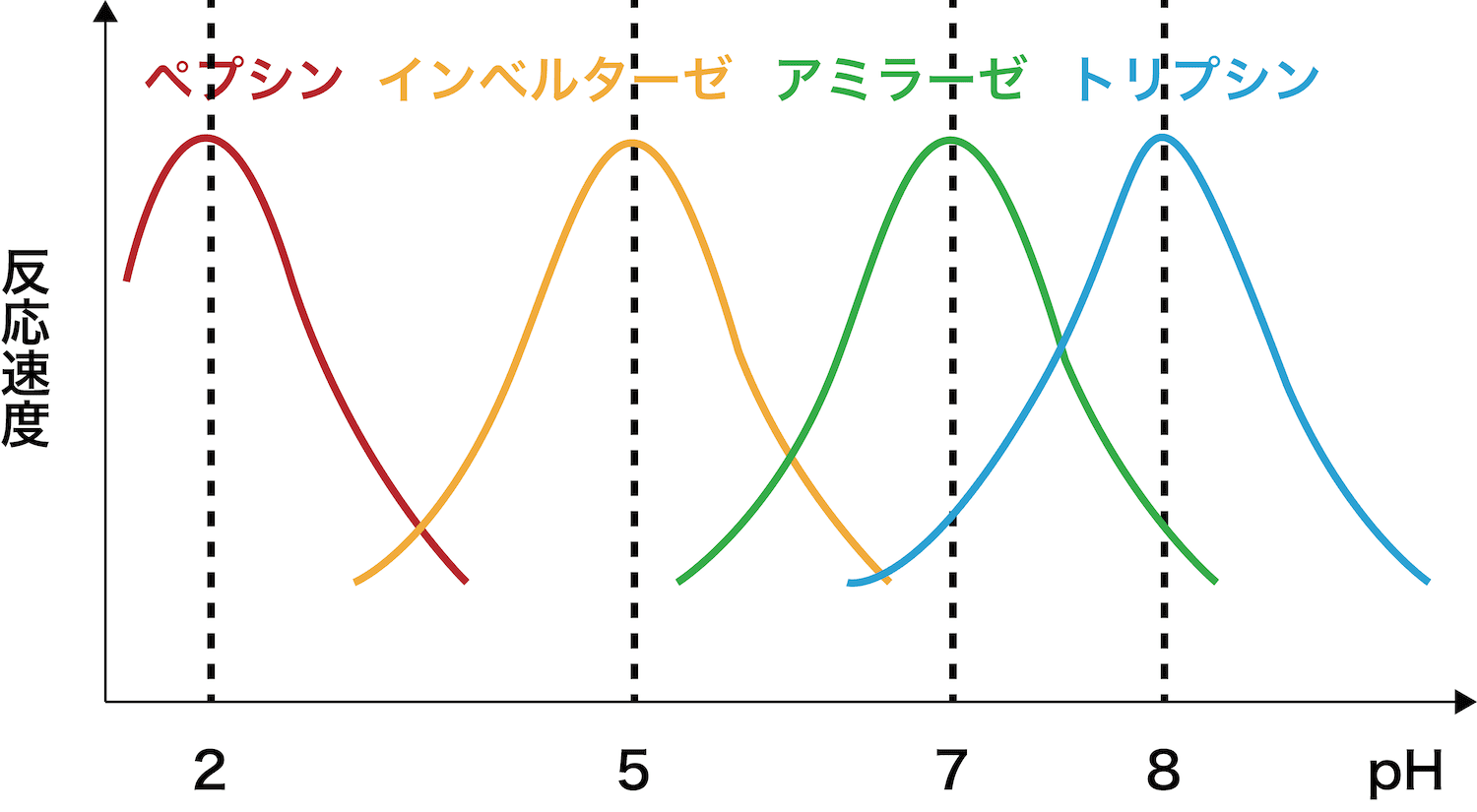
最適pH
- 酵素はタンパク質であり、構成アミノ酸の側鎖Rに含まれる-COOHや-NH2などを使って立体構造を保持している。
- これらの官能基の電離状態がpHとともに変化するため、pHの影響を受け、酵素の立体構造や活性部位の状態が変化する。
- その結果、pHについても最も強く作用する水溶液のpHが存在し、そのpHを最適pHという。
- ほとんどの酵素の最適pHは5〜8程度だが、胃酸存在下で働くペプシンのように、pH1.5〜2が最適pHとなる酵素も存在する。