MENU
硝酸の工業的製法「オストワルト法」(触媒・覚え方・仕組み・反応式など)
はじめに
【プロ講師解説】このページでは『硝酸の工業的製法「オストワルト法」(触媒・覚え方・仕組み・反応式など)』について解説しています。
オストワルト法とは
- 硝酸HNO3の工業的製法をオストワルト法という。
- オストワルト法ではアンモニアNH3を酸化することによりHNO3を得る。
\[ \mathrm{NH_{3}+2O_{2}→HNO_{3}+H_{2}O} \]
オストワルト法の流れ・仕組み
- オストワルト法は次の3STEPで行う。
●STEP1
アンモニアNH3を空気酸化する
→ 一酸化窒素NOが生成
●STEP2
NOを酸化する
→ 二酸化窒素NO2が生成
●STEP3
NO2を酸化する
→ 硝酸HNO3が生成
→ 一酸化窒素NOが生成
まずは、アンモニアNH3を空気酸化することで一酸化窒素NOを得る。
\[ \mathrm{4NH_{3} + 5O_{2} \overset{Pt}{→} 4NO + 6H_{2}O} \]
この反応では触媒として白金Ptを利用する。
また、ここで生成したNOはSTEP2で用いる。
アンモニアNH3の空気酸化
- アンモニアNH3の空気酸化では、NH3と過剰の空気の混合物を、高温(約800℃)で加熱した白金網(Pt)に接触させる。
\[ \mathrm{4NH_{3} + 5O_{2} \overset{Pt}{→} 4NO + 6H_{2}O} \]
- この反応は次の二段階で起こる。
\[\begin{align} &\mathrm{4NH_{3}+3O_{2}→2N_{2}+6H_{2}O\cdots①}\\
&\mathrm{N_{2}+O_{2}→2NO(-180kJ)\cdots②} \end{align}\]
- これらのうち、②の反応は吸熱反応である。したがって、温度を上昇させると温度を下げる方向、つまり右向きのNOが生成する方向に反応が進む。
- これが、オストワルト法のSTEP1の反応が高温下で行われる理由である。高温であればNOを効率よく得ることができる。
→ 二酸化窒素NO2が生成
次に、NOを酸化することで二酸化窒素NO2を得る。
\[ \mathrm{2NO + O_{2} → 2NO_{2}} \]
ここで生成したNO2はSTEP3で用いる。
NOの自動酸化
- STEP1で生成した一酸化窒素NOと空気の混合気体を140℃以下に冷却すると、NOはO2と反応して自動的にNO2に酸化される。
\[ \mathrm{2NO+O_{2}→2NO_{2}} \]
- このように、化合物がO2により触媒を使わずに自動的に酸化される反応を自動酸化という。
→ 硝酸HNO3が生成
最後に、NO2を酸化する(水に吸収させる)ことで硝酸HNO3を得る。
\[ \mathrm{3NO_{2} + H_{2}O → 2HNO_{3} + NO} \]
この反応式の係数決定は非常に面倒なので、係数を含めて式を丸ごと覚えてしまおう。
ちなみに、ここで発生するNOはSTEP2で再び利用される。
自己酸化還元反応
- STEP3の反応は二酸化窒素NO2の自己酸化還元反応である。
\[ \mathrm{3\underbrace{ N }_{ +4 }O_{2} + H_{2}O → 2H\underbrace{ N }_{ +5 }O_{3} + \underbrace{ N }_{ +2 }O} \]
- NO2中のNの酸化数は+4である。この反応の生成物である硝酸HNO3中のNの酸化数は+5、一酸化窒素NO中のNの酸化数は+2である。
全体の反応式
- オストワルト法全体の反応式は次の通りである。
\[ \mathrm{NH_{3}+2O_{2}→HNO_{3}+H_{2}O} \]
- この反応式は、上記STEP1〜3の反応式を足し合わせることによってつくられる。
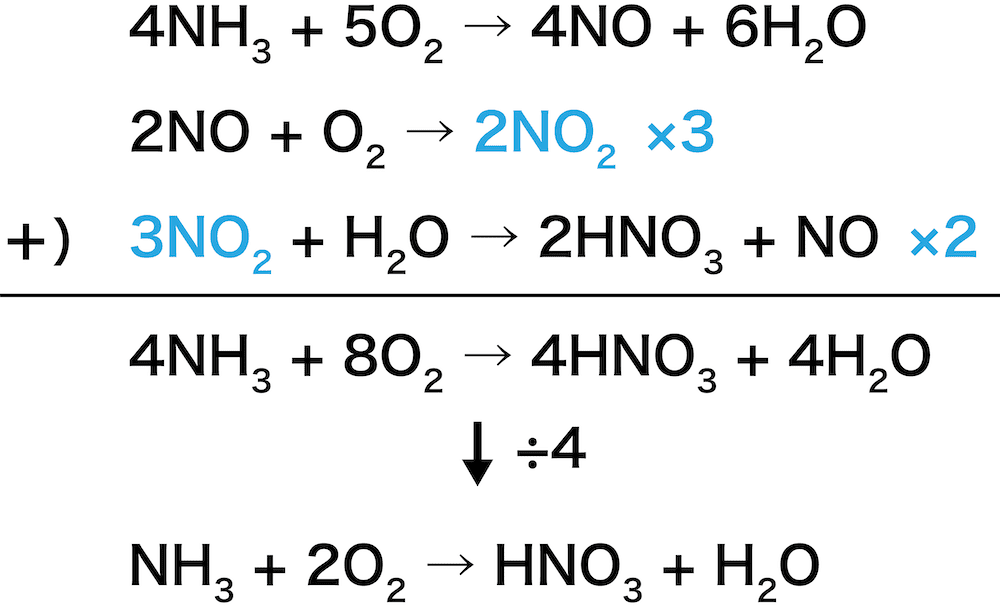
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
HNO3の工業的製法を【1】という。
解答/解説:タップで表示
解答:【1】オストワルト法
HNO3の工業的製法をオストワルト法という。
オストワルト法の第一段階では、NH3を酸化し【1】を得る。
解答/解説:タップで表示
解答:【1】一酸化窒素NO
オストワルト法の第一段階では、NH3を酸化し一酸化窒素NOを得る。
前問の反応では、【1】を触媒として用いる。
解答/解説:タップで表示
解答:【1】Pt(白金)
前問の反応では、Pt(白金)を触媒として用いる。
オストワルト法の第二段階では、NOを酸化し【1】を得る。
解答/解説:タップで表示
解答:【1】二酸化窒素NO2
オストワルト法の第二段階では、NOを酸化し二酸化窒素NO2を得る。
オストワルト法の第三段階では、NO2を水に吸収させ【1】を得る。
解答/解説:タップで表示
解答:【1】硝酸HNO3
オストワルト法の第三段階では、NO2を水に吸収させ硝酸HNO3を得る。
4NH3 + 5O2 → 4【1】 + 6H2O
解答/解説:タップで表示
解答:【1】NO
2NO + O2 → 2【1】
解答/解説:タップで表示
解答:【1】NO2
3NO2 + H2O → 2【1】 + NO
解答/解説:タップで表示
解答:【1】HNO3
【1】 + 2O2 → 【2】 + H2O
解答/解説:タップで表示
解答:【1】NH3【2】HNO3














