MENU
カルボン酸・エステル(一覧・構造・命名法・製法・反応・性質など)
はじめに
【プロ講師解説】このページでは『カルボン酸・エステル(一覧・構造・命名法・製法・反応・性質など)』について解説しています。
カルボン酸とは
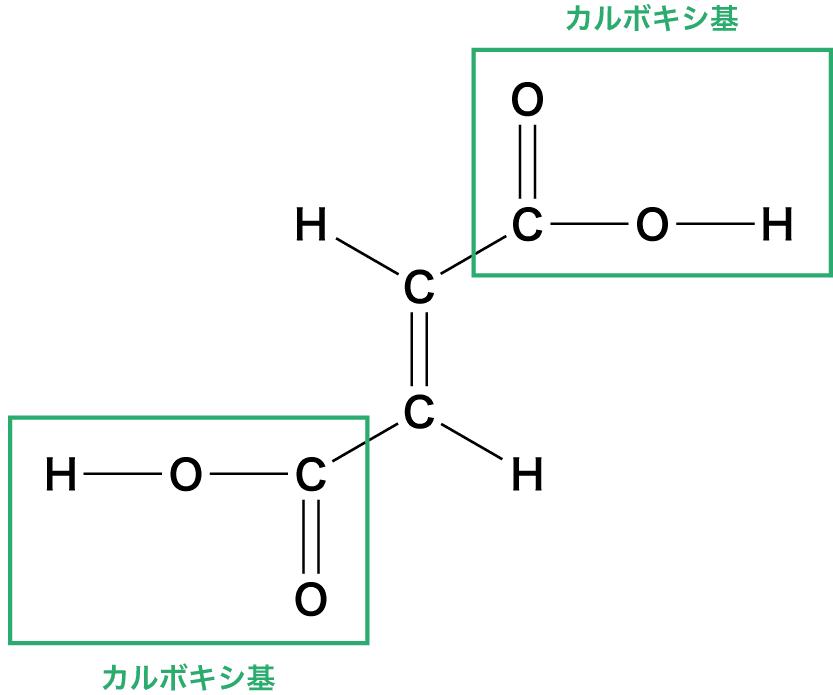
- カルボキシ基(-COOH)をもつ化合物をカルボン酸という。

カルボン酸一覧
- 代表的なカルボン酸を次に示す。
| 分類 | 名称 | 構造式 |
|---|---|---|
| 飽和脂肪酸 | ギ酸 | 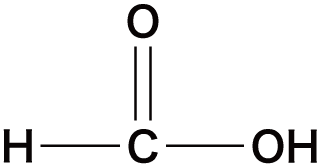 |
| 酢酸 | 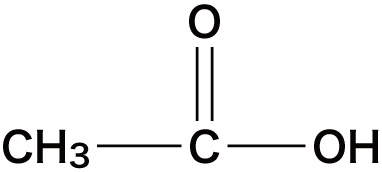 | |
| プロピオン酸 |  | |
| 不飽和脂肪酸 | アクリル酸 | 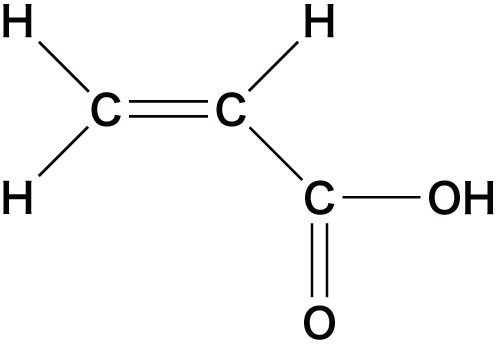 |
| ジカルボン酸 | シュウ酸 | 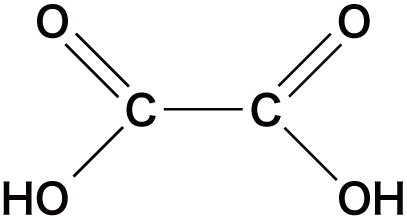 |
| マレイン酸 | 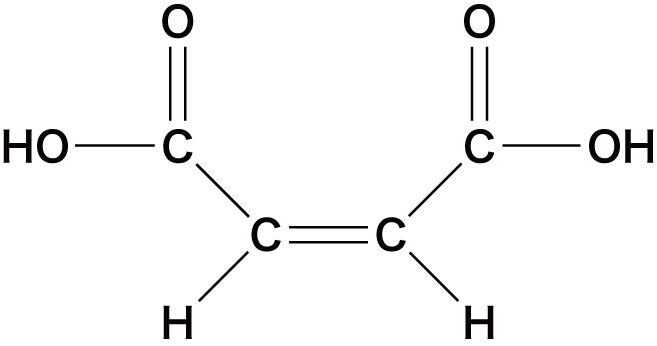 | |
| フマル酸 | 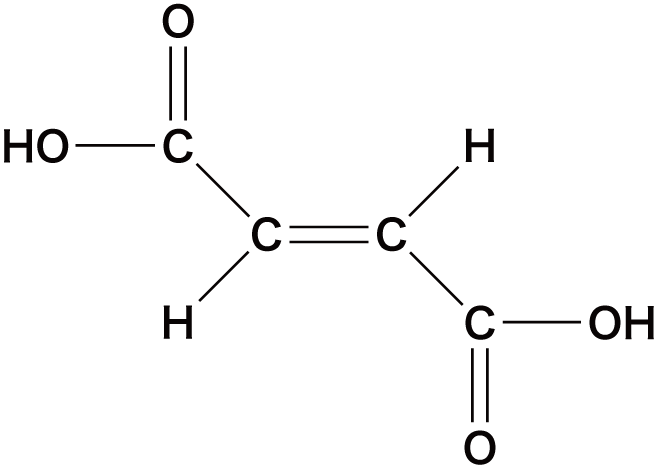 | |
| アジピン酸 | 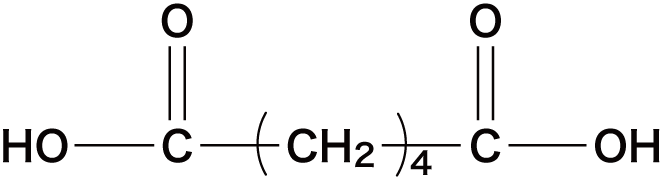 | |
| 芳香族カルボン酸 | 安息香酸 | 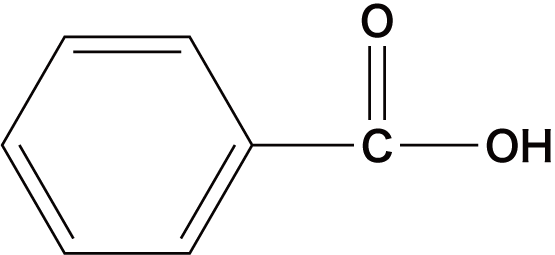 |
| フタル酸 |  | |
| テレフタル酸 |  | |
| ヒドロキシ酸 | 乳酸 |  |
| リンゴ酸 | 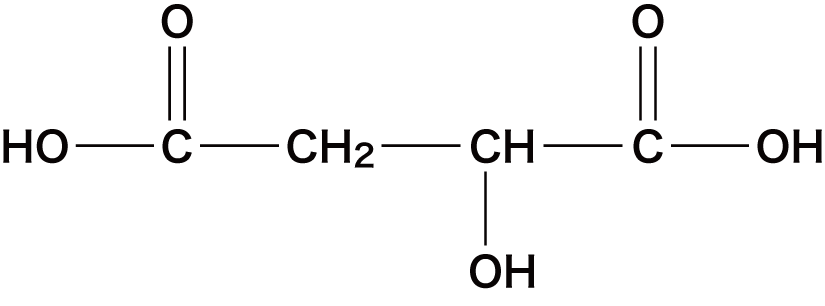 |
- カルボン酸は古来より知られていたものが多く、慣用名でよばれることが多い。上記のものはいずれも重要なカルボン酸なので名前と構造式を対応させて必ず覚えておこう。
- 鎖式炭化水素のH1個をカルボキシ基で置換したカルボン酸を脂肪酸という。脂肪酸のうち、炭化水素基が単結合のみのものを飽和脂肪酸、二重結合などを含むものを不飽和脂肪酸という。
- また、カルボキシ基を2個もつものをジカルボン酸、ベンゼンのH原子をカルボキシ基で置換したものを芳香族カルボン酸、ヒドロキシ基をもつカルボン酸をヒドロキシ酸という。
カルボン酸についたカルボキシ基の数を、そのカルボン酸の価数といいます。
カルボン酸の製法
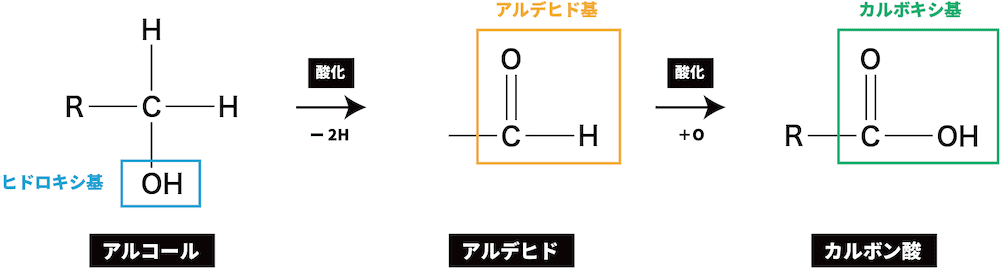
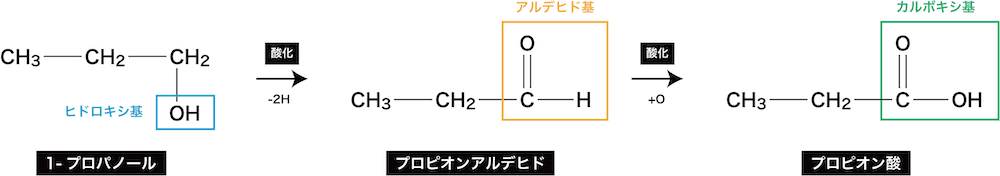
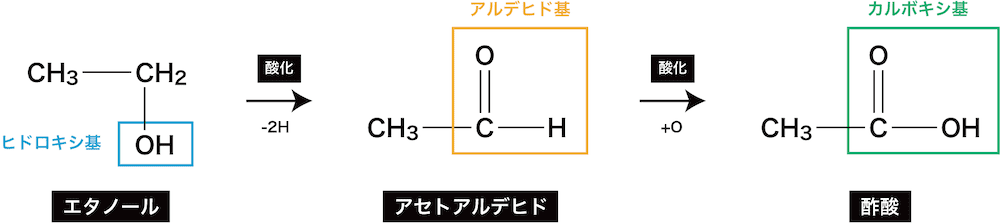
- カルボン酸の製法はそれぞれによって異なるが、1価のカルボン酸は次のように第1級アルコールの酸化によって得られる。
ex1)1-プロパノールの酸化
ex2)エタノールの酸化
カルボン酸の性質
- カルボン酸の性質として知っておくべきは次の3つである。
●カルボン酸の性質
- 炭化水素部分が小さければ、水に溶けて酸性を示す。
- 分子間で水素結合を形成する(異性体であるエステルに比べて沸点が高い)。
- ギ酸は還元性がある。
❶ 炭化水素部分が小さければ、水に溶けて酸性を示す。
- カルボン酸は、炭化水素部分が小さければ水に溶けて酸性を示す。
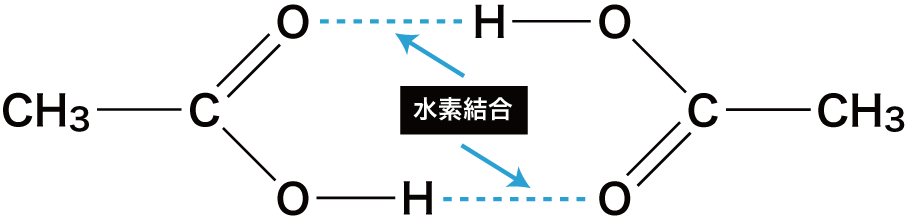
❷ 分子間で水素結合を形成する(異性体であるエステルに比べて沸点が高い)。
- カルボン酸は、分子間で水素結合を形成するため結合が切れにくく、異性体であるエステルに比べて沸点が高い。
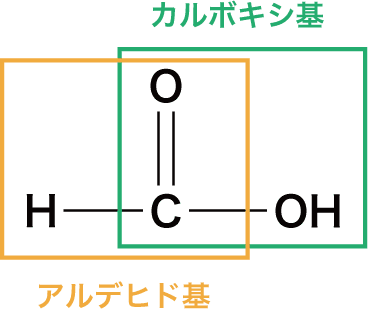
❸ ギ酸は還元性がある。
- カルボン酸の中で「ギ酸HCOOH」だけは(アルデヒド基があるため)還元性をもつ。
カルボン酸の反応①(中和反応)
- カルボン酸は酸性のため塩基と中和反応を起こす。
\[ \mathrm{R-COOH+NaHCO_{3}→R-COONa+\underbrace{ CO_{2}+H_{2}O }{ H_{2}CO_{3} }} \]
- ちなみに、カルボン酸の酸としての強さは次の通りである。
\[ \mathrm{HCl>\underbrace{ R-SO_{3}H }_{ スルホン酸 }>\underbrace{ R-COOH }_{ カルボン酸 }>H_{2}CO_{3}>フェノール} \]
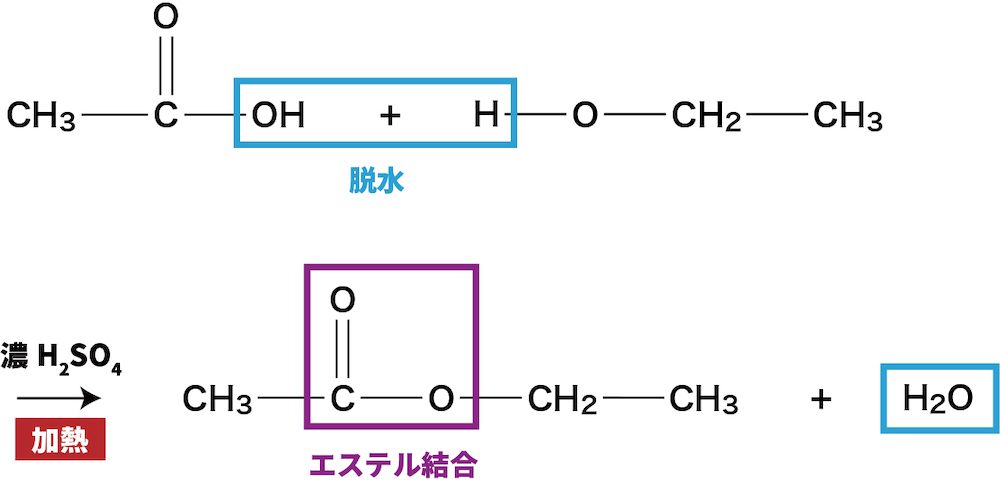
カルボン酸の反応②(エステル化)
- カルボン酸は、アルコールと脱水反応しエステル結合を形成する。
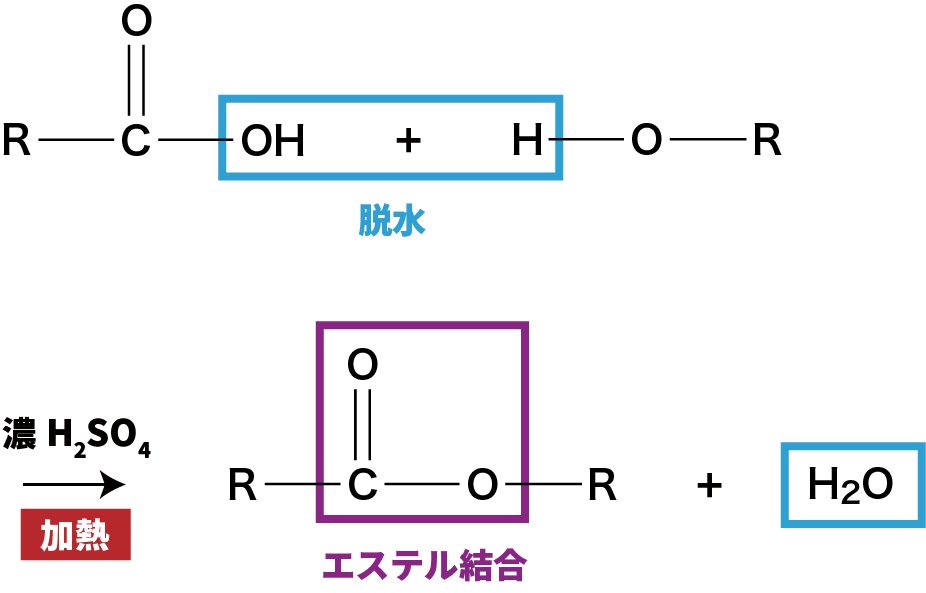
- 脱水反応のため、水H2Oが生じていることも理解しておこう。
ex)酢酸CH3COOHとエタノールC2H5OHによるエステル形成反応
- カルボン酸の酢酸CH3COOHとアルコールのエタノールC2H5OHが反応すると、エステル結合をもつ酢酸エチルCH3COOCH2CH3が生じる。
カルボン酸の反応③(脱水反応)
- カルボン酸2分子間で脱水が起こると酸無水物が形成される。
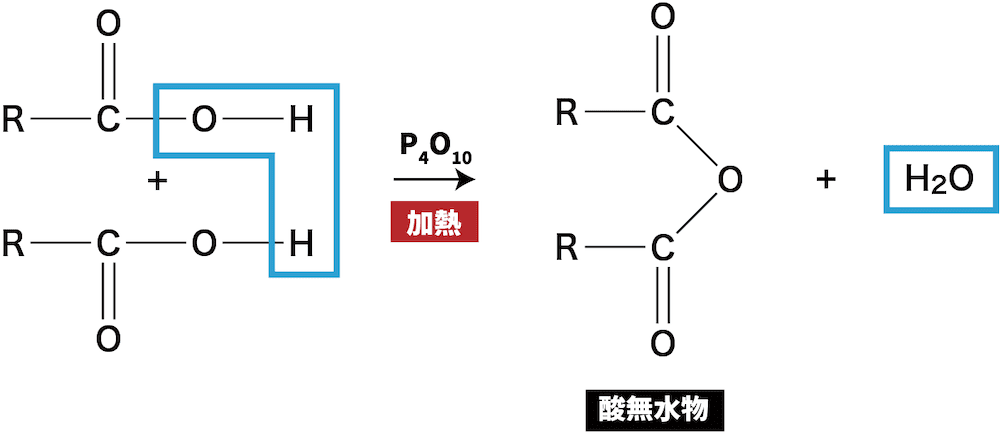
カルボン酸は比較的安定した物質なので、一般的な硫酸H2SO4による脱水はできません。十酸化四リンP4O10+加熱などの特別な処理が必要になります。
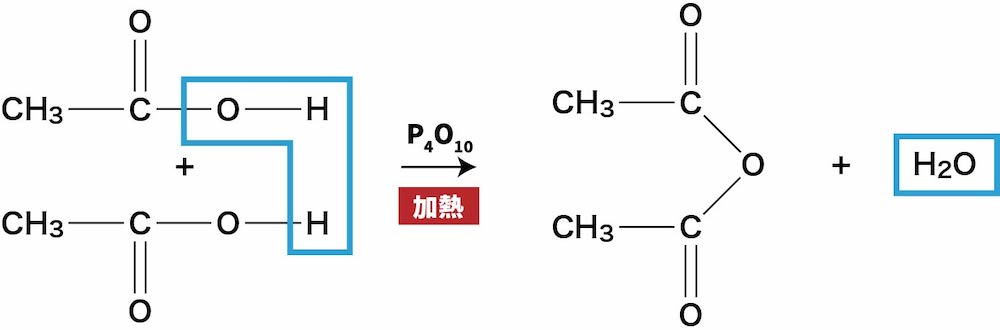
ex1)酢酸の脱水
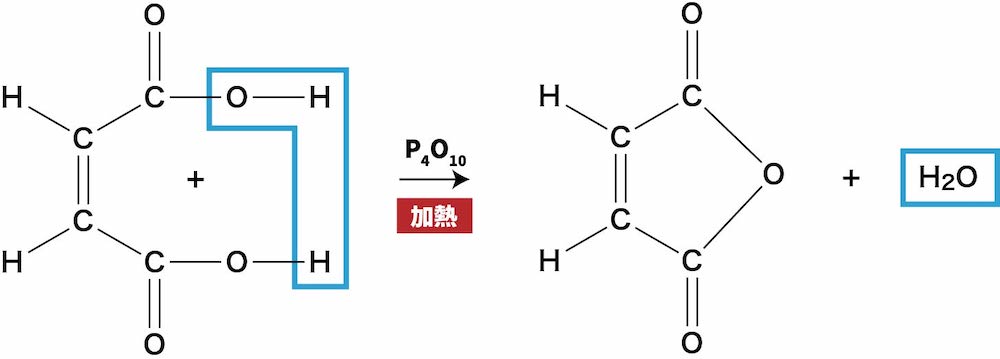
ex2)マレイン酸の脱水
カルボン酸の反応④(脱炭酸反応)
- カルボン酸の脱炭酸反応(炭酸イオンCO32ーが抜けるような反応)によって、アルカンやケトンが生成する。
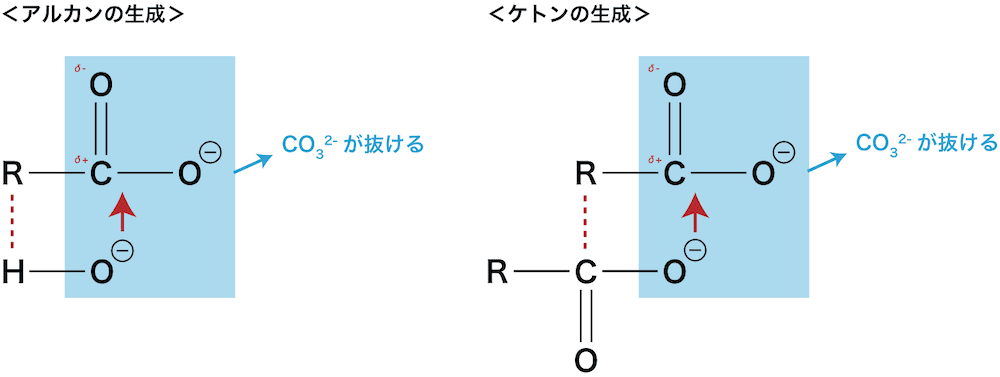
- メタンやアセトンを実験室で生成する反応は、このカルボン酸の脱炭酸反応である。
メタンの製法
- メタンの製法では、酢酸ナトリウムCH3COONaに水酸化ナトリウムNaOHを加えて加熱する。
\[ \mathrm{CH_{3}COONa+NaOH→\underbrace{ CH_{4} }_{ メタン }+Na_{2}CO_{3}} \]
- メタンの製法について詳しくは次のページを参照のこと。
参考:アルカン(一般式の作り方・一覧・命名法・製法・性質・置換反応など)
アセトンの製法
- アセトンの製法では、酢酸カルシウム(CH3COO)2Caを乾留する。
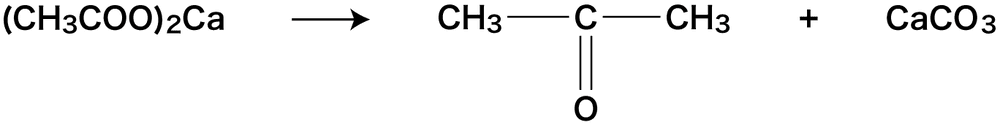
乾留とは空気を遮断して加熱することです。アセトンの製法では、生成物のアセトンの蒸気が引火しやすいので、空気(酸素)を遮断した状態で加熱する必要があります。
- アセトンの製法について詳しくは次のページを参照のこと。
エステルとは
- 分子内にエステル結合(-COO-)をもつ化合物をエステルという。
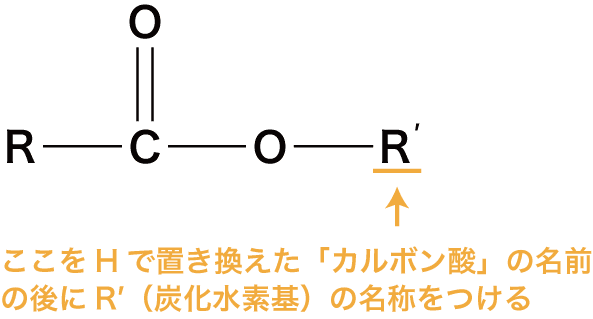
エステルの命名法
- エステルの命名法は至って簡単で、次図R´をHで置き換えた「カルボン酸」の名前の後にR´(炭化水素基)の名称をつけるだけである。
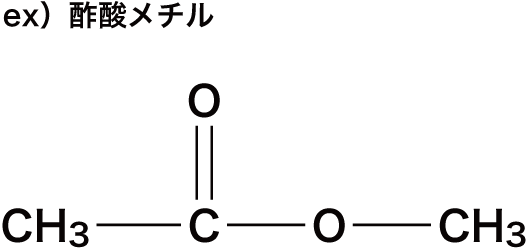
ex)酢酸メチル
- COOに続いているメチル基CH3をHに変えてできるカルボン酸が”酢酸”のため「酢酸メチル」となる。

エステルの製法
- 代表的なエステルの製法を解説する。
●エステルの製法
- 酸触媒を使った合成法
- カルボン酸無水物を使った合成法
- アルケンやアルキンにカルボン酸を付加する方法
❶ 酸触媒を使った合成法
- 上記「カルボン酸の反応②(エステル化)」で紹介したように、カルボン酸は酸触媒下でアルコールと脱水反応しエステル結合を形成する。これを利用してエステルを合成することができる。

ex)酢酸CH3COOHとエタノールC2H5OHによるエステル形成反応
- カルボン酸の酢酸CH3COOHとアルコールのエタノールC2H5OHが反応すると、エステル結合をもつ酢酸エチルCH3COOCH2CH3が生じる。

酸触媒を使った合成法の原理
- 酸触媒を使ったエステル合成法の原理を解説する。
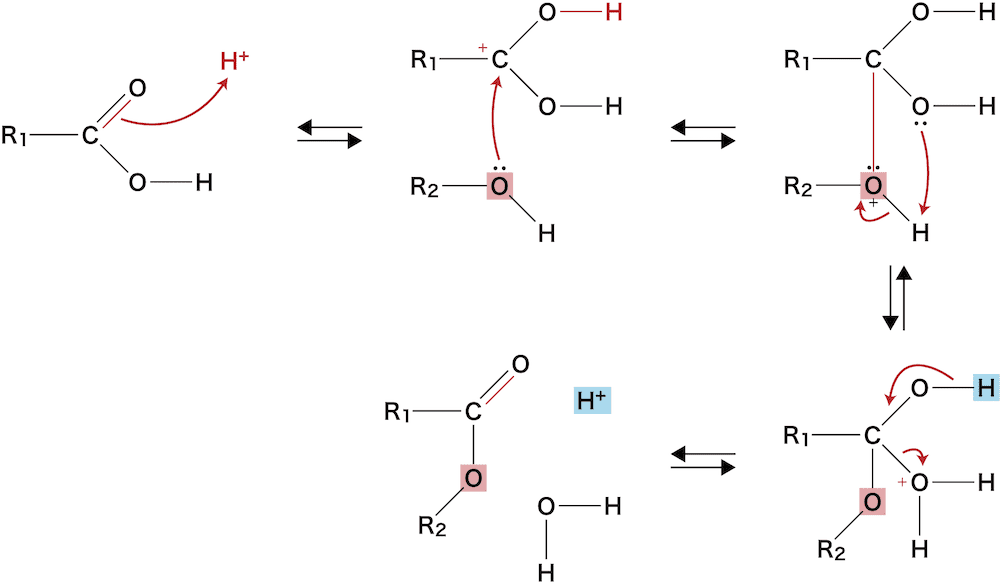
- この反応は可逆的であり、したがって、出来るだけ平衡を右に移動させる(多くのエステルを得る)ためにはH2Oを少なくする必要がある(ルシャトリエの原理)。
- そこで触媒として濃硫酸が用いられている(反応速度が変化する要因)。
❷ カルボン酸無水物を使った合成法
- 無水酢酸をアルコールと反応させるとエステルが生じる。
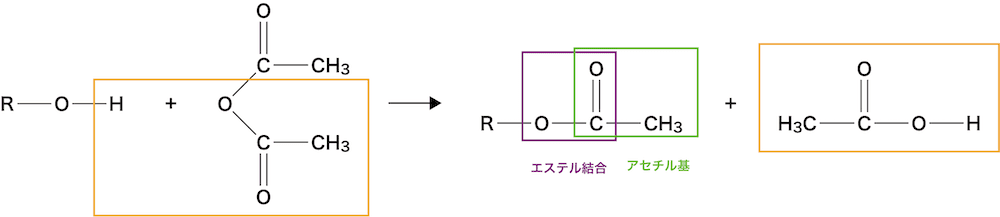
- エステル結合とともにアセチル基(-COCH3)も生成しているので「アセチル化」と捉えることもできる。
この反応は、エステルの製法としてよりも、「ヒドロキシ基-OHの検出反応」として知られています。
カルボン酸無水物を使った合成法の原理
- カルボン酸無水物を使った合成法の原理を解説する。
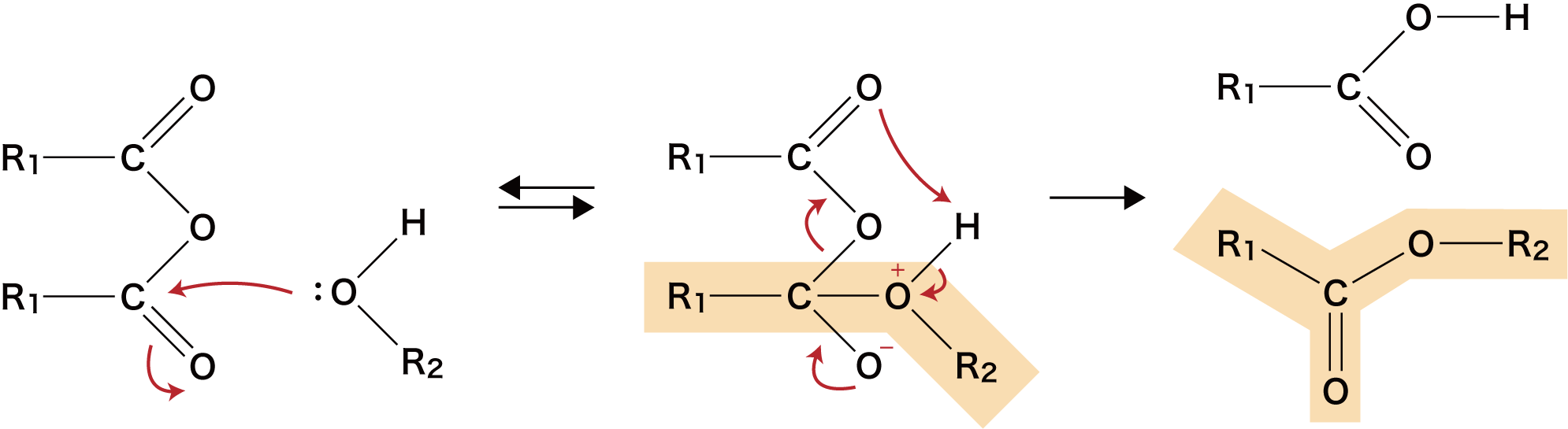
- この反応は不可逆的であり、H2Oは生じない。
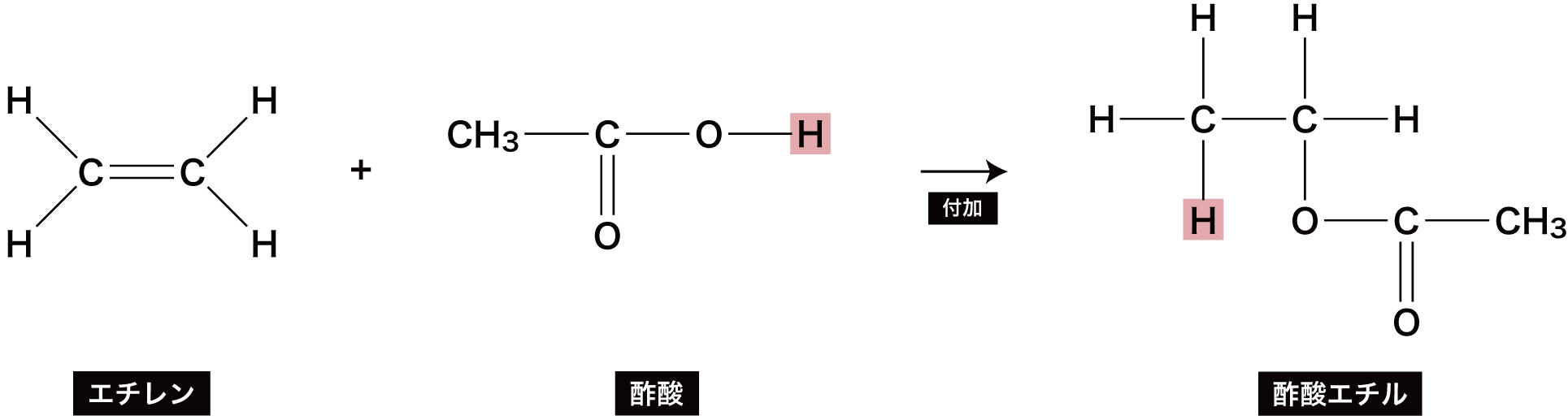
❸ アルケンやアルキンにカルボン酸を付加する方法
- アルケンやアルキンにカルボン酸を付加するとエステルが生じる。
ex)エチレンC2H4と酢酸CH3COOHにより、酢酸エチルCH3COOC2H5ができる反応
アルケンやアルキンにカルボン酸を付加する方法の原理
- 次のように考えると、この反応でエステルができることに納得できるはずである。

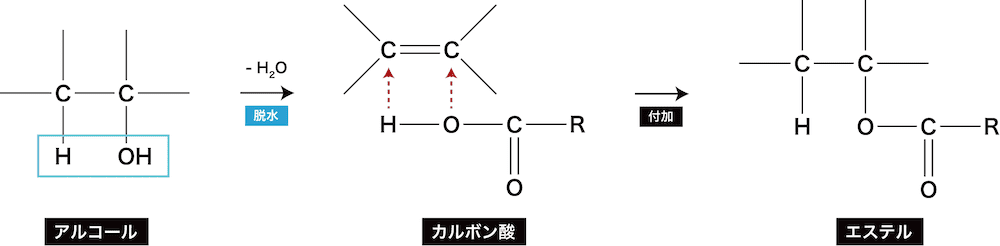
- また、この考え方は「カルボン酸無水物を使った合成法」でも適応できる。

- カルボン酸から先にH2Oを抜くか、あとで抜くかの違いということ。
エステルの性質
- エステルの性質として知っておくべきは次の4つである。
●エステルの性質
- 中性
- 水に溶けにくく、有機溶媒に溶けやすい
- 芳香性をもつ
- ギ酸エステルは還元性をもつ
- エステルは(異性体であるカルボン酸と異なり)中性である。
- また、ギ酸エステルはカルボン酸のところで紹介したギ酸と同様、アルデヒド基があるので還元性を示す。
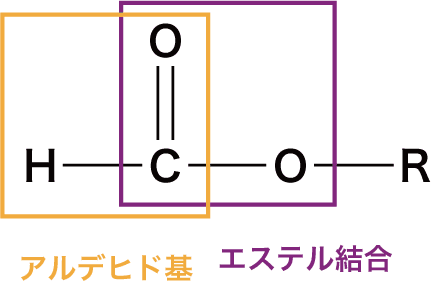
エステルの反応
- エステルの製法として知っておくべきは次の2つである。
●エステルの製法
- 酸触媒を用いた加水分解
- 塩基を用いた加水分解(けん化)
❶ 酸触媒を用いた加水分解
- エステルを加水分解するとカルボン酸とアルコールが生じる。

ex)酢酸エチルCH3COOC2H5の酸触媒を用いた加水分解

❷ 塩基を用いた加水分解(けん化)
- エステルを強塩基(NaOH・KOHなど)により加水分解することをけん化という。

ex)酢酸エチルの水酸化ナトリウムNaOHによるけん化

けん化の原理
- けん化の反応機構は次の通りである。
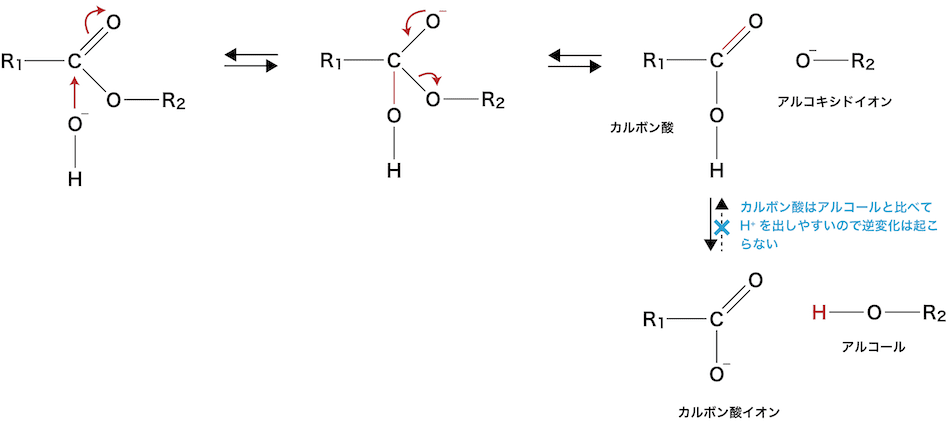
- カルボン酸とアルコキシドイオンからカルボン酸とアルコールが生成したあと、カルボン酸はアルコールと比べてH+を出しやすいため逆変化は起こらず、けん化が成立する。