MENU
アルデヒド・ケトン(一覧・違い・命名法・製法・反応・性質など)
はじめに
【プロ講師解説】このページでは『アルデヒド・ケトン(一覧・違い・命名法・製法・反応・性質など)』について解説しています。
アルデヒドとは
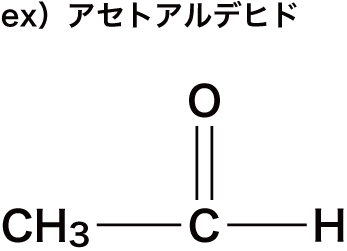
- アルデヒド基(-CHO)をもつ化合物をアルデヒドという。
アルデヒドの名称
- 代表的なアルデヒドを次に示す。
| 示性式 | 慣用名 |
|---|---|
| H-CHO | ホルムアルデヒド |
| CH3-CHO | アセトアルデヒド |
| CH3-CH2-CHO | プロピオンアルデヒド |
- アルデヒドは慣用名でよばれることがほとんどである。慣用名と構造をきっちり対応させて覚えよう。
アルデヒドの製法
- アルデヒドの製法について解説する。
基本的な製法(第1級アルコールの酸化)
- アルデヒドは第1級アルコールの酸化により得ることができる。
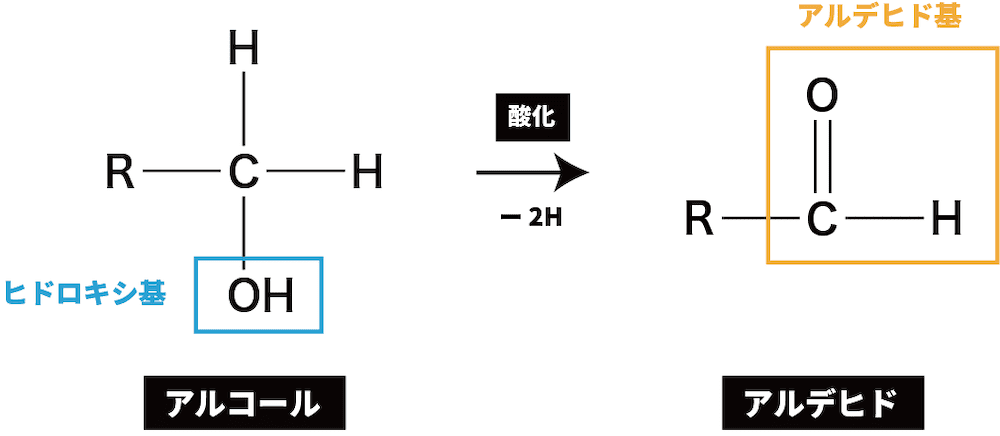
ex)エタノールの酸化によるアセトアルデヒドの生成反応
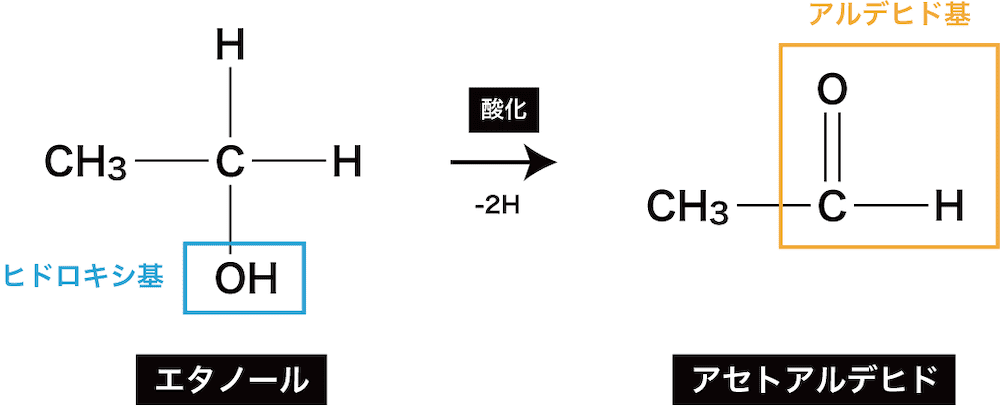
アセトアルデヒドの工業的製法(エチレンの酸化)
- アセトアルデヒドは、工業的には塩化パラジウム(Ⅱ)PdCl2と塩化銅(Ⅱ)CuCl2を触媒に用いて、エチレンを空気酸化して製造される。
\[ \mathrm{2CH_{2}=CH_{2} + O_{2} → 2CH_{3}-CHO} \]
- この反応はヘキスト・ワッカー法とよばれている。
アルデヒドの性質
- アルデヒドの性質として知っておくべきは次の3つである。
●アルデヒドの性質
- 沸点が高い
- 水溶性
- 還元性
❶ 沸点が高い
- アルデヒド基は比較的大きな極性をもち、同程度の分子量をもつアルカンよりもファンデルワールス力が大きいため、沸点は高くなる。
- ただし、ヒドロキシ基のように分子間で水素結合を形成できないので、アルコールと比べると沸点は低くなる。
参考:アルカン(一般式の作り方・一覧・命名法・製法・性質・置換反応など)
参考:分子間力(水素結合・ファンデルワールス力・沸点のグラフなど)
❷ 水溶性
- アルデヒドは炭化水素部分が小されけば水に溶ける。
\[ \mathrm{ホルムアルデヒド(HCHO)→ ホルマリン} \]
- 特に30%〜40%程度のホルムアルデヒド水溶液はホルマリンとよばれ、防腐剤などとして用いられる(解剖前のご遺体を保存しておくやつ)。
❸ 還元性
- アルデヒドは還元性があるため、フェーリング反応や銀鏡反応などの反応を起こす。
アルデヒドの反応①(フェーリング反応)
- 代表的なアルデヒドの反応であるフェーリング反応を紹介する。
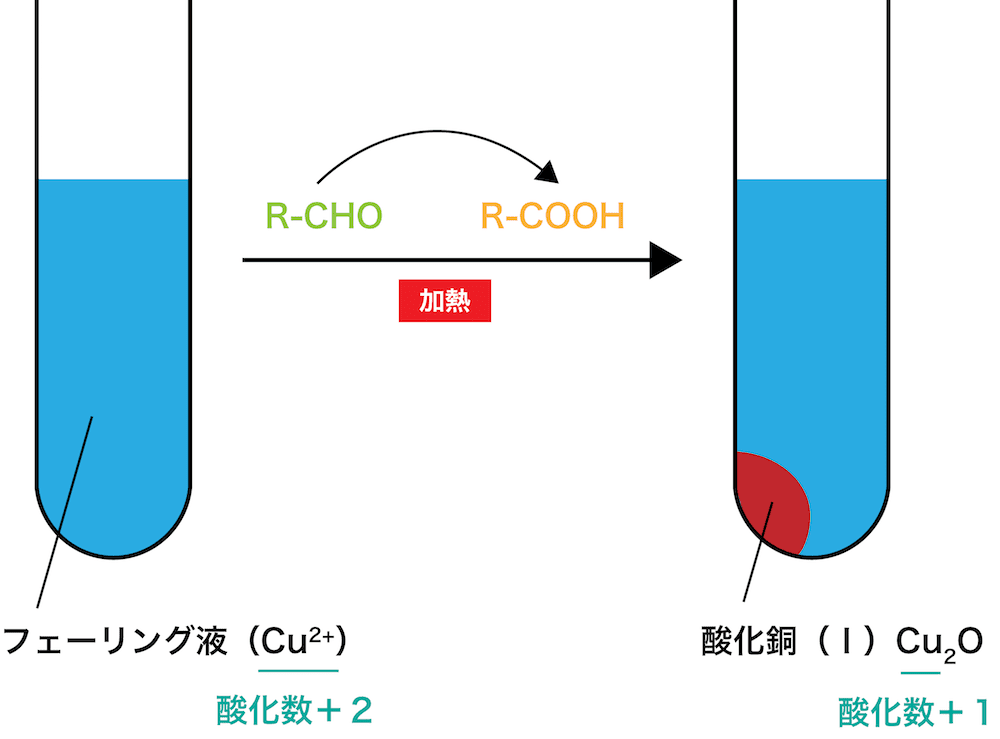
- フェーリング液には銅(Ⅱ)イオンCu2+が含まれている。
- ここにアルデヒドを加えて加熱すると、アルデヒドの還元性によりCu2+は還元され、酸化銅(Ⅰ)Cu2Oの沈殿が生成する(酸化銅(Ⅰ)中の銅イオンの酸化数は+1(Cu+)なので酸化数が減っている=還元されている)。この反応をフェーリング反応という。
フェーリング反応では、アルデヒド自身は酸化され、カルボン酸となっています。
参考:銀鏡反応とフェーリング反応(原理・反応式・沈殿・色変化など)
参考:カルボン酸・エステル(一覧・構造・命名法・製法・反応・性質など)
参考:酸化数(求め方・ルール・例外・例題・一覧・演習問題)
アルデヒドの反応②(銀鏡反応)
- 代表的なアルデヒドの反応である銀鏡反応を紹介する。
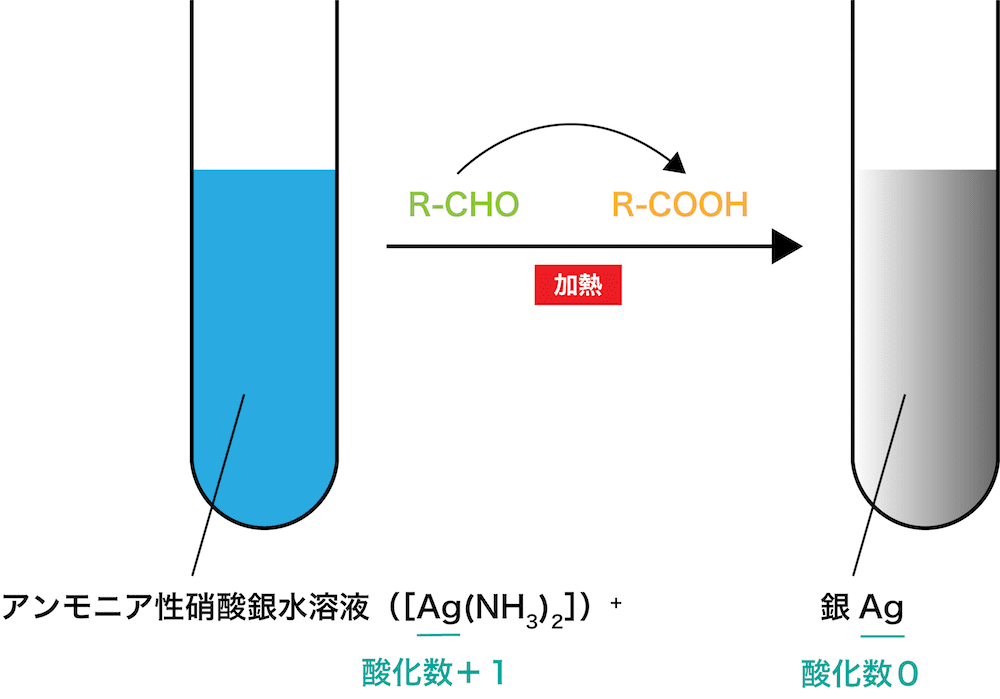
- アンモニア性硝酸銀水溶液中には錯イオン[Ag(NH3)2]+が含まれる。
- ここにアルデヒドを加えて加熱すると、アルデヒドによって[Ag(NH3)2]+中の銀イオンAg+が還元され、単体の銀Agが生じる(Agの酸化数は0なのでAg+の酸化数+1から還元されている)。
- 生成した銀は金属特有の光沢を示すため試験管の中は鏡のような状態になり、これが反応名”銀鏡反応”の由来になっている。
- また、フェーリング反応と同様にアルデヒド自身は酸化されてカルボン酸になる。
参考:銀鏡反応とフェーリング反応(原理・反応式・沈殿・色変化など)
参考:【錯イオン】色・配位数・形・価数・命名法を総まとめ
参考:カルボン酸・エステル(一覧・構造・命名法・製法・反応・性質など)
参考:酸化数(求め方・ルール・例外・例題・一覧・演習問題)
ケトン
- ケトン基(R-CO-R‘)をもつ化合物をケトンという。
- アルデヒドとケトンはともにC=Oの結合をもつ化合物であり、これらを一括りにしてカルボニル化合物とよぶこともある。
ケトンの命名法
- ケトンの命名は次の手順で行う。
●STEP1
ケトン基の両サイドにある炭化水素基を確認する。
●STEP2
“ケトン”の前にアルファベットの若い順に官能基名をつける。また、2つの官能基が同じ場合は官能基名の前に”ジ”をつける。
- ここでは次のケトンを例に命名の手順を確認する。
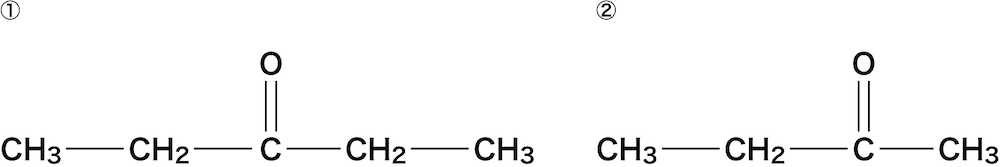
まずは、ケトン基の両サイドにある炭化水素基を確認する。
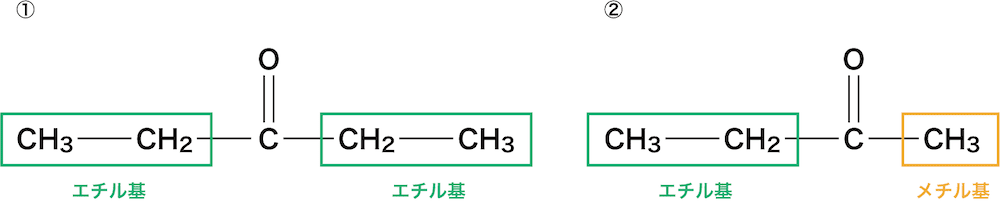
①は両側ともエチル基、②は左側はエチル基、右側はメチル基になっている。
次に、”ケトン”の前にアルファベットの若い順に官能基名をつける。また、2つの官能基が同じ場合は官能基名の前に”ジ”をつける。
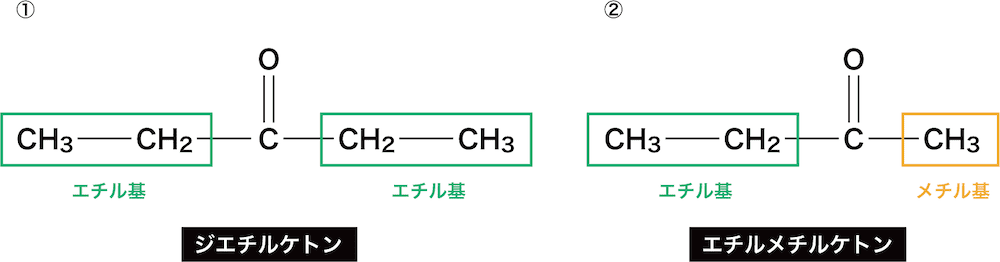
①は両側にエチル基が付いているので「ジエチルケトン」、②は左側にエチル基、右側にメチル基が付いているので「エチルメチルケトン」になる。
「ジメチルケトン」だけは例外として「アセトン」という慣用名でよばれます。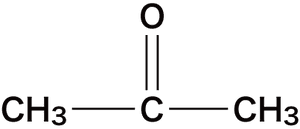
ケトンの製法
- 代表的なケトンの製法を解説する。
●ケトンの製法
- 第2級アルコールの酸化
- アルケンの酸化
- クメン法(アセトンのみ)
- 酢酸カルシウムの乾留(アセトンのみ)
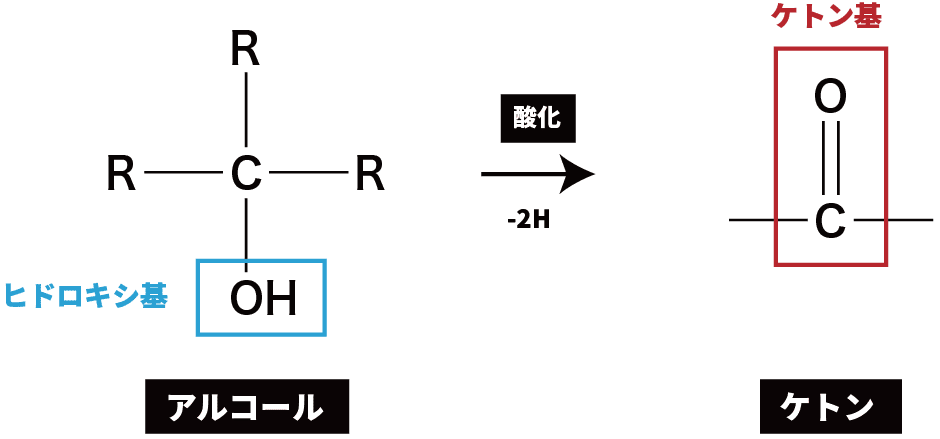
❶ 第2級アルコールの酸化
- 第2級アルコールを酸化すると、ケトンが生成する。
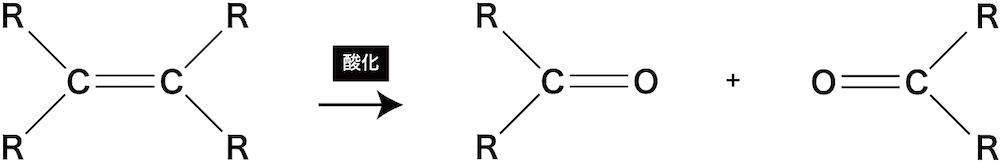
❷ アルケンの酸化
- アルケンを酸化すると2つのケトンが生成する。
❸ クメン法(アセトンのみ)
- クメン法はフェノールの製法として知られているが、フェノールと同時にケトンの一種であるジメチルケトン(=アセトン)が生成する。
❹ 酢酸カルシウムの乾留(アセトンのみ)
- アセトンの実験室的製法として酢酸カルシウムの乾留が知られている。

ケトンの性質
- ケトンは還元性がなくフェーリング反応や銀鏡反応を起こさない。
- したがって、還元性を示すアルデヒドと区別が可能である。
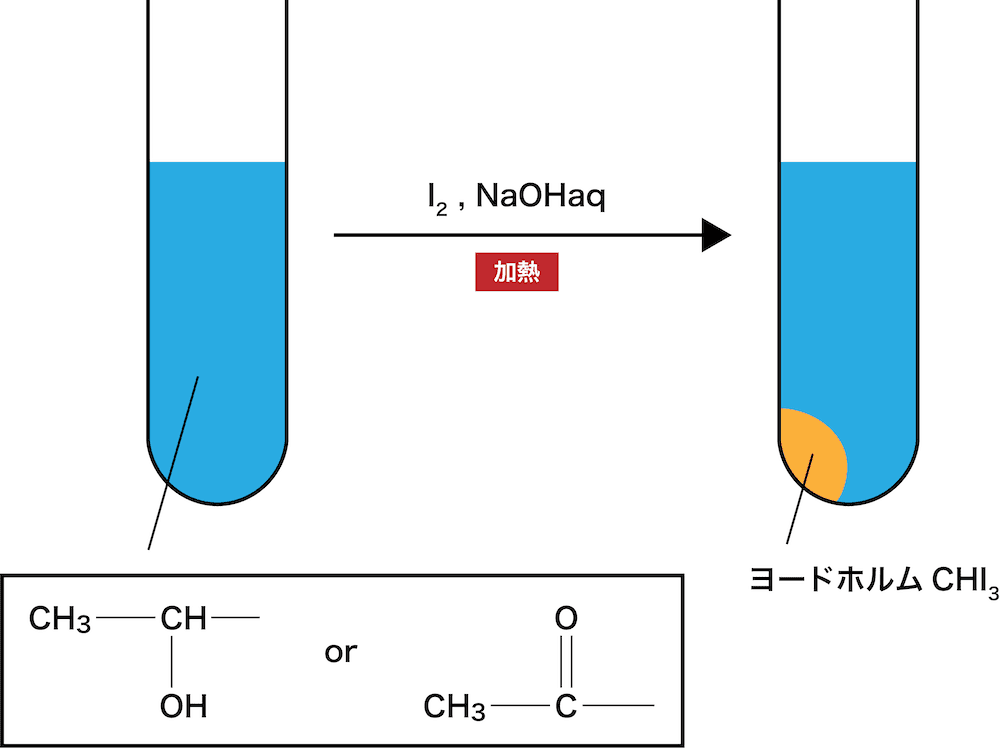
ケトンの反応(ヨードホルム反応)
- 次のような構造を持つアルコールやケトンにヨウ素I2と水酸化ナトリウムNaOH水溶液を加えて温めると特有の臭いをもつヨードホルムCHI3という黄色沈殿が得られる。
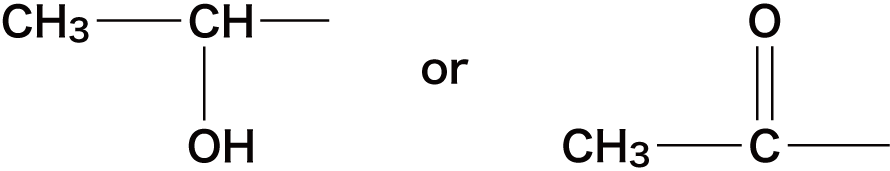
- この反応をヨードホルム反応という。
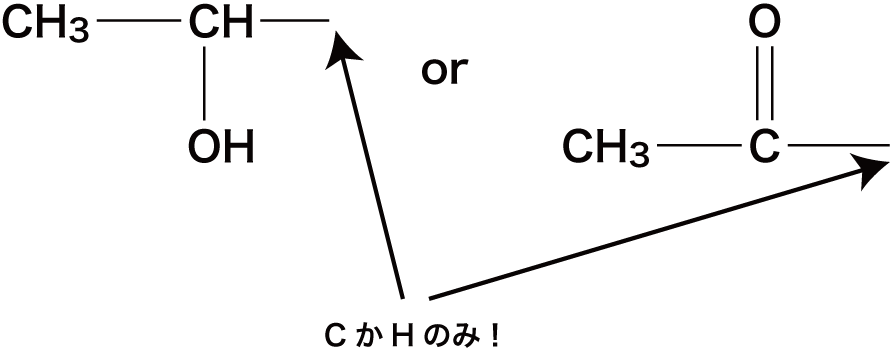
- ちなみに、ヨードホルム反応において、反応する部分構造に隣接する原子はCかHでなければならない。
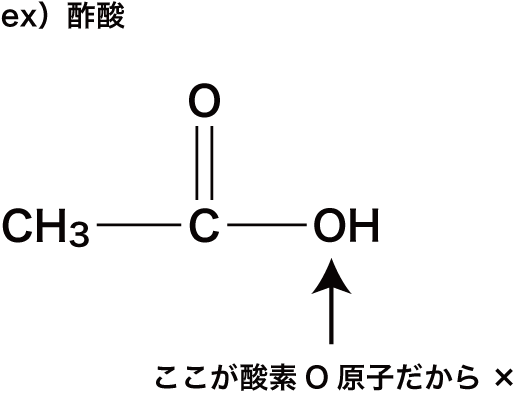
- 例えば、隣がOである酢酸はヨードホルム反応を起こさない。
ヨードホルム反応の原理
- 次の構造はアセチル基とよばれる。
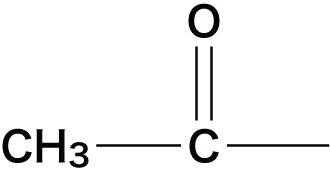
- アセチル基において、C-H結合が隣接するカルボニル基の影響で、塩基性条件下ではOHーによりH+が引き抜かれやすくなっている。
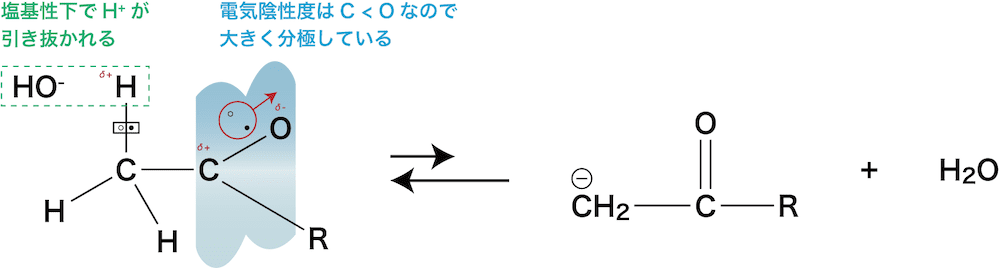
- ここに、酸化剤(電子を奪うもの)であるI2分子が接近すると、次のような反応が起こる。
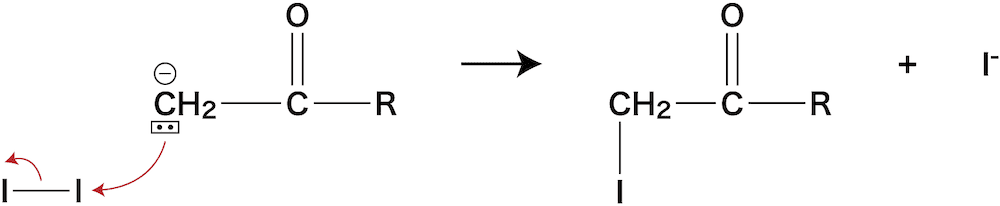
- これをもう2回繰り返すと…
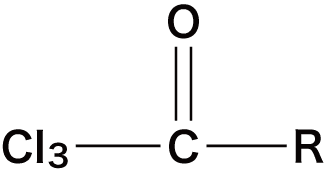
- ここで、さらに正電荷を帯びたカルボニル基の炭素がOHーに攻撃されて、次のような分解が進む。
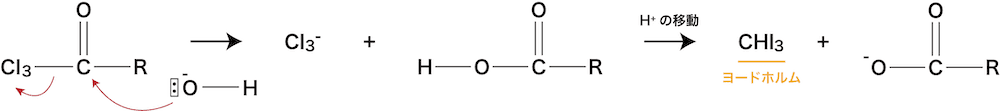
- 最終的にヨードホルムCHI3が生成しているのが確認できる。














