MENU
酸化数(求め方・ルール・例外・例題・一覧・演習問題)
はじめに
【プロ講師解説】このページでは『酸化数(求め方・ルール・例外・例題・一覧・演習問題)』について解説しています。
酸化数とは
- 物質のもつ電子が基準よりも多いか少ないかを表した値を酸化数という。
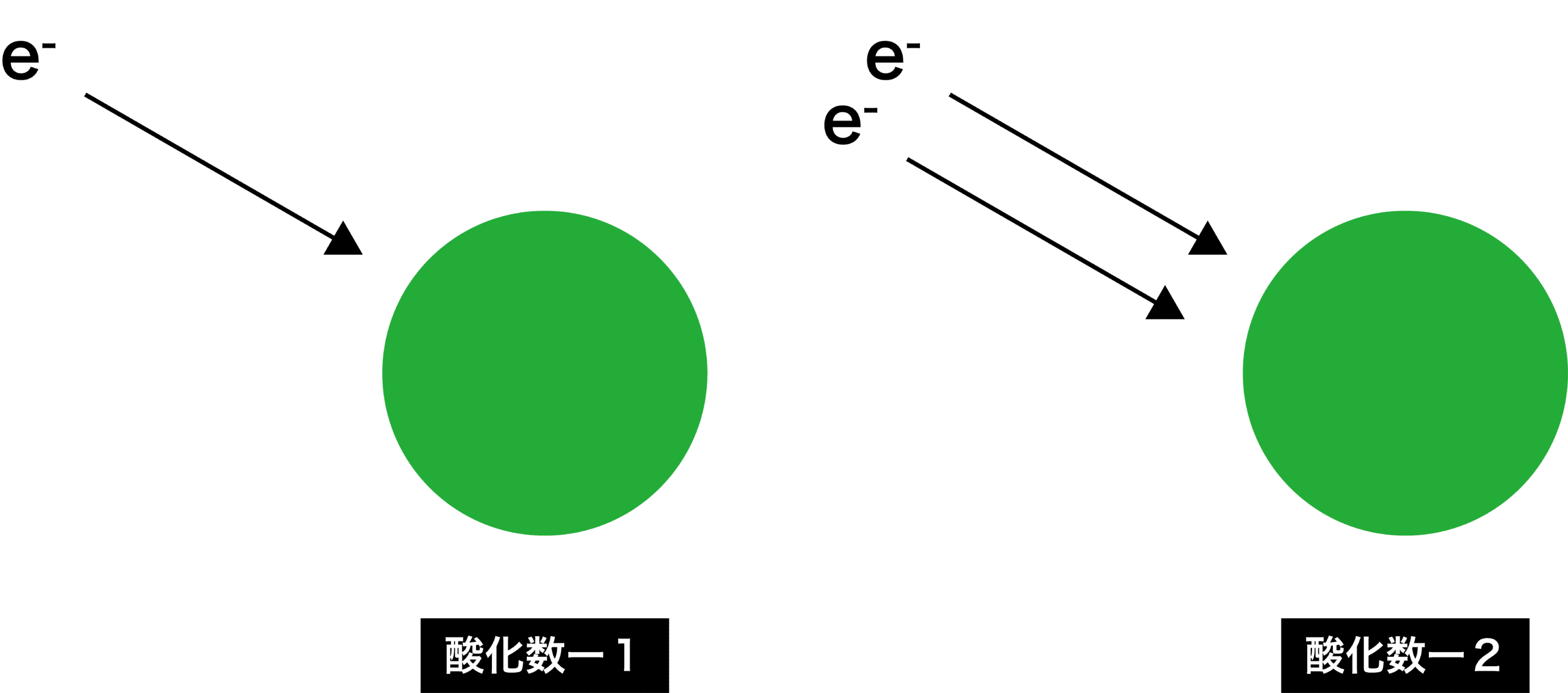
- 酸化された物質は、マイナスの電荷をもつ電子eーを失うためプラスに帯電する。電子eーを1個失うと酸化数+1、2個失うと酸化数+2となる。
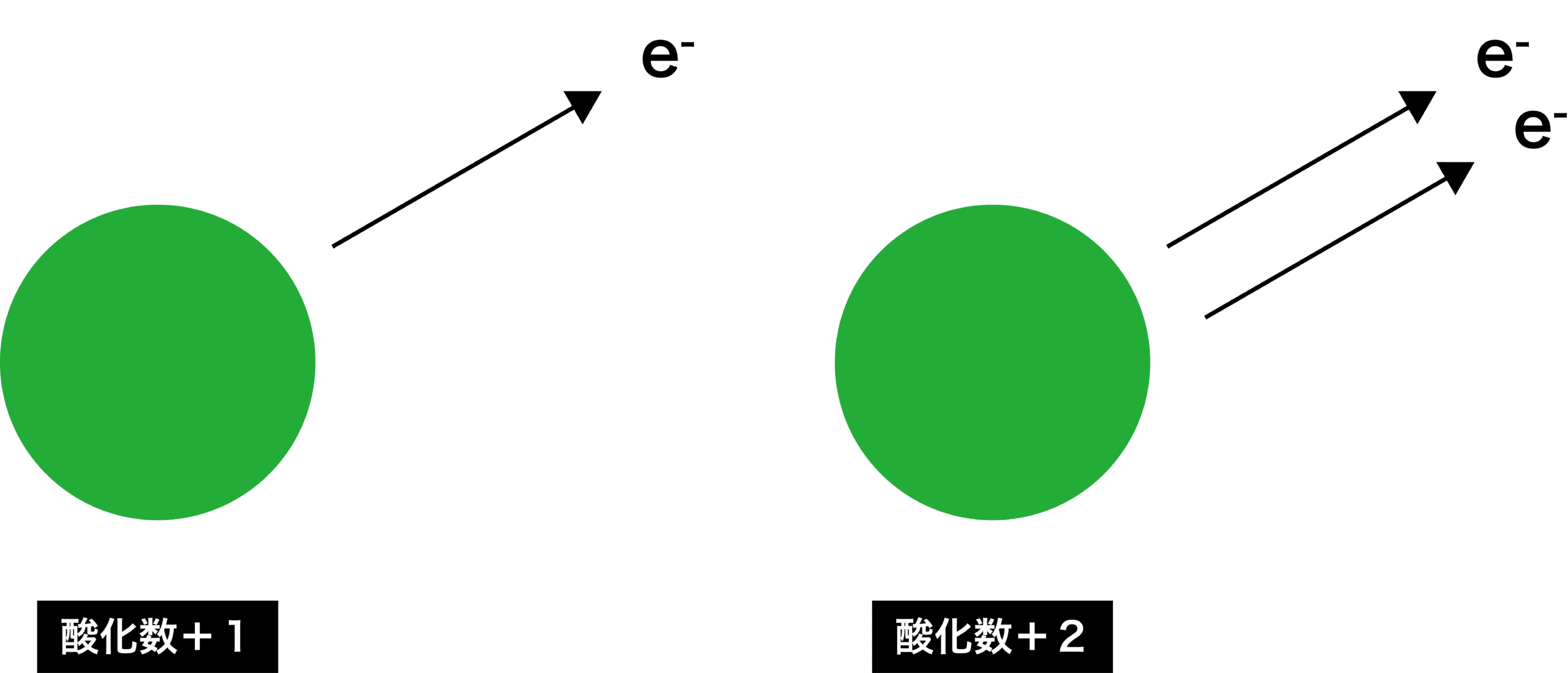
- 一方、還元された物質は、マイナスの電荷をもつ電子eーを得るため、マイナスに帯電する。電子eーを1個得ると酸化数ー1、2個得ると酸化数ー2となる。
- これ以降、原子の酸化数をどのように決定するのかについて具体例を用いながら解説する。
- 全て電気陰性度を使って説明するので電気陰性度についてよく復習してから学習することをオススメする。
単体の酸化数
- 単体の酸化数は0である。

- 単体の場合、2個の原子の電気陰性度に差がないため、共有電子対は2個の原子の中心に存在する。
- したがって、原子は電子eーを得ることも失うこともないため、酸化数は0となる。
化合物の酸化数
- 化合物全体の酸化数は0である。

- 化合物は異なる原子同士が結合してできており、原子の電気陰性度には当然差がある。
- 今回の化合物HClでは、共有電子対が電気陰性度の大きいClの方に引きつけられており、Clは電子eーを得ていると考えることができる。
- しかし、化合物全体で電子eーの総数は変化していないため、化合物全体の酸化数は0となる。
単原子イオンの酸化数
- 単原子イオンの酸化数はそのイオンの電荷と等しくなる。

- これは酸化数の定義が「電子eーが基準より多いか少ないかを表した値」であることを考えると当然である。
多原子イオンの酸化数
- 多原子イオンの酸化数については、単原子イオンの酸化数と同様の考え方をすればいい。
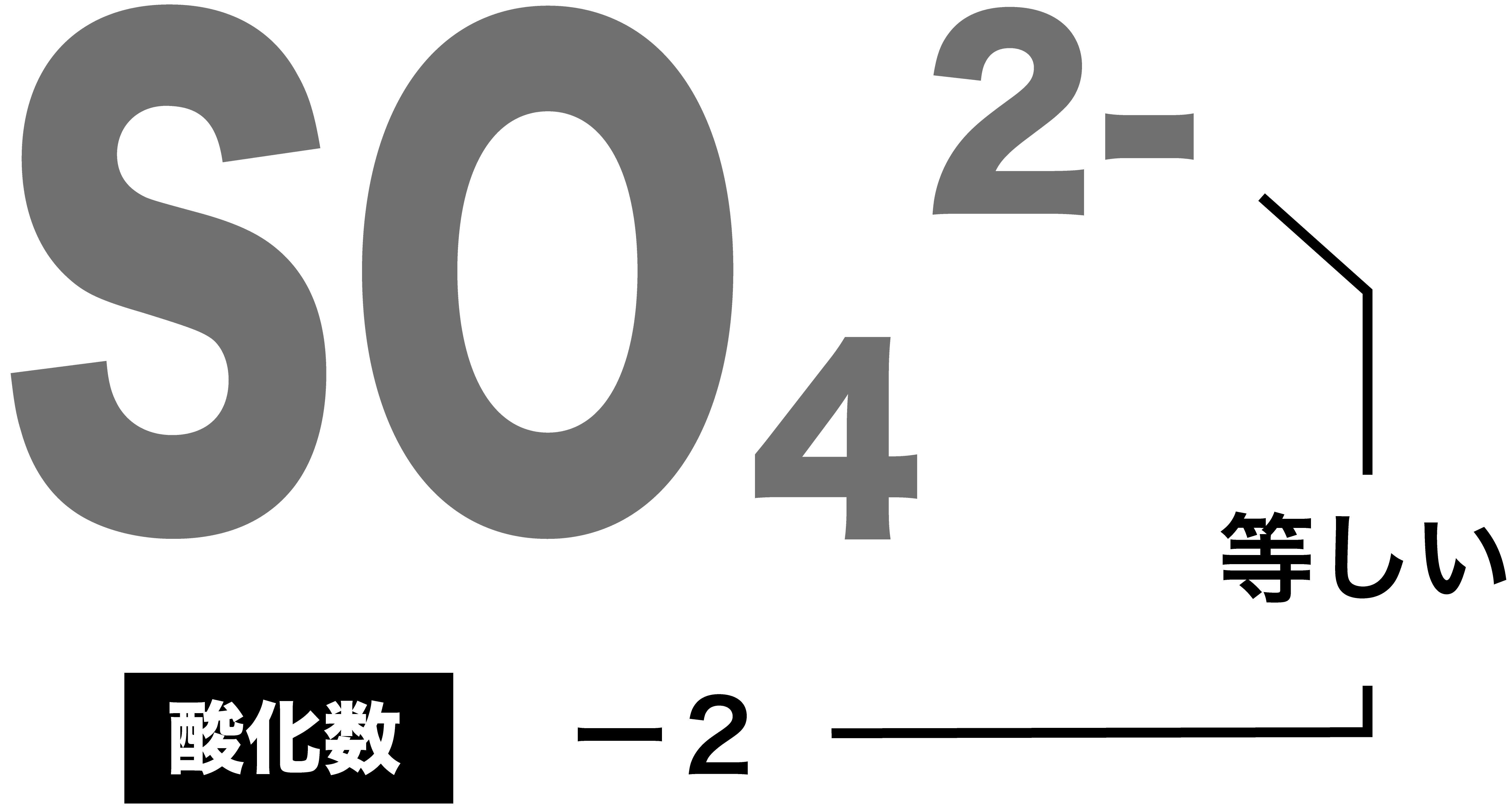
- 構成する原子の酸化数の総和が、イオンの電荷と一致する。
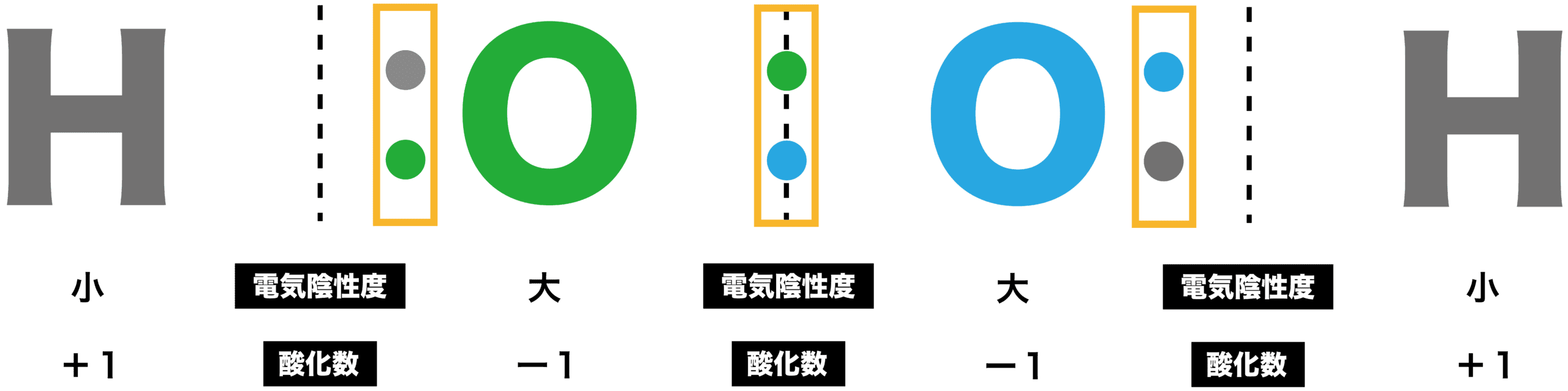
水素H原子の酸化数
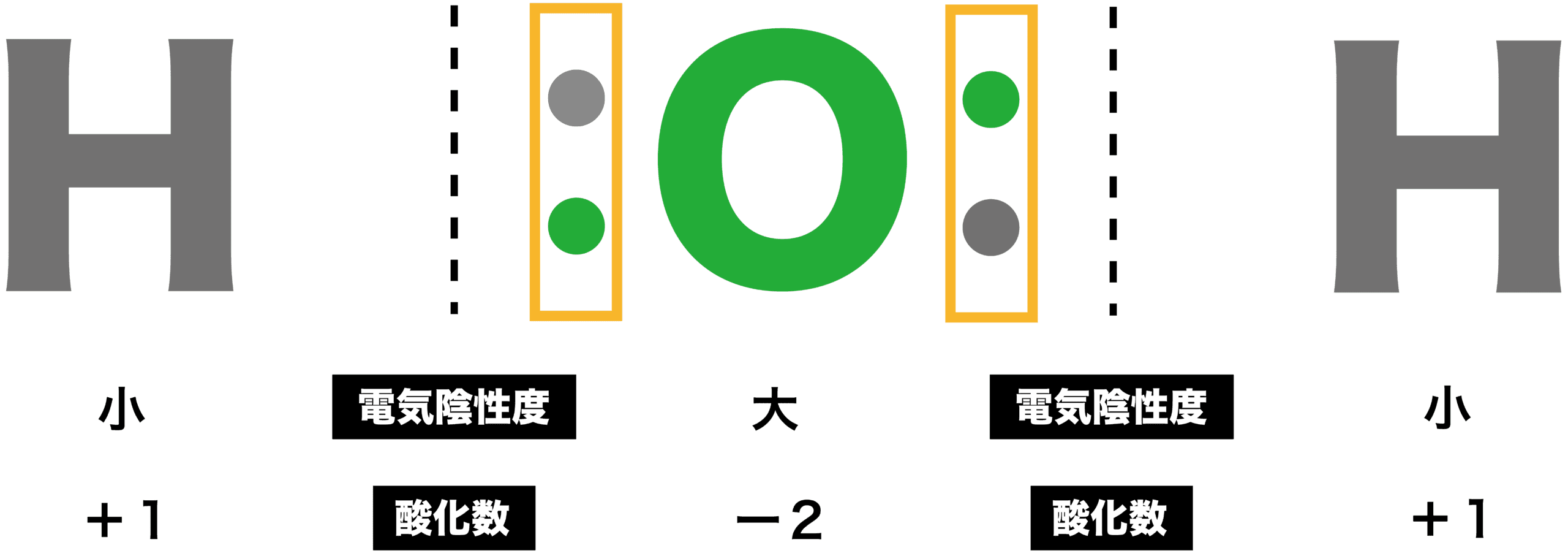
- 水素H原子は、他の非金属元素と比べると電気陰性度が小さいため、共有電子対が結合している相手の方に引きつけられ、酸化数は+1となる。

- ただし、金属元素と比べると電気陰性度が大きいため、金属の水素化物の場合は共有電子対が水素H原子の方に引きつけられて酸化数はー1となる。

酸素O原子の酸化数
- 酸素O原子は電気陰性度が大きく、2組の共有電子対を自分の方に引きつけるため、酸化数はー2となる。
- ただし、過酸化水素H2O2のような過酸化物(-O-O-構造をもつ)の場合、(片方の電子対しか引きつけないため)酸化数はー1となるので注意しよう。
アルカリ金属・二族元素の酸化数
- アルカリ金属(水素以外の一族元素)や二族元素は電気陰性度が小さく、共有電子対が結合している相手の方に引きつけられているため、酸化数はそれぞれ+1、+2となる。
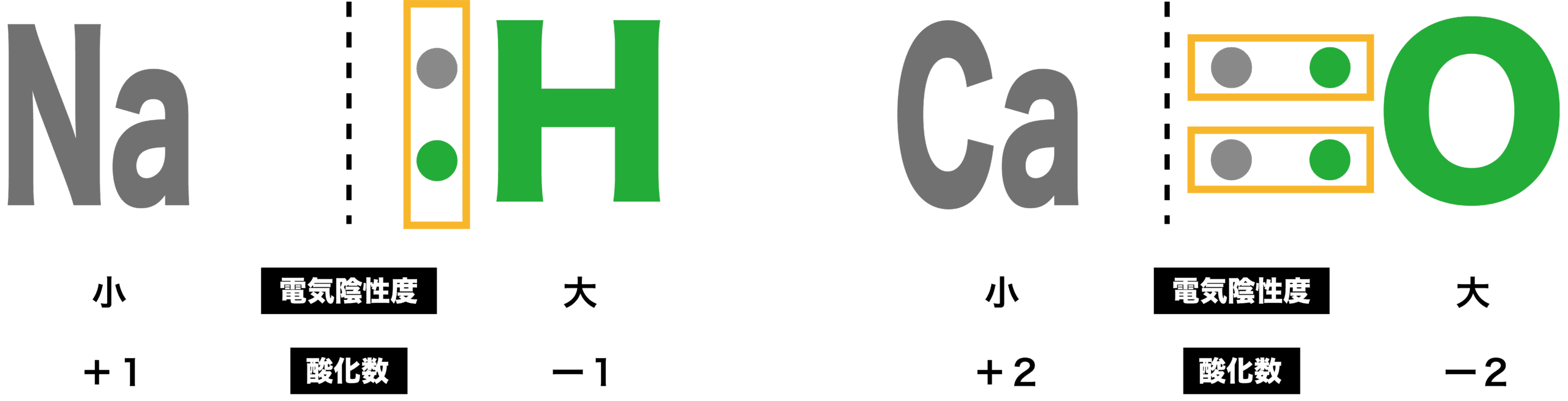
ハロゲンの酸化数
- ハロゲンは電気陰性度が大きく、共有電子対を自身の方に引きつけるため、酸化数はー1となる。

酸化数の求め方・ルール
- 酸化数を判断するときに重要となるルールをまとめる。
- 酸化数のルールには、酸化数を判断するときに必ず使う「ベースのルール」と、場合によって使ったり使わなかったりする「プラスのルール」が存在する。
ベースのルール
- 1〜3のうちどれか1個を必ず使う。
●RULE1
単体の酸化数は0
●RULE2
化合物全体の酸化数は0
●RULE3
イオン全体の酸化数は、その電荷に等しい
プラスのルール
- 状況に応じて1の方から優先的に使う1〜3のうちどれか1個を必ず使う
●RULE1
アルカリ金属 +1
2族元素 +2
●RULE2
水素H原子 +1
●RULE3
酸素O原子 ー2
●RULE4
ハロゲン(ハロゲン化物中) ー1
硫黄S原子(硫化物中) ー2
- これ以降、「ベースのルール」と「プラスのルール」に基づいた酸化数の求め方を、例題を用いながら解説する。
二酸化炭素CO2中のC原子の酸化数を求めよ。
- まず、「ベースのルール」のRULE2より、CO2全体の酸化数は0である。
\[ \underbrace{ \mathrm{CO_{2}} }
_{ 0 } \]
- 次に、プラスのルールのRULE3より、O原子の酸化数をー2とする。(今回はOが2個あるので(ー2)×2になる)
\[ \underbrace{ \mathrm{C}
\underbrace{ \mathrm{O_{2}} }
_{ (-2)×2 } }
_{ 0 } \]
- 以上より、化合物全体の酸化数が0、O原子の酸化数の合計がー4なので、C原子の酸化数は「+4」となる。
\[ \underbrace{ \underbrace{ \mathrm{C} }
_{ +4 }
\underbrace{ \mathrm{O_{2}} }
_{ (-2)×2 } }
_{ 0 } \]
酸化数まとめ
この『酸化数(求め方・ルール・例外・例題・一覧・演習問題)』のページで解説した内容をまとめる。
- 物質のもつ電子が基準よりも多いか少ないかを表した値を酸化数という。
- 酸化数を求める【ベースのルール】
●RULE1
単体の酸化数は0
●RULE2
化合物全体の酸化数は0
●RULE3
イオン全体の酸化数は、その電荷に等しい - 酸化数を求める【プラスのルール】
●RULE1
アルカリ金属 +1
2族元素 +2
●RULE2
水素H原子 +1
●RULE3
酸素O原子 ー2
●RULE4
ハロゲン(ハロゲン化物中) ー1
硫黄S原子(硫化物中) ー2
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
水H2O中のO原子の酸化数を求めよ。
解答/解説:タップで表示
解答:ー2
ベースのルール
1〜3のうちどれか1個を必ず使う
●RULE1
単体の酸化数は0
●RULE2
化合物全体の酸化数は0
●RULE3
イオン全体の酸化数は、その電荷に等しい
プラスのルール
状況に応じて1の方から優先的に使う1〜3のうちどれか1個を必ず使う
●RULE1
アルカリ金属 +1
2族元素 +2
●RULE2
水素H原子 +1
●RULE3
酸素O原子 ー2
●RULE4
ハロゲン(ハロゲン化物中) ー1
硫黄S原子(硫化物中) ー2
まず、ベースのルールのRULE2より、H2O全体の酸化数は0である。
\[ \underbrace{ \mathrm{H_{2}O} }
_{ 0 } \]
次に、プラスのルールのRULE2より、H原子の酸化数を+1とする。(今回はHが2個あるので(+1)×2になる)
\[ \underbrace{ \underbrace{ \mathrm{H_{2}} }
_{ (+1)×2 }
\mathrm{O} }
_{ 0 } \]
以上より、化合物全体の酸化数が0、H原子の酸化数の合計が+2なので、O原子の酸化数は「ー2」となる。
\[ \underbrace{ \underbrace{ \mathrm{H_{2}} }
_{ (+1)×2 }
\underbrace{ \mathrm{O} }
_{ -2 } }
_{ 0 } \]
H2O2の酸化数
「プラスのルール」のRULE3で酸素O原子の酸化数が「ー2」とあるが、最初から「酸素の酸化数はー2だ!」と決めつけてはいけない。優先順位を意識して考える必要がある。例として、過酸化水素H2O2中の酸素O原子の酸化数を考えていく。
まず、「ベースのルール」のRULE2より、H2O2全体の酸化数は0である。
\[ \underbrace{ \mathrm{H_{2}O_{2}} }
_{ 0 } \]
次に、プラスのルールのRULE2より、H原子の酸化数を+1とする。(今回はHが2個あるので(+1)×2になる)
\[ \underbrace{ \underbrace{ \mathrm{H_{2}} }
_{ (+1)×2 }
\mathrm{O_{2}} }
_{ 0 } \]
以上より、化合物全体の酸化数が0、H原子の酸化数の合計が+2なので、O原子1個の酸化数は「ー1」となる。
\[ \underbrace{ \underbrace{ \mathrm{H_{2}} }
_{ (+1)×2 }
\underbrace{ \mathrm{O_{2}} }
_{ (-1)×2 } }
_{ 0 } \]
二酸化炭素CO2中のC原子の酸化数を求めよ。
解答/解説:タップで表示
解答:+4
ベースのルール
1〜3のうちどれか1個を必ず使う
●RULE1
単体の酸化数は0
●RULE2
化合物全体の酸化数は0
●RULE3
イオン全体の酸化数は、その電荷に等しい
プラスのルール
状況に応じて1の方から優先的に使う1〜3のうちどれか1個を必ず使う
●RULE1
アルカリ金属 +1
2族元素 +2
●RULE2
水素H原子 +1
●RULE3
酸素O原子 ー2
●RULE4
ハロゲン(ハロゲン化物中) ー1
硫黄S原子(硫化物中) ー2
まず、「ベースのルール」のRULE2より、CO2全体の酸化数は0である。
\[ \underbrace{ \mathrm{CO_{2}} }
_{ 0 } \]
次に、「プラスのルール」のRULE3より、O原子の酸化数をー2とする。(今回はOが2個あるので(ー2)×2になる)
\[ \underbrace{ \mathrm{C}
\underbrace{ \mathrm{O_{2}} }
_{ (-2)×2 } }
_{ 0 } \]
以上より、化合物全体の酸化数が0、O原子の酸化数の合計がー4なので、C原子の酸化数は「+4」となる。
\[ \underbrace{ \underbrace{ \mathrm{C} }
_{ +4 }
\underbrace{ \mathrm{O_{2}} }
_{ (-2)×2 } }
_{ 0 } \]
炭酸水素ナトリウムNaHCO3中のC原子の酸化数を求めよ。
解答/解説:タップで表示
解答:+4
ベースのルール
1〜3のうちどれか1個を必ず使う
●RULE1
単体の酸化数は0
●RULE2
化合物全体の酸化数は0
●RULE3
イオン全体の酸化数は、その電荷に等しい
プラスのルール
状況に応じて1の方から優先的に使う1〜3のうちどれか1個を必ず使う
●RULE1
アルカリ金属 +1
2族元素 +2
●RULE2
水素H原子 +1
●RULE3
酸素O原子 ー2
●RULE4
ハロゲン(ハロゲン化物中) ー1
硫黄S原子(硫化物中) ー2
まず、「ベースのルール」のRULE2より、NaHCO3全体の酸化数は0である。
\[ \underbrace{ \mathrm{NaHCO_{3}} }
_{ 0 } \]
次に、プラスのルールのRULE1より、Na原子の酸化数を+1とする。
\[ \underbrace{ \underbrace{ \mathrm{Na} }
_{ +1 }
\mathrm{HCO_{3}}}
_{ 0 } \]
次に、プラスのルールのRULE2より、H原子の酸化数を+1とする。
\[ \underbrace{ \underbrace{ \mathrm{Na} }
_{ +1 }
\underbrace{ \mathrm{H} }
_{ +1 }
\mathrm{CO_{3}}}
_{ 0 } \]
次に、プラスのルールのRULE3より、O原子の酸化数をー2とする。(今回はOが3個あるので(ー2)×3になる)
\[ \underbrace{ \underbrace{ \mathrm{Na} }
_{ +1 }
\underbrace{ \mathrm{H} }
_{ +1 }
\mathrm{C}
\underbrace{\mathrm{ O_{3}} }
_{ (-2)×3 } }
_{ 0 } \]
以上より、化合物全体の酸化数が0、Na原子の酸化数が+1、H原子の酸化数が+1、O原子の酸化数の合計がー6なので、C原子の酸化数は「+4」となる。
\[ \underbrace{ \underbrace{\mathrm{ Na} }
_{ +1 }
\underbrace{\mathrm{ H} }
_{ +1 }
\underbrace{ \mathrm{C} }
_{ +4 }
\underbrace{ \mathrm{O_{3}} }
_{ (-2)×3 } }
_{ 0 } \]
硫酸H2SO4中のS原子の酸化数を求めよ。
解答/解説:タップで表示
解答:+6
ベースのルール
1〜3のうちどれか1個を必ず使う
●RULE1
単体の酸化数は0
●RULE2
化合物全体の酸化数は0
●RULE3
イオン全体の酸化数は、その電荷に等しい
プラスのルール
状況に応じて1の方から優先的に使う1〜3のうちどれか1個を必ず使う
●RULE1
アルカリ金属 +1
2族元素 +2
●RULE2
水素H原子 +1
●RULE3
酸素O原子 ー2
●RULE4
ハロゲン(ハロゲン化物中) ー1
硫黄S原子(硫化物中) ー2
まず、「ベースのルール」のRULE2より、H2SO4全体の酸化数は0である。
\[ \underbrace{ \mathrm{H_{2}SO_{4}} }
_{ 0 } \]
次に、プラスのルールのRULE2より、H原子の酸化数を+1とする。(今回はHが2個あるので(+1)×2になる)
\[ \underbrace{ \underbrace{ \mathrm{H_{2}} }
_{ (+1)×2 }
\mathrm{SO_{4}}}
_{ 0 } \]
次に、プラスのルールのRULE3より、O原子の酸化数をー2とする。(今回はOが4個あるので(ー2)×4になる)
\[ \underbrace{ \underbrace{ \mathrm{H_{2}} }
_{ (+1)×2 }
\mathrm{S}
\underbrace{ \mathrm{O_{4}} }
_{ (-2)×4 } }
_{ 0 } \]
以上より、化合物全体の酸化数が0、H原子の酸化数の合計が+2、O原子の酸化数の合計がー8なので、S原子の酸化数は「+6」となる。
\[ \underbrace{ \underbrace{ \mathrm{H_{2}} }
_{ (+1)×2 }
\underbrace{ \mathrm{S} }
_{ +6 }
\underbrace{ \mathrm{O_{4}} }
_{ (-2)×4 } }
_{ \mathrm{0} } \]
硫酸イオンSO42ー中のS原子の酸化数を求めよ。
解答/解説:タップで表示
解答:+6
ベースのルール
1〜3のうちどれか1個を必ず使う
●RULE1
単体の酸化数は0
●RULE2
化合物全体の酸化数は0
●RULE3
イオン全体の酸化数は、その電荷に等しい
プラスのルール
状況に応じて1の方から優先的に使う1〜3のうちどれか1個を必ず使う
●RULE1
アルカリ金属 +1
2族元素 +2
●RULE2
水素H原子 +1
●RULE3
酸素O原子 ー2
●RULE4
ハロゲン(ハロゲン化物中) ー1
硫黄S原子(硫化物中) ー2
まず、ベースのルールのRULE3より、SO42ー全体の酸化数はー2である。
\[ \underbrace{ \mathrm{SO_{4}^{2-}} }
_{ -2 } \]
次に、プラスのルールのRULE3より、O原子の酸化数をー2とする。(今回はOが4個あるので(ー2)×4になる)
\[ \underbrace{ \mathrm{S}
\underbrace{ \mathrm{O_{4}^{2-}} }
_{ (-2)×4 } }
_{ -2 }
\]
以上より、イオン全体の酸化数がー2、O原子の酸化数の合計がー8なので、S原子の酸化数は「+6」となる。
\[ \underbrace{ \underbrace{ \mathrm{S} }
_{ +6 }
\underbrace{ \mathrm{O_{4}^{2-}} }
_{ (-2)×4 } }
_{ -2 } \]













