MENU
電気陰性度(表・覚え方・一覧・電子親和力との関係など)
はじめに
【プロ講師解説】このページでは『電気陰性度(表・覚え方・一覧・電子親和力との関係など)』について解説しています。
電気陰性度とは
- 異なる2つの原子(グレーとグリーン)が結合するとき、お互いが電子を1個ずつ出し合い、共有電子対を形成する。
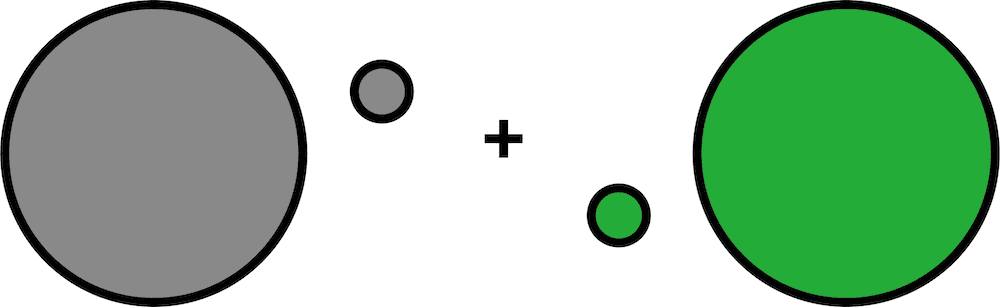
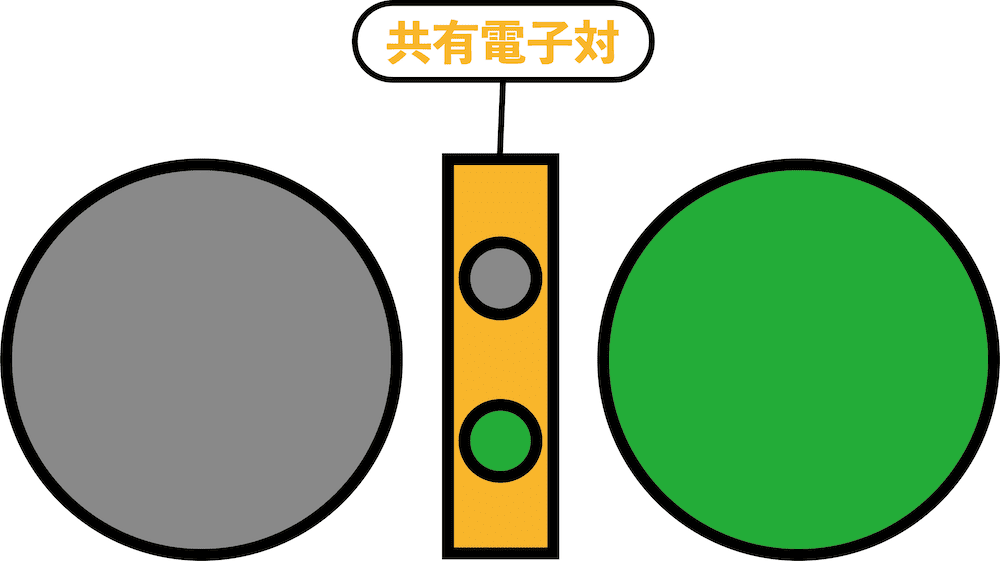
- このとき、原子が共有電子対を自分の方に引っ張る強さを電気陰性度という。
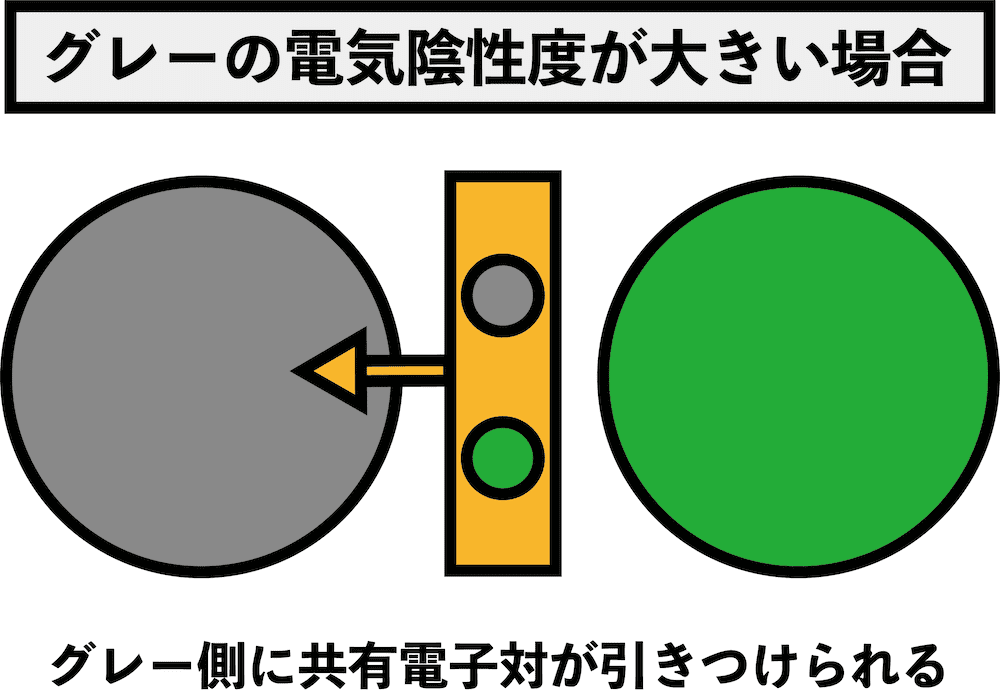
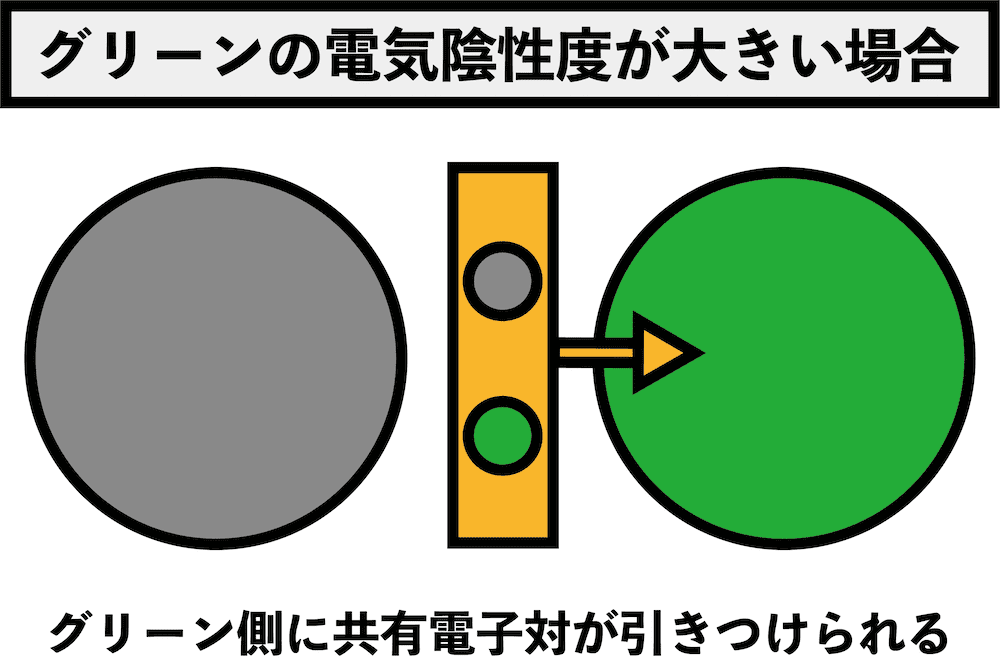
- 電気陰性度の大きい原子が、共有電子対をより強く自分側に引き寄せる。
電気陰性度の周期表上での傾向
- 電気陰性度は周期表の右上にいくほど大きくなり、ハロゲンのフッ素が最大である。
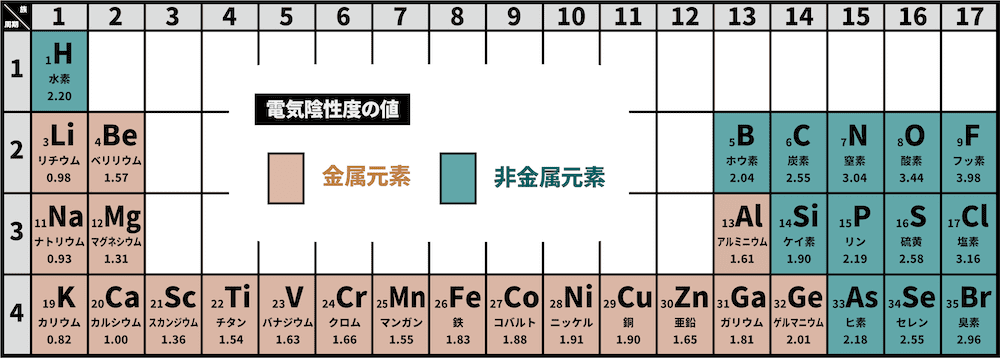
- この周期表において、緑は非金属元素、茶色は金属元素である。
- 非金属元素は陰性が強く、電子を欲しがるため電気陰性度が大きい。一方、金属元素は陽性が強く、電子を欲しがらないため電気陰性度が小さい。
電気陰性度は結合をするときの指標なので、閉殻状態で反応性の低い18族の貴ガスでは、考える必要がありません(貴ガスの電子配置)。
電気陰性度の周期表上での傾向に関する注意点・応用事項
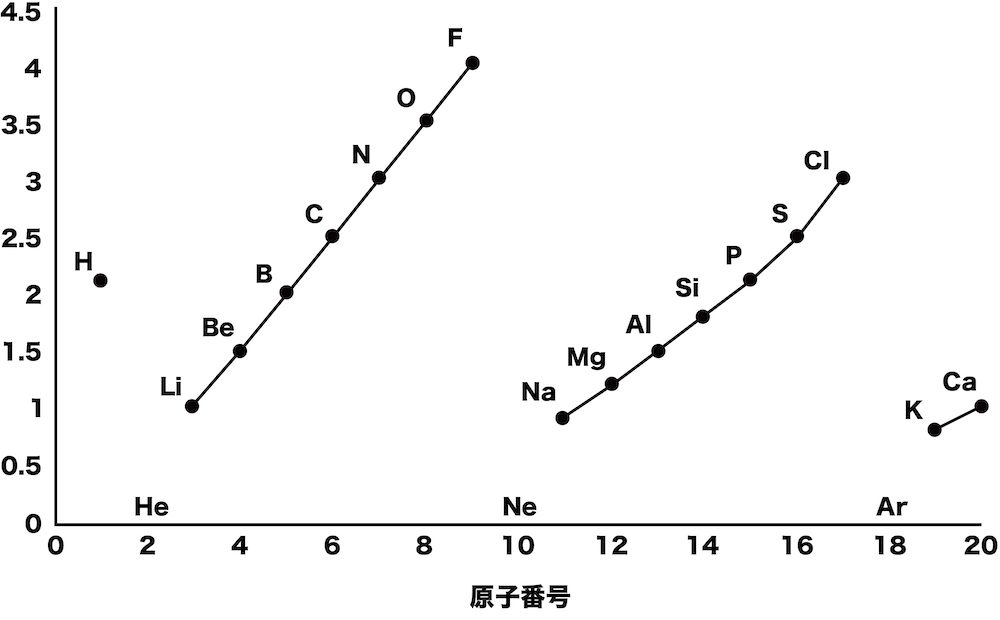
電気陰性度のグラフ
- 電気陰性度に関するグラフとして次のようなものが出題されることが多い。周期表と照らし合わせて覚えておこう。
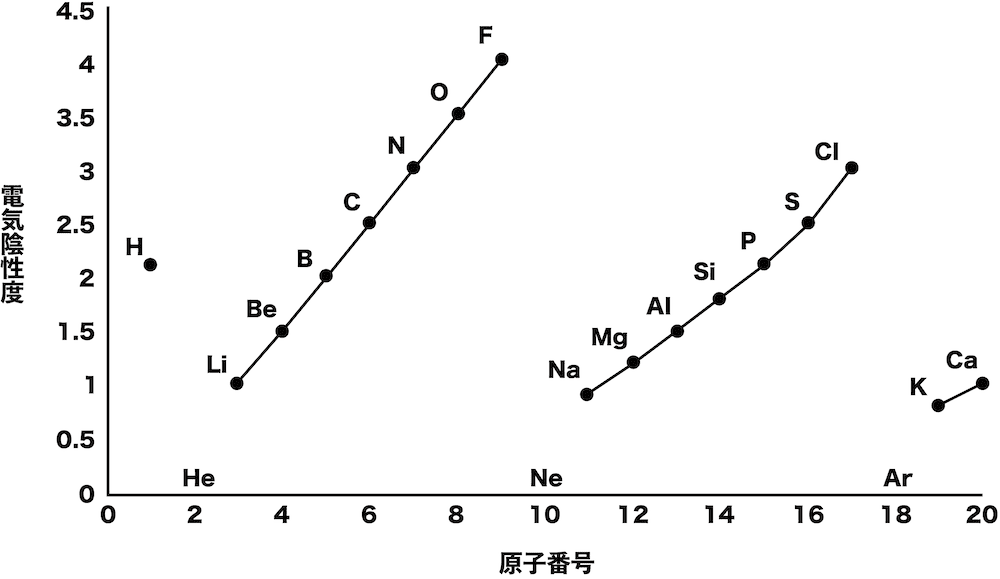
水素の電気陰性度
- 水素の電気陰性度は「周期表の右上に行くにしたがって大きくなる」というルールに従わない。
- 水素は電子を1つしかもっていないので、それを出すと電子が1つもない“原子核のみ”の状態になってしまう。原子核単体だと非常に不安定なので、水素はあまり電子を出したがらない。よって、その1つの電子を奪われないように電気陰性度が非常に大きくなっている。
電気陰性度と第一イオン化エネルギー・電子親和力の関係
- 第一イオン化エネルギーは「自分の電子を守る力(=防御力)」、電子親和力は「相手の電子を奪う力(=攻撃力)」である。
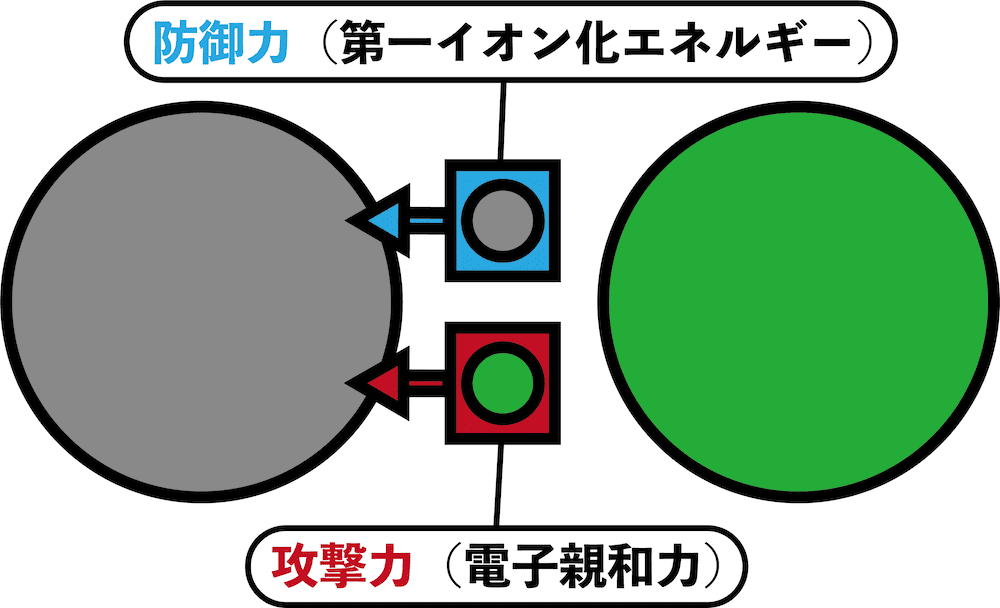
- 共有電子対は「自分の電子」と「相手の電子」が組み合わさってできたものである。
- したがって、電気陰性度、つまり「共有電子対を自分の方に引っ張る力」は、自分の電子を守る力(=防御力=第一イオン化エネルギー)と相手の電子を奪い取る力(=攻撃力=電子親和力)の両方を合わせた総合力ということになる。
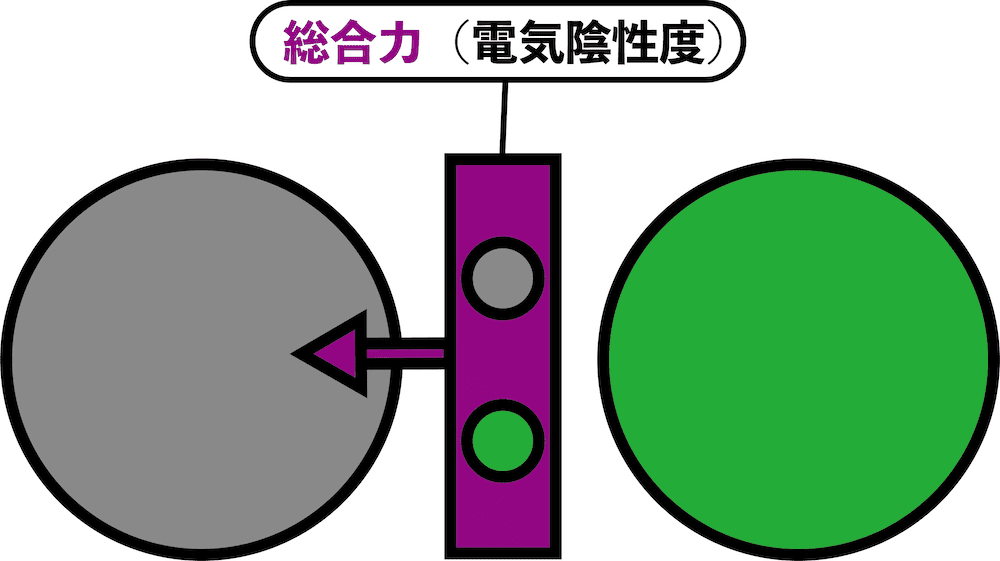
第一イオン化エネルギー、電子親和力について詳しくは、次のページを確認しましょう。
・第一イオン化エネルギー(周期表での最大最小・グラフ・電子親和力との違いなど)
・電子親和力(周期表上での最大最小・グラフ・希ガスやハロゲンの場合など)
電気陰性度とマリケンの評価方法
- 電気陰性度・イオン化エネルギー・電子親和力の関係を表したマリケンの定義とよばれる式が存在する。

- この式をみると、電気陰性度はイオン化エネルギーと電子親和力の和に比例しており、イオン化エネルギーと電子親和力が大きくなればなるほど電気陰性度も大きくなるということがわかる。

※マリケンの定義は正確性に欠けることがわかり、現在はあまり使われていない。代わりにポーリングの定義が使われている。(マリケンの定義も、式が綺麗でわかり易いので参考にするのは全然あり)
電気陰性度と化学結合
- 結合は原子間の結合と分子間の結合に分類することができる。
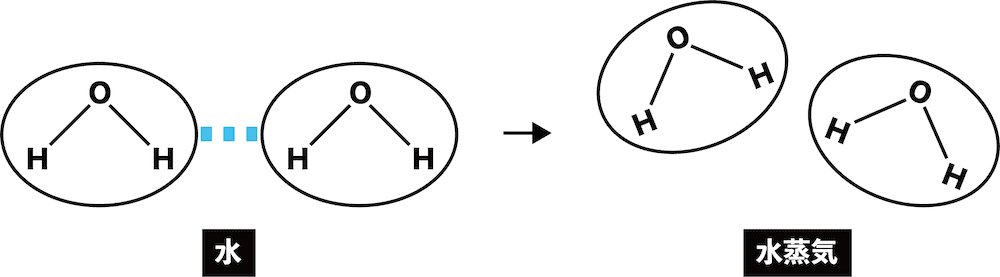
- 分子間の結合が切れた場合、状態が変化するだけで物質の種類そのものは変化しない。たとえば水H2Oの分子間の結合が切れると水蒸気になるが、あくまで物質はH2Oのままである。
参考:分子間力(水素結合・ファンデルワールス力・沸点のグラフなど)
- 一方、原子間の結合が切れた場合、H2OはH原子とO原子に変化するため、H2Oではなくなる。このような原子間の結合を化学結合という。
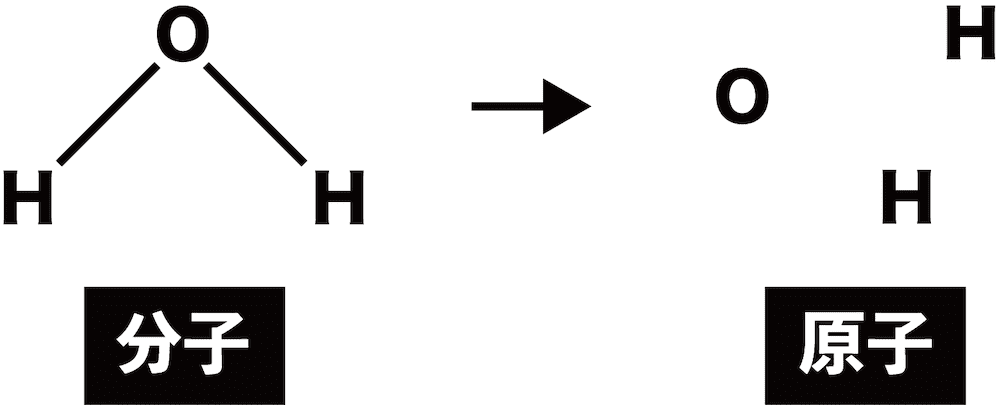
- 化学結合の種類は電気陰性度で決まる。非金属元素の電気陰性度は大きく、金属元素の電気陰性度は小さい。
- 結合している元素が金属元素か非金属元素かで結合の種類を判断する。
電気陰性度と極性
- 極性は「分子内での電子の偏り」を表す指標である。
- 先述の通り、電気陰性度は「電子を自分の方に引っ張る力」を表している。したがって、電気陰性度はこの”極性”を生み出す原因になる。

- 電気陰性度が大きい方の原子(ここではCl)は共有電子対を自分の方に引っ張るため、電荷がやや負に偏る(これをδ–と表す)。一方、電気陰性度が小さい方の原子(ここではH)は電荷がやや正に偏る(これをδ+と表す)。
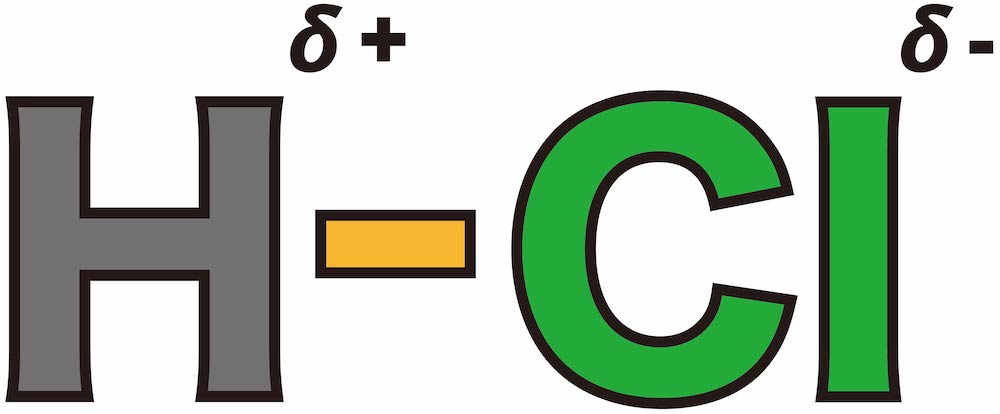
電気陰性度まとめ
この『電気陰性度(表・覚え方・一覧・電子親和力との関係など)』のページで解説した内容をまとめる。
演習問題
【プロ講師解説】化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
原子が共有電子対を自分の方に引っ張る強さを【1】という。
解答/解説:タップで表示
解答:【1】電気陰性度
原子が共有電子対を自分の方に引っ張る強さを電気陰性度という。
電気陰性度は同一周期において、右にいくほど【1(大き or 小さ)】くなる傾向がある。
解答/解説:タップで表示
解答:【1】大き
電気陰性度は同一周期において、右にいくほど大きくなる傾向がある。
電気陰性度は同族において、下にいくほど【1(大き or 小さ)】くなる傾向がある。
解答/解説:タップで表示
解答:【1】小さ
電気陰性度は同族において、下にいくほど小さくなる傾向がある。
周期表の左下にある元素は【1(陽 or 陰)】性が強い傾向がある。
解答/解説:タップで表示
解答:【1】陽
周期表の左下にある元素は陽性が強い傾向がある。
周期表の右上にある元素は【1(陽 or 陰)】性が強い傾向がある。
解答/解説:タップで表示
解答:【1】陰
周期表の右上にある元素は陰性が強い傾向がある。
電気陰性度の周期表上での傾向を表すグラフとして適切なのはどれか。
①
②
③
解答/解説:タップで表示
解答:③
①はイオン化エネルギー、②は電子親和力、③は電気陰性度を表したグラフである。
参考:イオン化エネルギー(周期表での最大最小・グラフ・電子親和力との違いなど)
参考:電子親和力(周期表上での最大最小・グラフ・希ガスやハロゲンの場合など)














