MENU
金属結合(例・強さ・自由電子の役割など)
はじめに
【プロ講師解説】このページでは『金属結合(例・強さ・自由電子の役割など)』について解説しています。
金属結合とは
- どんな結合も不対電子の共有で始まる。
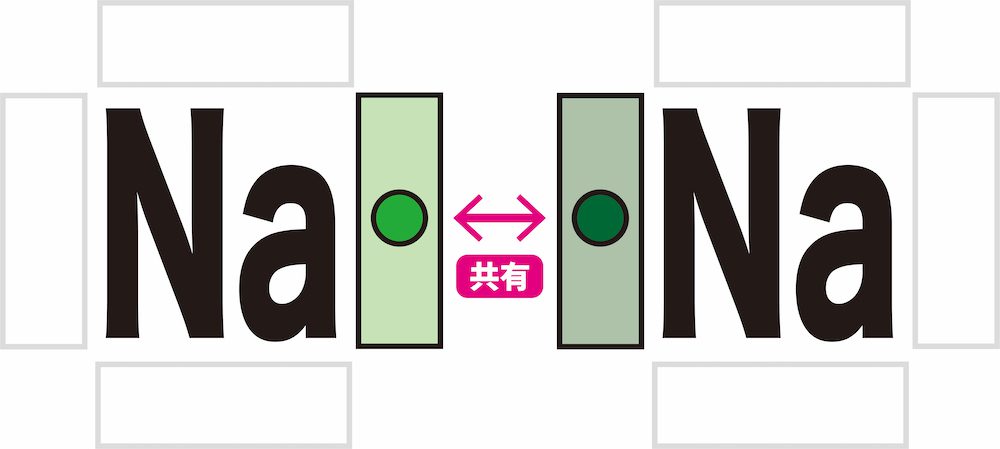
- 金属原子はいずれも電気陰性度が小さく、電子を引きつける力が弱い。したがって、金属結合において共有電子対はどちらの原子のものにもならず、自由に動き回る(この電子を自由電子という)。
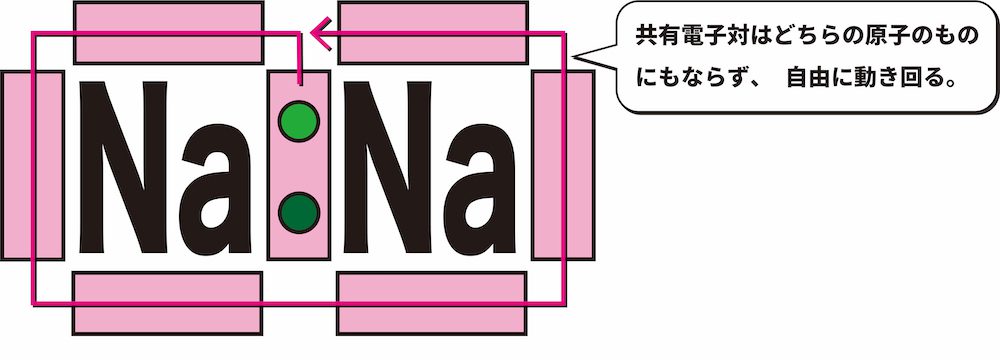
- このとき、金属原子は(電子を失ったので)陽イオンになっており、全ての陽イオンで自由電子を共有しているような状態になる。

- このように、自由電子により金属元素の陽イオンが繋ぎ止められてできる結合を金属結合という。
参考:電気陰性度(表・覚え方・一覧・電子親和力との関係など)
参考:陽イオン・陰イオン(違い・一覧・イオン式・価数・多原子イオンなど)
金属結合では、電子が特定の原子間で共有されているのではなく、全ての原子間で共有されています。したがって、金属結合には共有結合のような”方向性”はみられません。
参考:共有結合(例・イオン結合や配位結合との違いなど)
金属結晶とその性質(自由電子)
- 金属結合によってできる結晶を金属結晶(金属)という。
- 金属結晶の特徴は次の通りである。
●金属結晶の特徴
- 熱・電気伝導性が高い
- 展性・延性がある
- 金属光沢がある
❶ 熱・電気伝導性が高い
- 金属中を自由電子が移動することで熱や電気のエネルギーが伝えられるため、金属は熱・電気伝導性が高い。また、熱をよく通す金属は電気も同様によく通す。
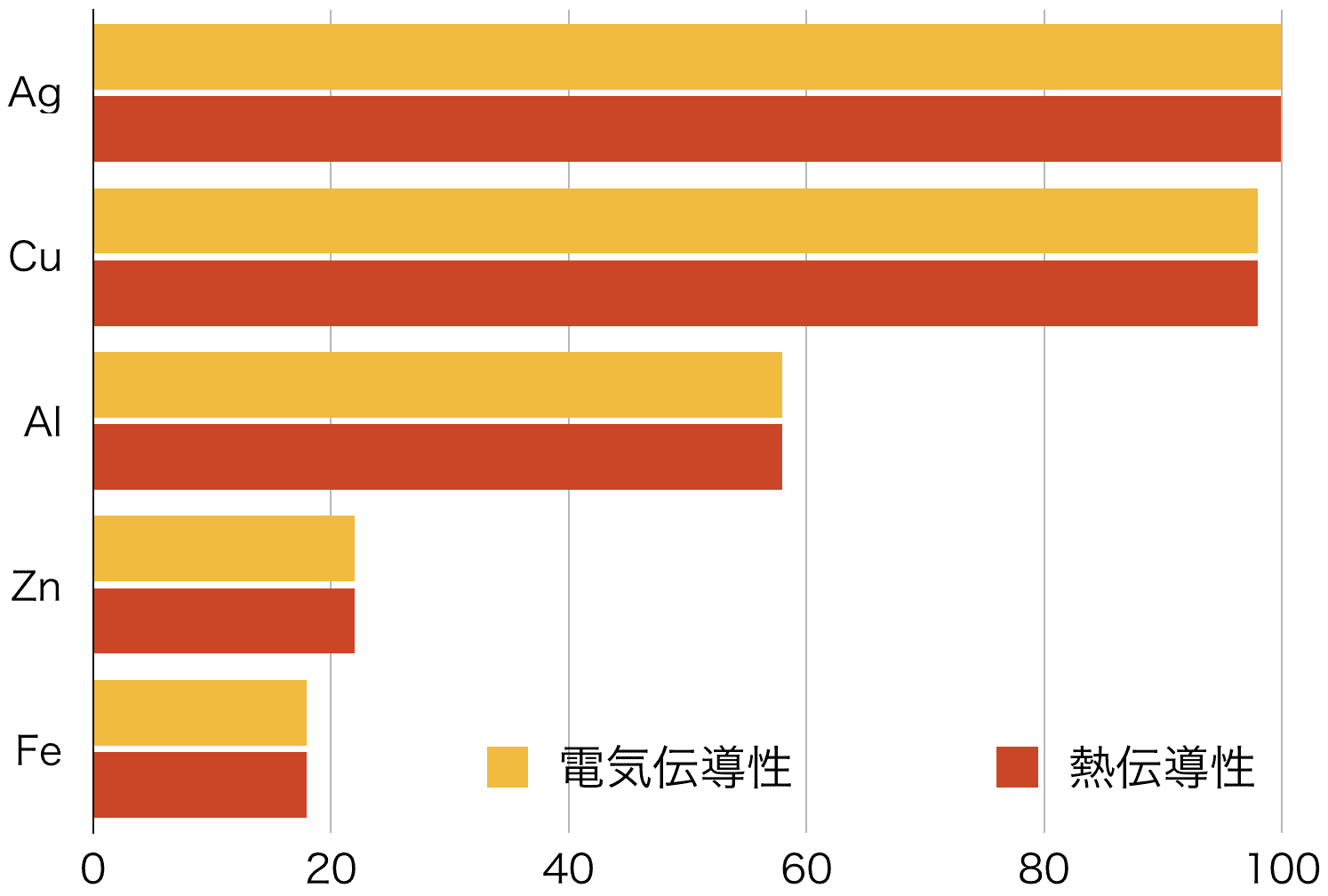
※Agの電気・熱伝導性を100としたときの値
❷ 展性・延性がある
- 金属は展性(薄く箔状に広がる性質)、延性(細く線状に延びる性質)をもち、叩いたり延ばしたりしても変形するだけで、簡単には切れない。

- これは、金属結合では原子の位置が多少ズレても、自由電子が適した位置に移動し金属原子を包み込むことにより、結合力を保てるためである。
❸ 金属光沢がある
- 金属は特有の光沢をもち、これを金属光沢という。
- 金属光沢は、自由電子が光を反射するため起こる。
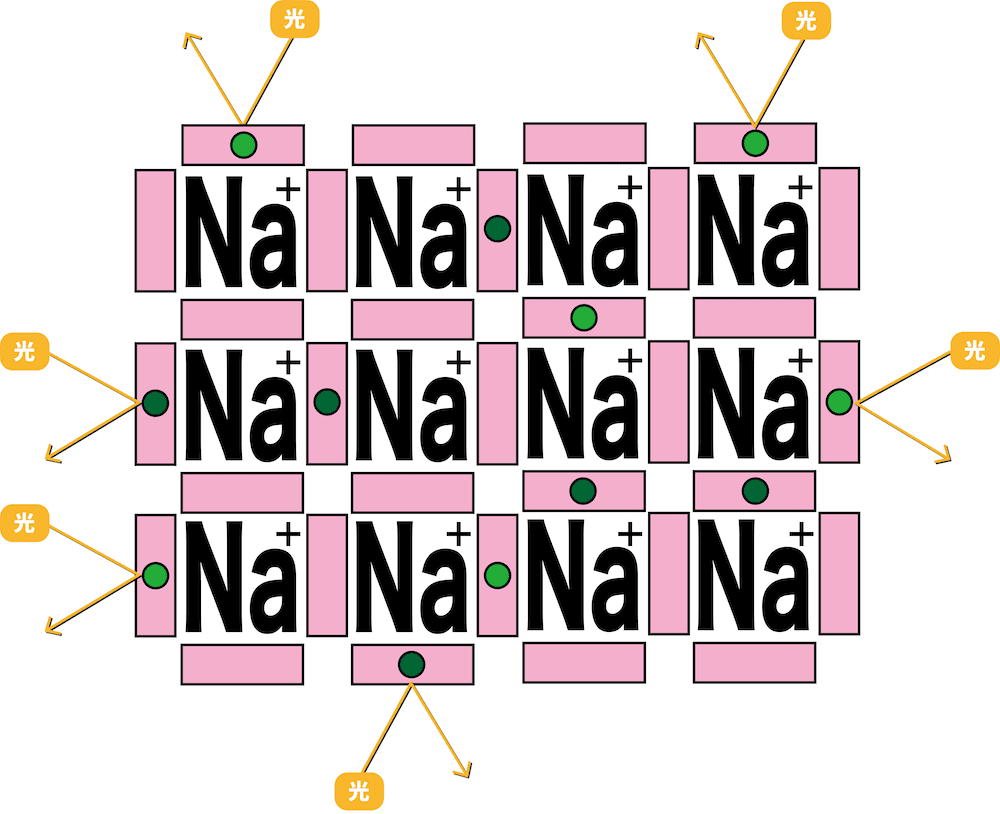
3つの性質全てに自由電子が関わっている点に注目しましょう。自由電子は金属結合を考える上で非常に重要なことがわかりますね。
金属光沢の原理
- 金属では、自由電子が可視光を吸収し、それを再放射するため、金属光沢がみられる。
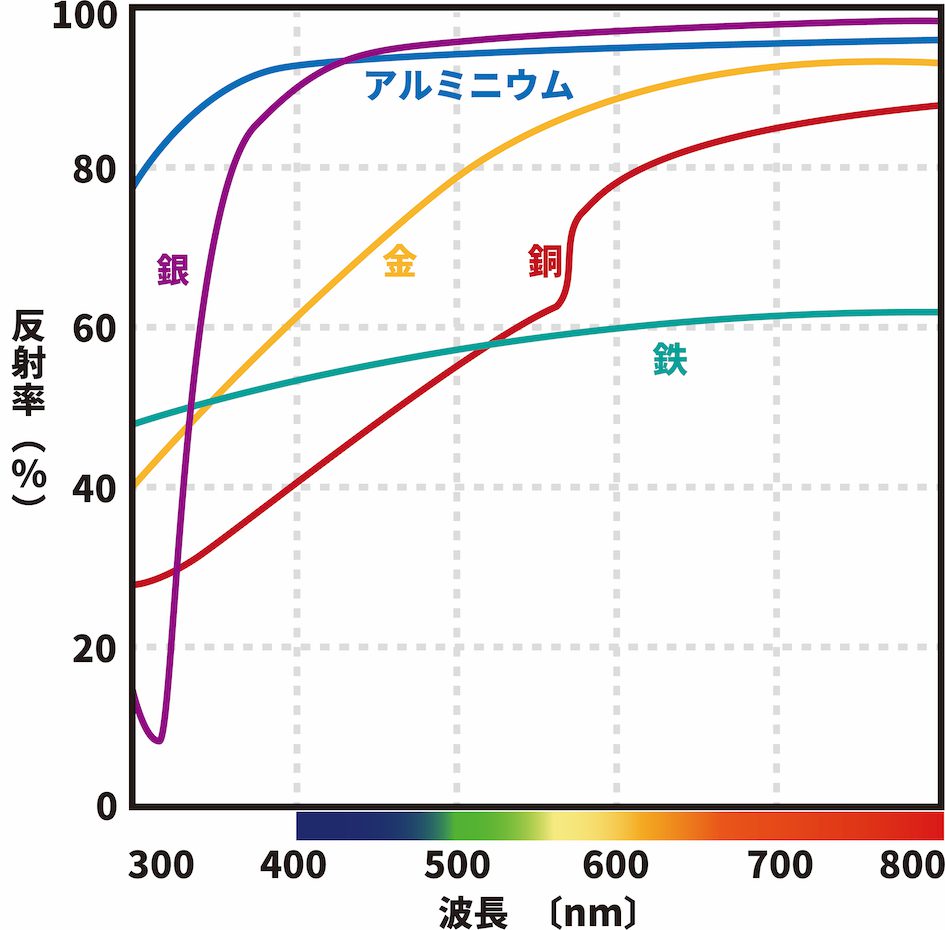
可視光とは、人間の目に光として見える波長の電磁波です。一般に、約360~830nmの範囲を指します。
アルミニウム/銀など
- ほぼ全ての可視光を反射するため、白色の光沢をもつ。
銅
- 可視光のうち、赤色系の光をよく反射するため、赤色の光沢をもつ。
金
- 可視光のうち、緑~赤系の光をよく反射するため、黄色の光沢をもつ。
金属の硬さ・融点
- 金属結合では、一原子あたりの自由電子の数が多くなるほど結合が強く、融点が高くなる。また、自由電子の数が同じ場合、金属原子の原子半径が小さいほど金属結合は強くなる。
- アルカリ金属は、一原子あたりの自由電子の数が少なく、原子半径が大きい。したがって、金属結合が比較的弱いため、柔らかく低融点のものが多い。
- 典型元素の金属は柔らかく低融点のものが多い。一方、遷移元素の金属は硬く高融点のものが多い。
| 典型元素 | 低融点 |
| 遷移元素 | 高融点 |
金属結合と組成式
- 金属の単体は金属結晶であり、無数の金属原子が結合しているので、イオン結晶と同様、組成式で表される。
| 銀 | Ag |
| 銅 | Cu |
| アルミニウム | Al |
金属結合まとめ
この『金属結合(例・強さ・自由電子の役割など)』のページで解説した内容をまとめる。
- 金属原子はいずれも電気陰性度が小さく、電子を引きつける力が弱い。したがって、金属結合において共有電子対はどちらの原子のものにもならず、自由に動き回る(この電子を自由電子という)。
- 自由電子により金属元素の陽イオンが繋ぎ止められてできる結合を金属結合という。
- 金属結合によってできる結晶を金属結晶(金属)という。
- 金属結晶の特徴は次の通りである。
❶ 熱・電気伝導性が高い
❷ 展性・延性がある
❸ 金属光沢がある - 金属結合では、一原子あたりの自由電子の数が多くなるほど結合が強く、融点が高くなる。また、自由電子の数が同じ場合、金属原子の原子半径が小さいほど金属結合は強くなる。
- 典型元素の金属は柔らかく低融点のものが多い。一方、遷移元素の金属は硬く高融点のものが多い。
| 典型元素 | 低融点 |
| 遷移元素 | 高融点 |
- 金属の単体は金属結晶であり、無数の金属原子が結合しているので、イオン結晶と同様、組成式で表される。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
金属元素同士の結合を【1】という。
解答/解説:タップで表示
解答:【1】金属結合
金属元素同士の結合を金属結合という。
金属元素はイオン化エネルギーが【1(大き or 小さ)】く、電子を出して【2(陽 or 陰)】イオンになりやすい。
解答/解説:タップで表示
金属元素が放出した電子は、陽イオンの周りを飛び回り、それらを結びつける。このような電子を【1】という。
解答/解説:タップで表示
解答:【1】自由電子
金属元素が放出した電子は、陽イオンの周りを飛び回り、それらを結びつける。このような電子を自由電子という。
金属は電気や熱をよく通す。これは、金属中を【1】が移動することで電気や熱のエネルギーが伝わるためである。
解答/解説:タップで表示
解答:【1】自由電子
金属は電気や熱をよく通す。これは、金属中を自由電子が移動することで電気や熱のエネルギーが伝わるためである。
金属がもつ下記の性質は全て【1】に由来する性質である。
- 熱/電気伝導性がある
- 展性/延性がある
- 金属光沢がある
解答/解説:タップで表示
解答:【1】自由電子
金属がもつ上の性質は全て自由電子に由来する性質である。
- 熱/電気伝導性がある
- 展性/延性がある
- 金属光沢がある














