MENU
【塩化セシウム型構造】イオン結晶の配位数・半径・限界半径比まとめ
はじめに
【プロ講師解説】このページでは『【塩化セシウム型構造】イオン結晶の配位数・半径・限界半径比まとめ』について解説しています。
塩化セシウム型構造とは
- 次のような構造をもつイオン結晶を塩化セシウム型構造(CsCl型構造)という。
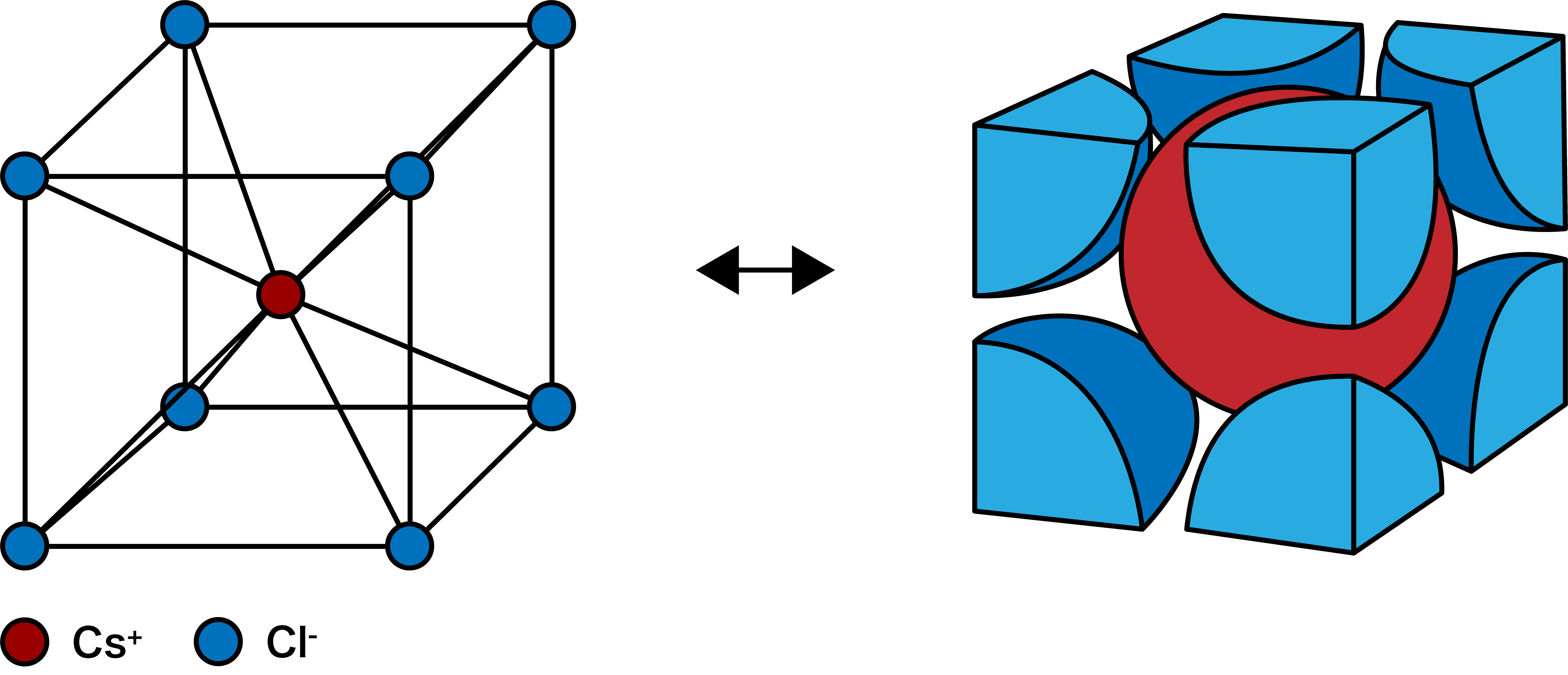
塩化セシウム型構造に含まれる陽イオン・陰イオンの数
- 塩化セシウム型構造(CsCl型構造)に含まれる陽イオン、陰イオンの数を数える。
セシウムイオンCs+
- まずは、塩化セシウム型構造(CsCl型構造)に含まれるCs+を数える。
- 塩化セシウム型構造(CsCl型構造)に含まれるCs+は格子の中心にある1個のみである。
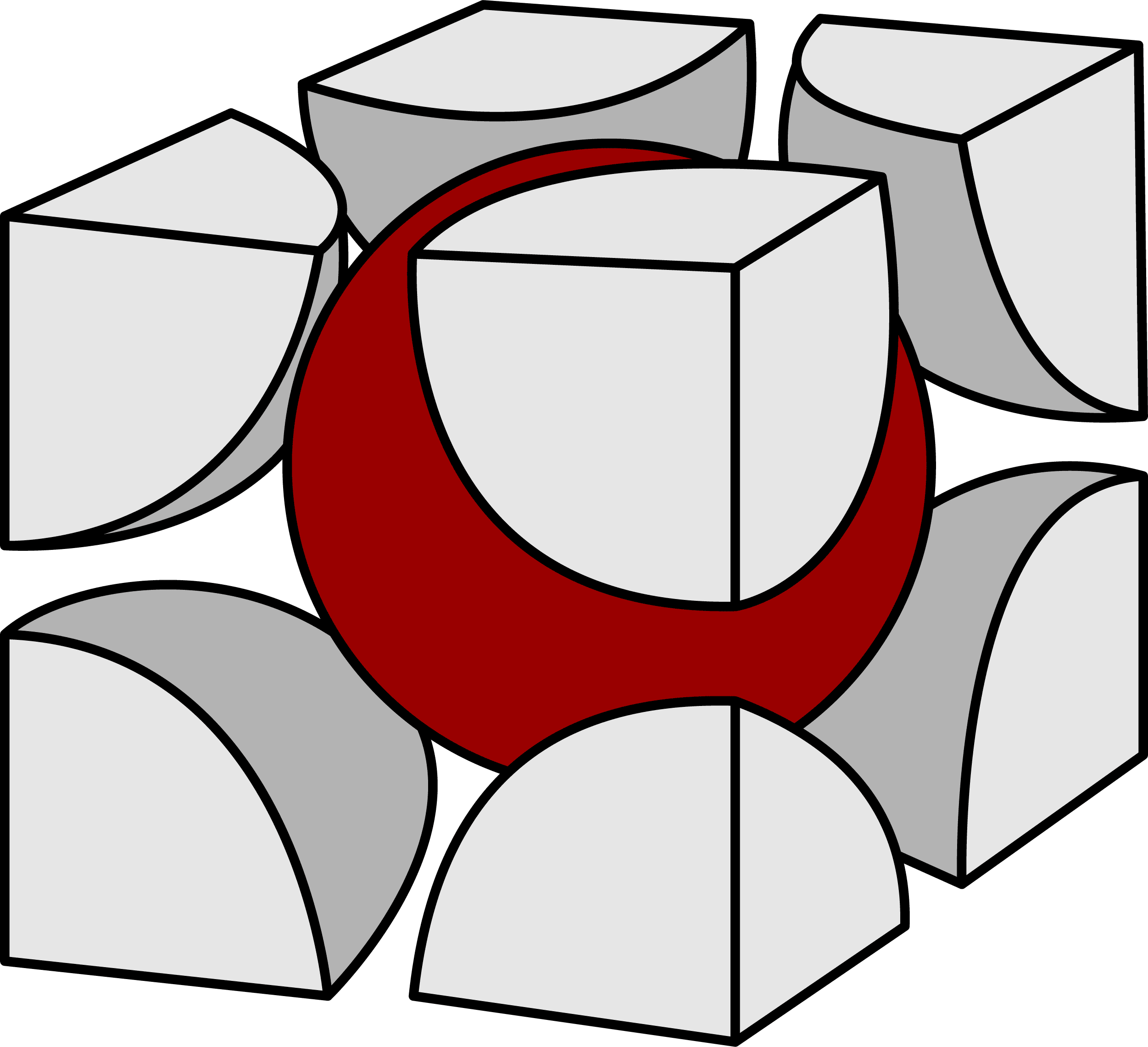
- したがって、塩化セシウム型構造(CsCl型構造)に含まれるCs+の数は1個である。
塩化物イオンClー
- 次に、塩化セシウム型構造(CsCl型構造)に含まれるClーを数える。
- 塩化セシウム型構造(CsCl型構造)の単位格子に含まれるClーは全て単位格子の頂点に存在しており、各頂点にあるClーは8分割された状態になっている。
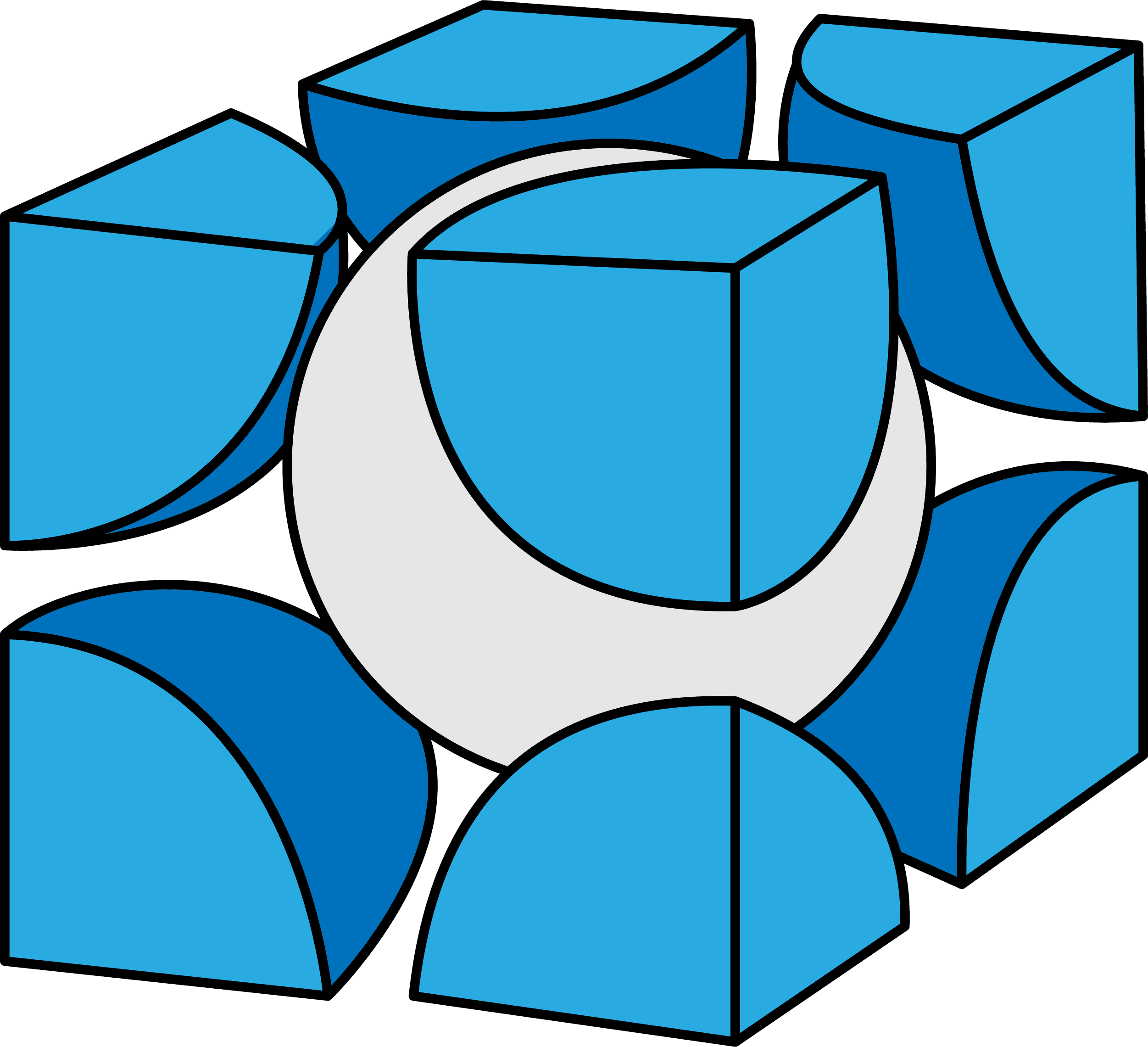
- したがって、8分割(1/8)したものが頂点の数分=8個あるので…
\[
\frac{ 1 }{ 8 }×8=1
\]
- 塩化セシウム型構造(CsCl型構造)に含まれるClーの数は1個である。
塩化セシウム型構造の配位数
- 塩化セシウム型構造(CsCl型構造)では、中心のCs+は周りの8個のClーと接しており、同様にClーも周りの8個のCs+と接している。
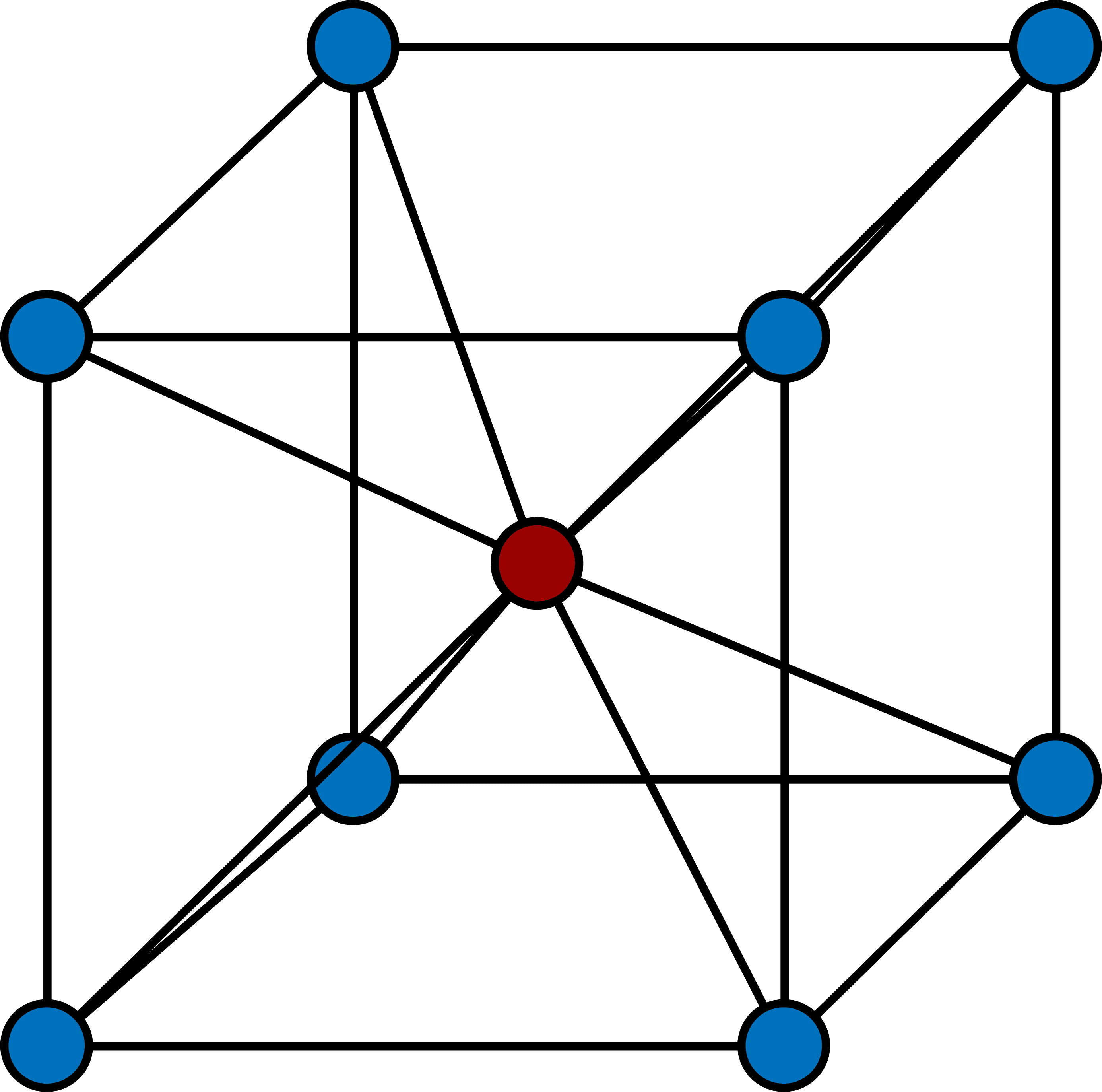
- したがって、塩化セシウム型構造(CsCl型構造)の各イオンの配位数は8となる。
塩化セシウム型構造のイオン半径と単位格子一辺の長さとの関係
- Cs+・Clーのイオン半径をそれぞれrCs+・rClー、単位格子一辺の長さをaとし、塩化セシウム型構造(CsCl型構造)の面の部分に注目すると…
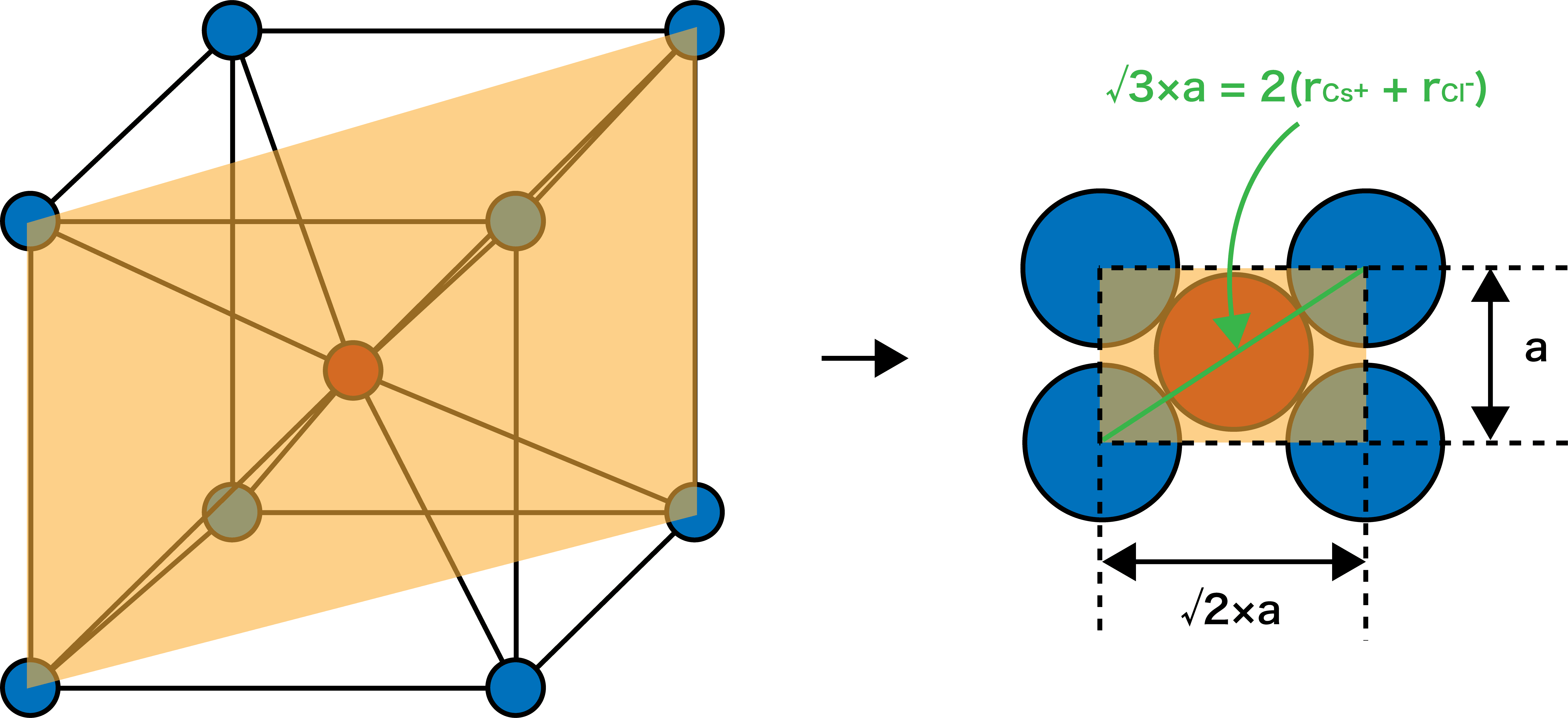
\[
\mathrm{\sqrt{ 3 }a=2(r_{Cs^{+} }+r_{Cl^{-}})}
\]
- イオン半径と単位格子一辺の長さの間にこのような関係があることがわかる。
CsCl型構造まとめ
この『【塩化セシウム型構造】イオン結晶の配位数・半径・限界半径比まとめ』のページで解説した内容をまとめる。
- 塩化セシウム型構造(CsCl型構造)に含まれるCs+の数は1個である。
- 塩化セシウム型構造(CsCl型構造)に含まれるClーの数は1個である。
- 塩化セシウム型構造(CsCl型構造)の各イオンの配位数は8である。
- イオン半径と単位格子一辺の長さの間には次の関係がある。
\[ \sqrt{ 3 }a=2(r_{Cs^{+} }+r_{Cl^{-}}) \] - 塩化セシウム型構造(CsCl型構造)の限界イオン半径比は≧0.73である。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
塩化セシウム型構造(CsCl型構造)に含まれるCs+の数は【1】個である。
解答/解説:タップで表示
解答:【1】1
塩化セシウム型構造(CsCl型構造)に含まれるCs+は格子の中心にある1個のみである。

したがって、塩化セシウム型構造(CsCl型構造)に含まれるCs+の数は1個である。
塩化セシウム型構造(CsCl型構造)に含まれるClーの数は【1】個である。
解答/解説:タップで表示
解答:【1】1
塩化セシウム型構造(CsCl型構造)の単位格子に含まれるClーは全て単位格子の頂点に存在しており、各頂点にあるClーは8分割された状態になっている。

したがって、8分割(1/8)したものが頂点の数分=8個あるので…
\[
\frac{ 1 }{ 8 }×8=1
\]
塩化セシウム型構造(CsCl型構造)に含まれるClーの数は1個である。
塩化セシウム型構造(CsCl型構造)の各イオンの配位数は【1】である。
解答/解説:タップで表示
解答:【1】8
塩化セシウム型構造(CsCl型構造)では、中心のCs+は周りの8個のClーと接しており、同様にClーも周りの8個のCs+と接している。

したがって、塩化セシウム型構造(CsCl型構造)の各イオンの配位数は8となる。
イオン半径rと単位格子一辺の長さaの間には次の関係がある。
\[ \mathrm{\sqrt{ 3 }a=【1】(r_{Cs^{+} }+r_{Cl^{-}})} \]
解答/解説:タップで表示
解答:【1】2
Cs+・Clーのイオン半径をそれぞれrCs+・rClー、単位格子一辺の長さをaとし、塩化セシウム型構造(CsCl型構造)を下記のように切り取ってできる面に注目すると…

\[
\mathrm{\sqrt{ 3 }a=2(r_{Cs^{+} }+r_{Cl^{-}})}
\]
イオン半径と単位格子一辺の長さの間にこのような関係があることがわかる。
塩化セシウム型構造(CsCl型構造)の限界イオン半径比は≧【1】である。