MENU
2族元素(アルカリ土類金属・Mg)の特徴・性質・反応など
はじめに
【プロ講師解説】このページでは『アルカリ土類金属(2族)の単体・化合物の性質や製法』について解説しています。
アルカリ土類金属とは
- 2族元素をアルカリ土類金属元素という。
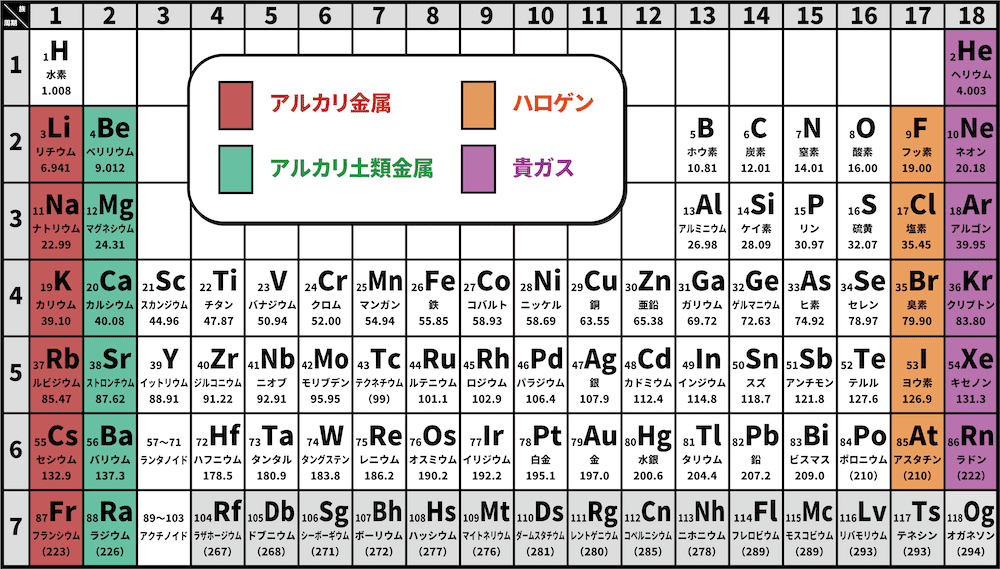
以前はBe・Mgを除く2族元素がアルカリ土類金属元素とよばれていましたが、2022年の学習指導要領の改訂により全ての2族元素がアルカリ土類金属元素となりました。
アルカリ土類金属の単体
- アルカリ土類金属の単体は次のような性質をもつ。
| Be | Mg | Ca | Sr | Ba | |
|---|---|---|---|---|---|
| ❶ 炎色反応 | × | × | 橙色 | 紅色 | 黄緑色 |
| ❷ H2Oとの反応 | × | 熱水と反応 | 冷水と反応 | 冷水と反応 | 冷水と反応 |
| ❸ SO42ーとの反応 | 沈殿なし | 沈殿なし | CaSO4 (白) | SrSO4 (白) | BaSO4 (白) |
| ❹ OHーとの反応 | Be(OH)2 (白) | Mg(OH)2 (白) | Ca(OH)2 (白)(注) | 沈殿なし | 沈殿なし |
❶ 炎色反応
- アルカリ金属同様に、アルカリ土類金属も特徴的な炎色反応を示す。
| Be | Mg | Ca | Sr | Ba | |
|---|---|---|---|---|---|
| 炎色反応 | × | × | 橙色 | 紅色 | 黄緑色 |
- なお、Be・Mgは炎色反応を示さない。
❷ 水H2Oとの反応
- アルカリ土類金属は水H2Oと次のように反応する。
| Be | Mg | Ca | Sr | Ba | |
|---|---|---|---|---|---|
| H2Oとの反応 | × | 熱水と反応 | 冷水と反応 | 冷水と反応 | 冷水と反応 |
- Beは水と反応しない。
- また、Mgは熱水とのみ反応する。
\[ \mathrm{Mg+2H_{2}O→Mg(OH)_{2}+H_{2}} \]
- Ca・Sr・Baは(熱水に加え)冷水とも反応する。
\[ \mathrm{Ca+2H_{2}O→Ca(OH)_{2}+H_{2}}\\
\mathrm{Sr+2H_{2}O→Sr(OH)_{2}+H_{2}}\\
\mathrm{Ba+2H_{2}O→Ba(OH)_{2}+H_{2}} \]
❸ 硫酸イオンSO42-との反応
- アルカリ土類金属は硫酸イオンSO42-と次のように反応する。
| Be | Mg | Ca | Sr | Ba | |
|---|---|---|---|---|---|
| SO42ーとの反応 | 沈殿なし | 沈殿なし | CaSO4 (白) | SrSO4 (白) | BaSO4 (白) |
- Be・MgはSO42-と沈殿をつくらない。
- Ca・Sr・BaはSO42-と硫酸塩の白色沈殿をつくる。
❹ 水酸化物イオンOH-との反応
- アルカリ土類金属は水酸化物イオンOH-と次のように反応する。
| Be | Mg | Ca | Sr | Ba | |
|---|---|---|---|---|---|
| OHーとの反応 | Be(OH)2 (白) | Mg(OH)2 (白) | Ca(OH)2 (白)(注) | 沈殿なし | 沈殿なし |
- BeとMgはOH-と水酸化物の白色沈殿をつくる。
- Caは多量のOH-を加えた際に水酸化物の白色沈殿をつくる。
- SrとBaはOH-と沈殿をつくらない。
アルカリ土類金属の融点・密度
- アルカリ土類金属の融点・密度について解説する。
融点
- アルカリ土類金属の単体は金属結晶であり、融点は1000℃以下である。
- 鉄・銅などの典型元素の金属単体の融点は1000℃以上のため、アルカリ土類金属の単体の融点は金属結晶のなかで比較的低いといえる(ただし、アルカリ金属の単体と比べると高い)。
密度
- アルカリ土類金属の単体の密度は、他の金属結晶と比べて小さく、軽金属である。
- なお、アルカリ土類金属の単体の融点・密度は金属結晶のなかで比較的小さいが、アルカリ金属の単体と比べると大きい。
酸化カルシウムCaO
●酸化カルシウムCaOの単体の特徴
- 生石灰ともよばれる
- 水に溶けて強塩基性を示す(水酸化物になる)
- 塩基性の乾燥剤として用いられる
- コークスを混ぜて加熱すると炭化カルシウム(カーバイド)が得られる
❶ 生石灰ともよばれる
- 酸化カルシウムCaOは生石灰(読み方:せいせっかい)ともよばれる。
❷ 水に溶けて強塩基性を示す(水酸化物になる)
- 酸化カルシウムCaOは塩基性酸化物であるため、水を加えると多量の熱を発しながら反応し、白色粉末の水酸化カルシウムCa(OH)2になる。
\[ \mathrm{CaO + H_{2}O → Ca(OH)_{2}(+63.6kJ)} \]
参考:酸化物の反応(金属元素・非金属元素)
参考:無機化学の色まとめ(イオン/化合物(沈殿)/ハロゲンなど)
弁当の発熱剤
- 先述の通り、酸化カルシウムCaOは水H2Oと次のような反応を起こす。
\[ \mathrm{CaO + H_{2}O → Ca(OH)_{2}(+63.6kJ)} \]
- この反応は多量の熱を発する発熱反応であり、したがってCaOは弁当の発熱剤として用いられる。
- ヒモを引っ張ることで発熱するタイプの弁当の内部構造は次のようになっている。
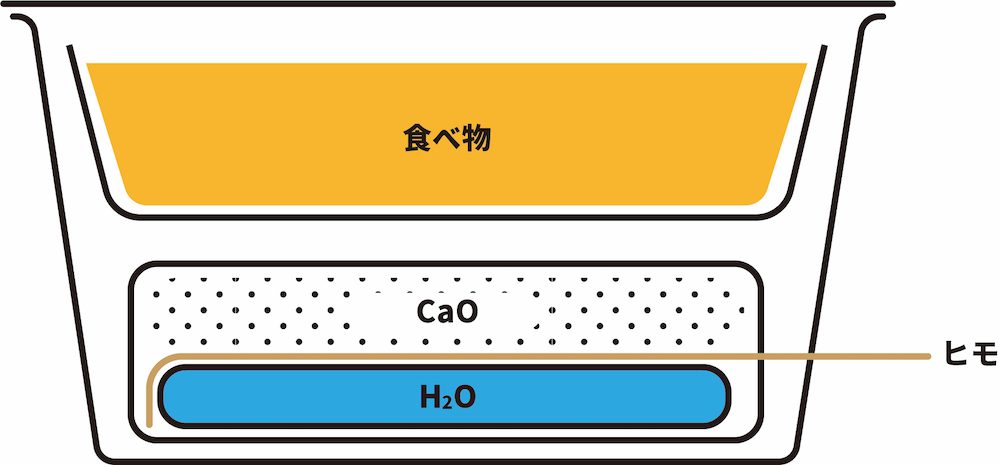
- 弁当についているヒモを引くと、中にある水袋が破れる。この水がCaOと接触することで上記の発熱反応が起こり、弁当内の食べ物が温まる。

❸ 塩基性の乾燥剤として用いられる
- 酸化カルシウムCaOは”塩基性の乾燥剤”として用いられる。
- 塩基性故、酸性気体の乾燥には用いることができない(中和反応してしまう)。
\[ \mathrm{CaO + 2HCl → CaCl_{2} + H_{2}O} \]
参考:【乾燥剤】酸性・中性・塩基性の乾燥剤一覧や分類・仕組みなど
❹ コークスを混ぜて加熱すると炭化カルシウム(カーバイド)が得られる
- 酸化カルシウムCaOにコークスCを混ぜ電気炉で強熱すると、炭化カルシウムCaC2(カーバイド)が得られる。
\[ \mathrm{CaO+3C \overset{約2000℃}{→} \underbrace{ CaC_{2} }_{ カーバイド }+CO} \]
水酸化カルシウムCa(OH)2
●水酸化カルシウムCa(OH)2の単体の特徴
- 消石灰ともよばれる(水溶液は石灰水)
- 石灰水に二酸化炭素を吹き込むと白く濁る→続けると再び無色に
- 鍾乳洞・鍾乳石の生成
- 塩素を吸収させるとさらし粉CaCl(ClO)・H2Oが得られる
❶ 消石灰ともよばれる(水溶液は石灰水)
- 水酸化カルシウムCa(OH)2は消石灰ともよばれる。
- なお、Ca(OH)2を水に溶かしてできる水溶液は石灰水とよばれる。
❷ 石灰水に二酸化炭素を吹き込むと白く濁る→続けると再び無色に
- 石灰水(水酸化カルシウムCa(OH)2水溶液)に二酸化炭素CO2を通じると、炭酸カルシウムCaCO3の沈殿が生成して白濁する。
\[ \mathrm{Ca(OH)_{2}+CO_{2}→CaCO_{3}↓+H_{2}O} \]
- ここでさらにCO2を吹き込むと、次のような反応が起こる。
\[ \mathrm{CaCO_{3} + CO_{2} + H_{2}O → Ca(HCO_{3})_{2}} \]
- 炭酸水素カルシウムCa(HCO3)2は水に溶けやすい(溶解度がCaCO3の約100倍)ため、沈殿が溶解する(=白濁が消える)。
- また、白濁が消えた後、水溶液を加熱すると上記の逆反応が進み、CaCO3の沈殿が生成し、再度白濁する。
\[ \mathrm{CaCO_{3} + CO_{2} + H_{2}O \color{#dc143c}{ ← } Ca(HCO_{3})_{2}} \]
- この反応はCO2の検出反応として用いられる。
参考:気体の検出反応まとめ
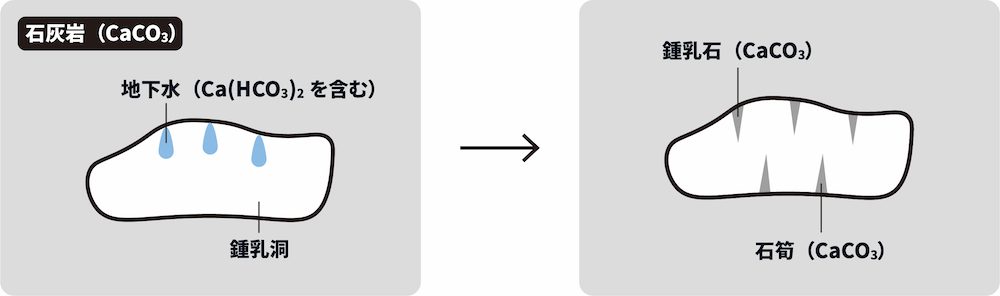
❸ 鍾乳洞・鍾乳石の生成
- 鍾乳洞(読み方:しょうにゅうどう)と鍾乳石(読み方:しょうにゅうせき)の生成に水酸化カルシウムCa(OH)2は深く関わっている。
- サンゴなどの主成分は炭酸カルシウムCaCO3である。したがって、海底が隆起してできた地層には石灰岩CaCO3が多く含まれる。
- そこにCO2を含んだ地下水が流れ続けると、次のような反応が起きて石灰岩が溶けて洞窟ができる。これが鍾乳洞である。
\[ \mathrm{CaCO_{3} + CO_{2} + H_{2}O → Ca(HCO_{3})_{2}} \]
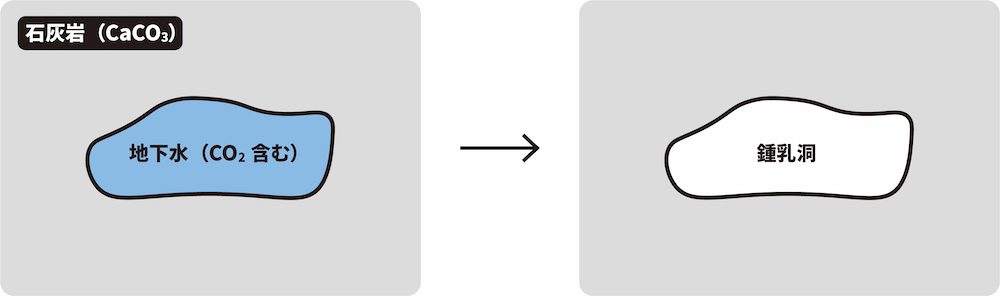
- このとき、鍾乳洞の上からはCa(HCO3)2を含んだ地下水が滴り落ちている。また、少量の地下水が蒸発している。
- その結果、次の反応が起き、少しずつ鍾乳石や石筍(読み方:せきじゅん)が成長する。
\[ \mathrm{Ca(HCO_{3})_{2}→CaCO_{3} + CO_{2} + H_{2}O} \]
- 鍾乳洞の上から垂れ下がったものが鍾乳石、下から突き出しているものが石筍である。
❹ 塩素を吸収させるとさらし粉CaCl(ClO)・H2Oが得られる
- 水酸化カルシウムCa(OH)2に塩素Cl2を吸収させるとさらし粉CaCl(ClO)・H2Oが得られる。
\[ \mathrm{Ca(OH)_{2}+Cl_{2}→ CaCl(ClO)・H_{2}O} \]
高度さらし粉
- さらし粉CaCl(ClO)・H2OはCaCl2・Ca(ClO)2・2H2Oとも考えることができ、塩化カルシウムCaCl2と次亜塩素酸カルシウムCa(ClO)2の複塩である。
- ここからCaCl2を取り除いたものを高度さらし粉(Ca(ClO)2・2H2Oが主成分)という。
- 高度さらし粉は有効塩素量が多く、安定しているため長期保存に向いている。したがって、プール用水や長期保存飲料の殺菌などに用いられる。
炭酸カルシウムCaCO3
●炭酸カルシウムCaCO3の単体の特徴
- 石灰石や大理石の主成分である
- 熱分解すると酸化カルシウムが生成する
- 水に溶けにくい
❶ 石灰石や大理石の主成分である
- 炭酸カルシウムCaCO3は石灰石や大理石の主成分として天然に多く存在する。
❷ 熱分解すると酸化カルシウムが生成する
- 炭酸カルシウムCaCO3を熱分解すると酸化カルシウムCaOが生成する。
\[ \mathrm{CaCO_{3} → CaO + CO_{2}} \]
参考:【熱分解反応】入試頻出3パターンの反応式の作り方などを解説
❸ 水に溶けにくい
- 炭酸カルシウムCaCO3は水に溶けにくい。
- 水に難溶な塩について詳しくは次のページを参照のこと。
塩化カルシウムCaCl2
- 塩化カルシウムCaCl2は吸湿性・潮解性をもっており、中性の乾燥剤として使用される。(NH3とは反応してしまうためNH3の乾燥には使用不可)
- 乾燥剤について詳しくは下記ページを参照のこと。
硫酸カルシウムCaSO4
- 硫酸カルシウムCaSO4は、天然では二水和物であるCaSO4・2H2O(セッコウ)として存在する。
- セッコウを加熱をすることにより得られる半水和物のCaSO4・1/2H2Oを焼きセッコウという。
\[ \mathrm{CaSO_{4}・2H_{2}O ⇄ CaSO_{4}・\frac{ 1 }{ 2 }H_{2}O + \frac{ 3 }{ 2 }H_{2}O} \]
- この反応は可逆的であり、焼きセッコウに水を加えて練ると元の普通のセッコウに戻る。
- セッコウ及び焼きセッコウは、塑像(可塑性のある素材:セッコウなどを用いて造られる像)、セッコウボード、医療用ギブスなどに用いられる。
死セッコウ・硬セッコウ
- 約400℃で焼きセッコウCaSO4・1/2H2Oを加熱し続けると、無水物であるCaSO4となる。これを死セッコウまたは硬セッコウという。
- 死セッコウ(硬セッコウ)はセメント・チョークなどの原料として用いられる。
ギブス
- 従来は、医療用ギブスとしてセッコウが多く用いられてきた。
- 現在は、セッコウ製ギブスと比較して軽く、硬化時間の短いプラスチック製ギブス(ガラス繊維)が用いられることが多い。
硫酸バリウムBaSO4
- 硫酸バリウムBaSO4は水に対する溶解度 が極めて小さな白色の固体である。
- 空気や熱、光などに対しても安定であり、白色ペンキや製紙の充填剤として用いられる。
- また、X線を遮蔽し、塩酸を含む胃液にも溶解しないため、消化器X線検査の造影剤としても用いられる。
炭酸バリウムBaCO3との違い
- 炭酸バリウムBaCO3と硫酸バリウムBaSO4の沈殿はともに白色であり、見分けがつきにくい。
- これらを見分けるには、弱酸を加える。BaCO3は弱酸を含む塩なので、強酸を加えると弱酸である二酸化炭素CO2が遊離する(弱酸遊離反応)。一方、BaSO4は強酸を含む塩なので、強酸を加えても反応しない。
炭化カルシウムCaC2
- 炭化カルシウムCaC2はカーバイドともよばれ、生石灰CaOにコークスCを混ぜ高温に熱することで製造する。
\[ \mathrm{CaO+3C \overset{約2000℃}{→} \underbrace{ CaC_{2} }_{ カーバイド }+CO} \]
- CaC2に水を加えると、加水分解反応が起こりアセチレンC2H2が発生する。
\[ \mathrm{CaC_{2} + 2H_{2}O → C_{2}H_{2} + Ca(OH)_{2}} \]
硬水と軟水
- Ca2+やMg2+を多量に含んだ水を硬水、少量しか含まない水を軟水という。
- 煮沸をしたり、陽イオン交換膜を用いることにより硬水を軟水に変化させることを「水の軟化」という。
- セッケンで洗い物をするときに硬水を用いると、泡立ちが悪く、また沈殿を形成するため洗浄力が非常に低くなる。これは、Ca2+やMg2+がセッケンの分子と反応し、不溶性の塩を形成するためである。
\[ \mathrm{2R-COO^{-}+Ca^{2+}→(R-COO)_{2}Ca} \]
マグネシウムの還元作用
- マグネシウムMgは空気(酸素)中で加熱すると発光を伴って燃焼する。
\[ \mathrm{2Mg + O_{2} → 2MgO} \]
- この反応は花火やフラッシュランプに利用される。
- また、マグネシウムは二酸化炭素と酸化還元反応を起こし、二酸化炭素を還元する。
\[ \mathrm{2Mg+CO_{2}→2MgO+C} \]