MENU
電子式(書き方・ルール・一覧・演習問題など)
目次
はじめに
【プロ講師解説】このページでは『電子式(書き方・ルール・一覧・演習問題など)』について解説しています。
電子式
- 最外殻電子を点で表した式を電子式という。
| 元素名(記号) | 原子番号 | 最外殻電子数 | 電子式 |
|---|---|---|---|
| 炭素(C) | 6 | 4 |  |
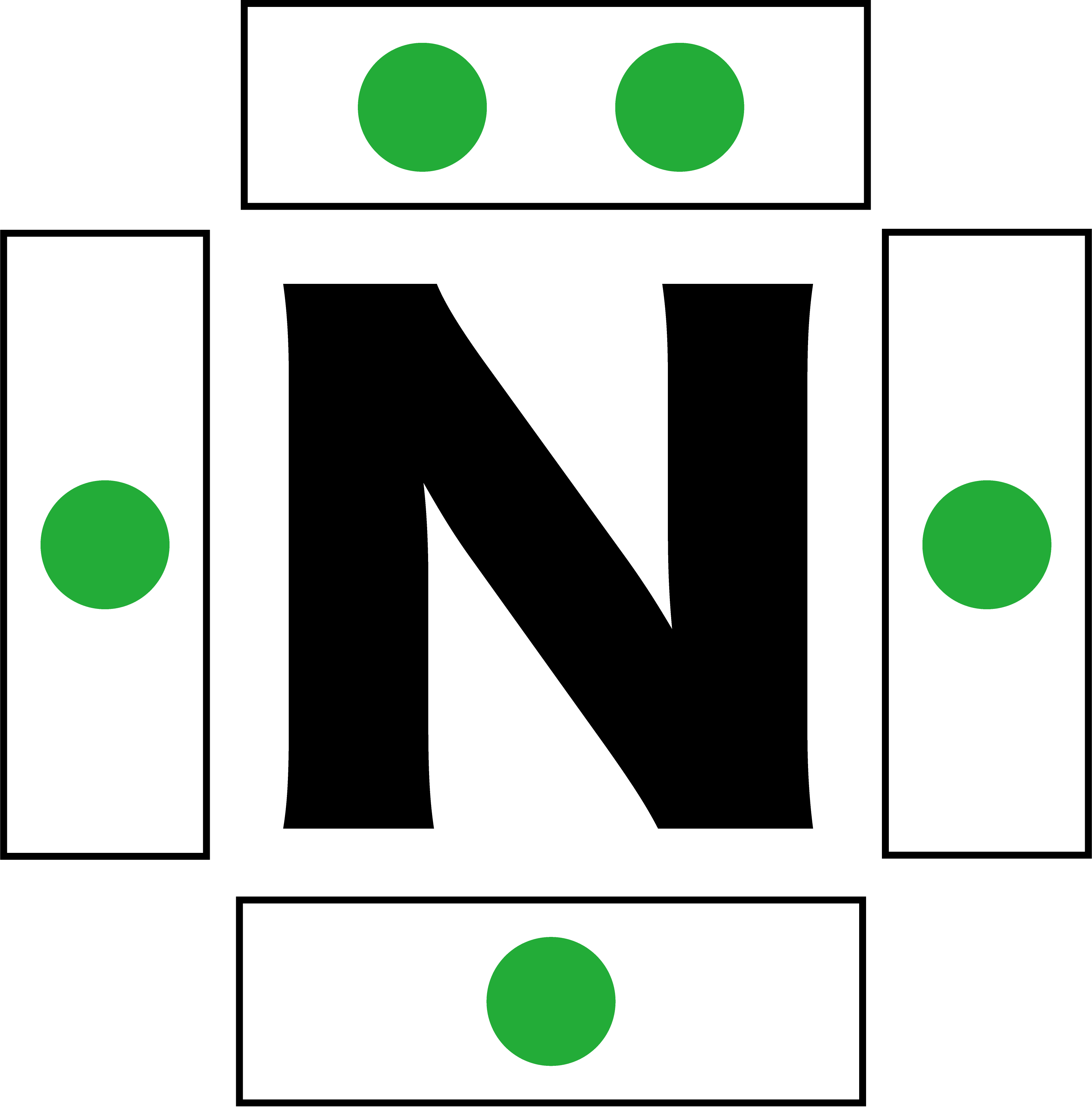
| 窒素(N) | 7 | 5 |  |
| 酸素(O) | 8 | 6 | 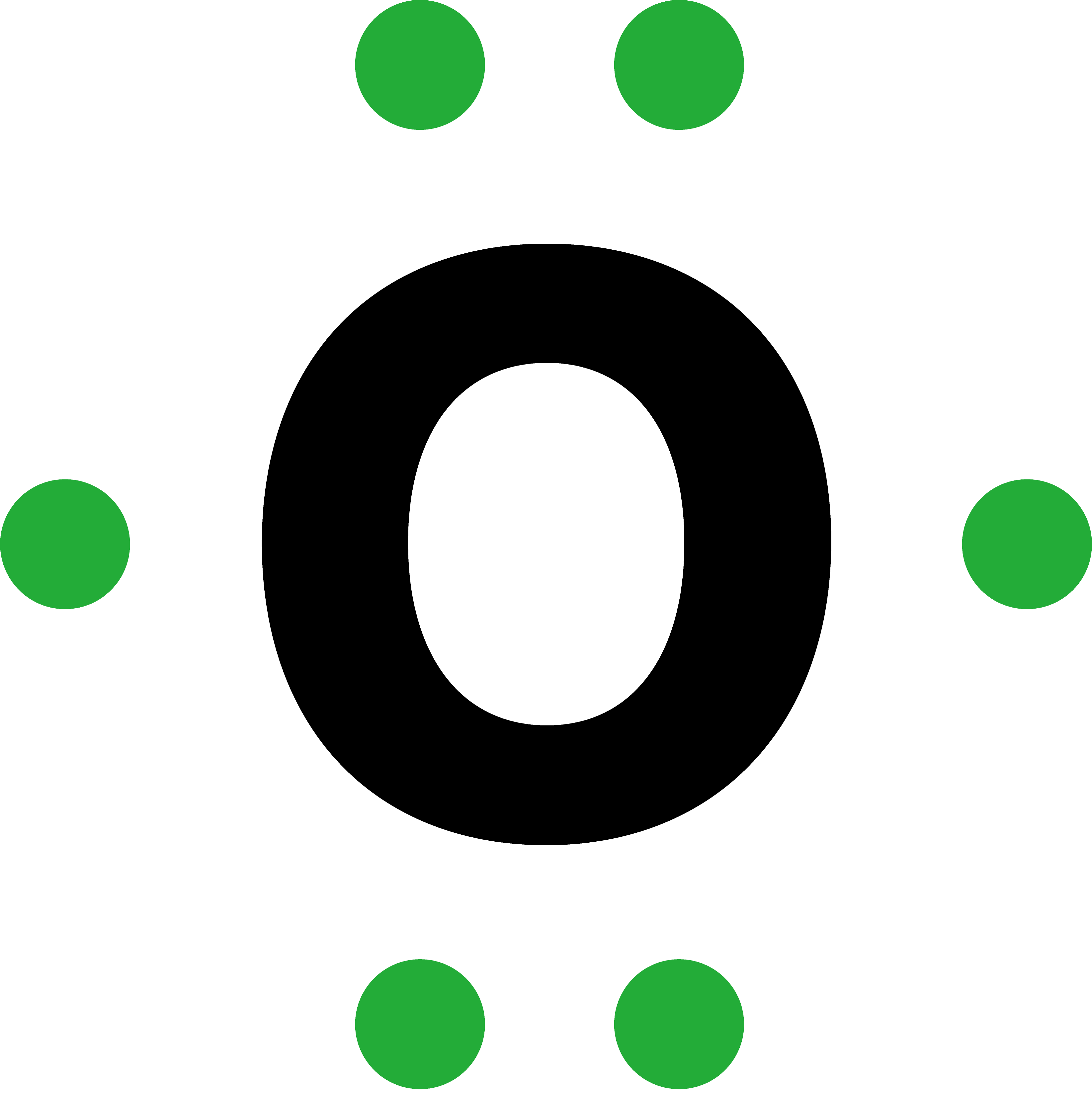 |
| フッ素(F) | 9 | 7 |  |
電子式を書くときのルール
- 電子式を書く際に重要な2つのルールがある。
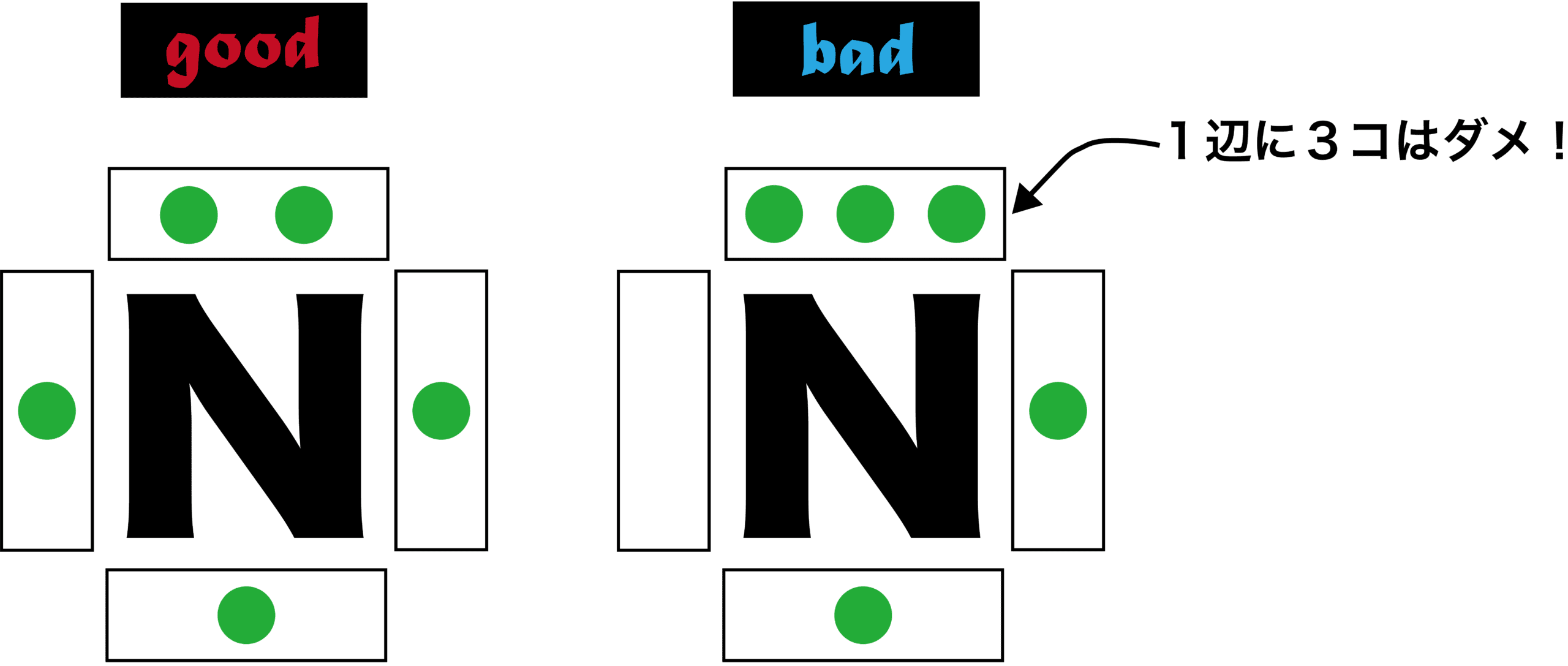
●ルール1
1つの辺に電子は2個まで
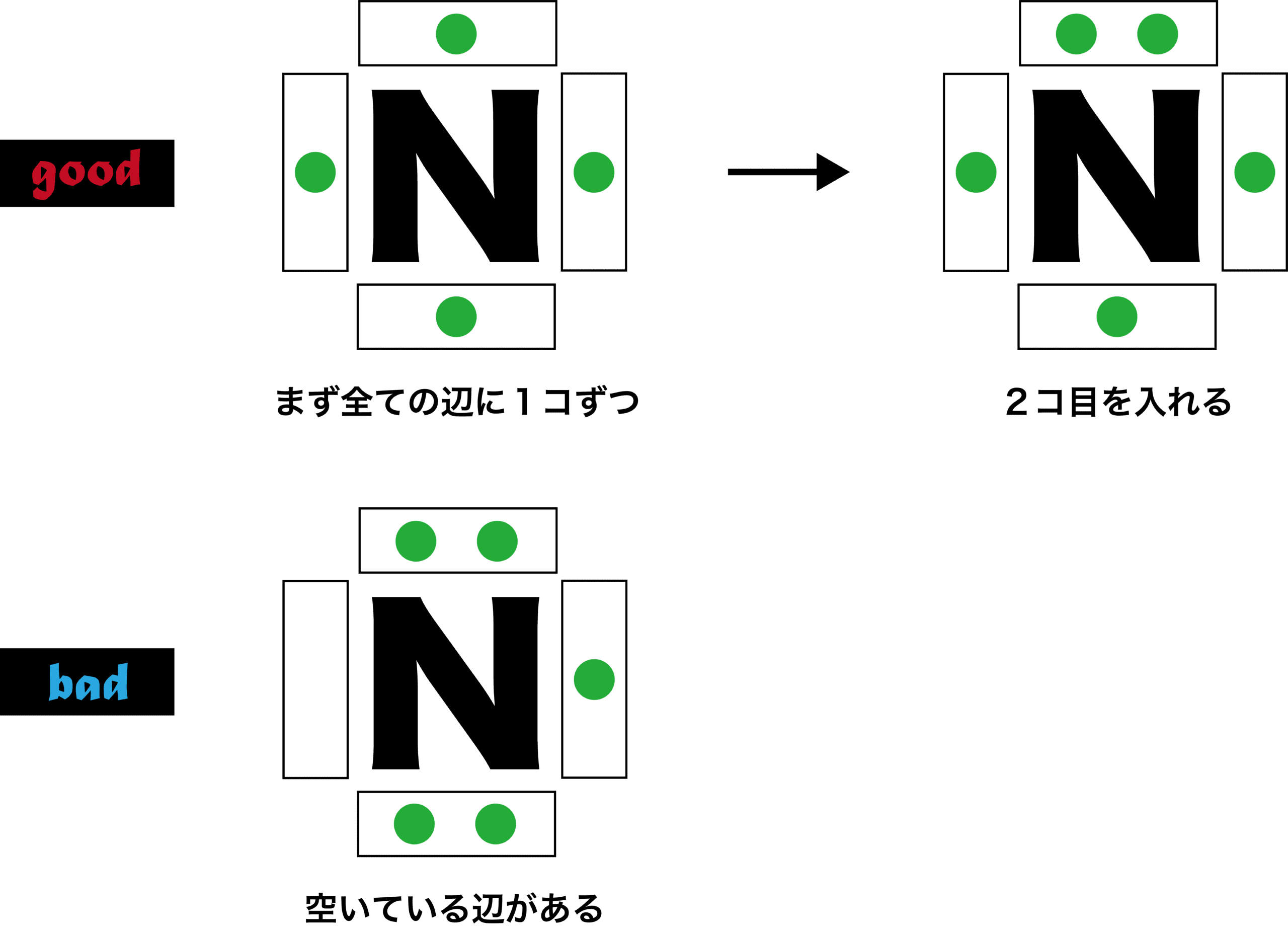
●ルール2
まず全ての辺に電子を1個入れてから2個目を入れる
ルール1
1つの辺に電子は2個まで
- 電子式を書くときは、アルファベット(元素記号)は1つの四角形であり、上下左右に”4つの辺”があると考える。
- このとき、1つの辺に入れる電子は「2個まで」でなければならない。
ルール2
まず全ての辺に電子を1個入れてから2個目を入れる
- ルール1の通り1つの辺には2個まで電子を入れることができるが、2個目を入れるときは「すべての辺に既に1個ずつ電子が入った状態」でなければならない。
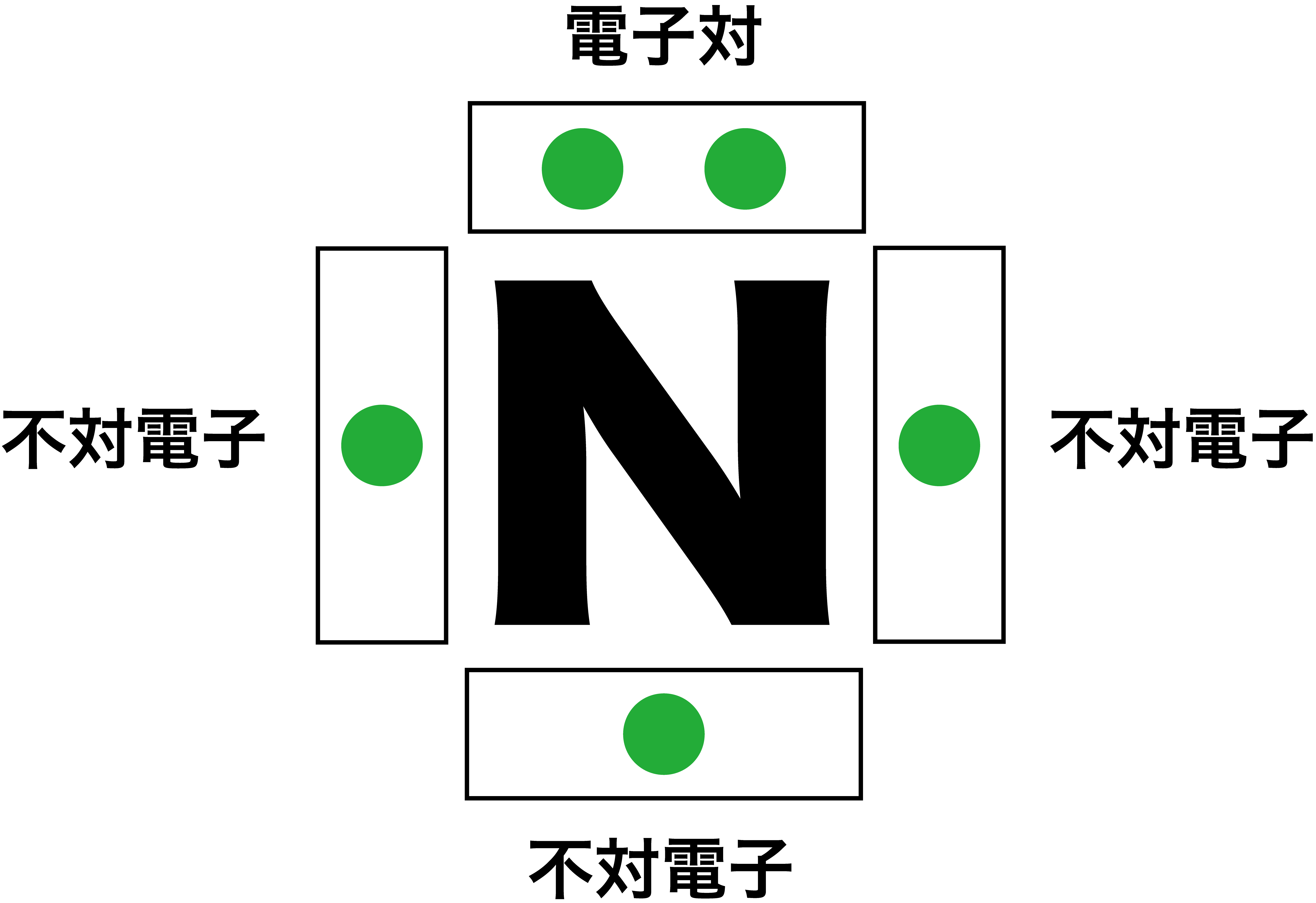
不対電子・電子対
- 電子式中の電子のうち、2個の電子がペアになっているものを電子対、1個で存在しているものを不対電子という。
分子の電子式
- 原子だけではなく、原子同士が共有結合してできた“分子”についても電子式で表すことができる。
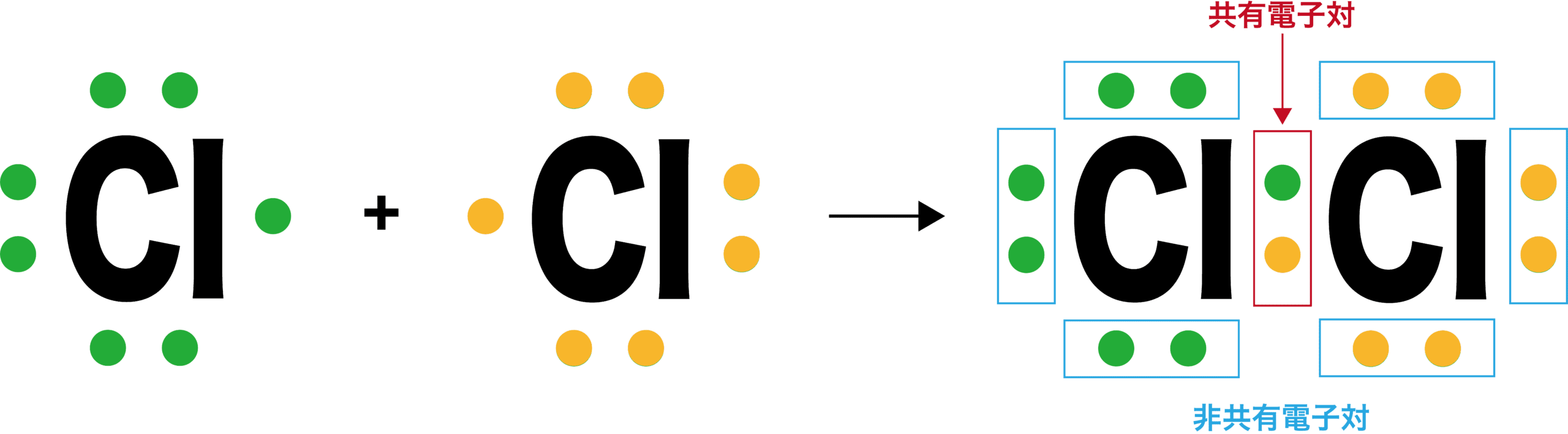
- 分子の電子式に含まれる電子対のうち、2個の原子が不対電子を1個ずつ出し合うことで形成される電子対を共有電子対、1個の原子がもつ電子のみで形成される電子対を非共有電子対という。
- 一般に、原子は不対電子の数だけ結合の手をもつ。この結合の手の数を原子価という。
電子式一覧
- 原子番号1〜18(第1周期〜第3周期)の原子の電子式を一覧としてまとめる。
| 元素名(記号) | 原子番号 | 最外殻電子数 | 電子式 |
|---|---|---|---|
| 水素(H) | 1 | 1 |  |
| ヘリウム(He) | 2 | 2 |  |
| リチウム(Li) | 3 | 1 |  |
| ベリリウム(Be) | 4 | 2 |  |
| ホウ素(B) | 5 | 3 |  |
| 炭素(C) | 6 | 4 |  |
| 窒素(N) | 7 | 5 |  |
| 酸素(O) | 8 | 6 |  |
| フッ素(F) | 9 | 7 |  |
| ネオン(Ne) | 10 | 8 |  |
| ナトリウム(Na) | 11 | 1 |  |
| マグネシウム(Mg) | 12 | 2 | 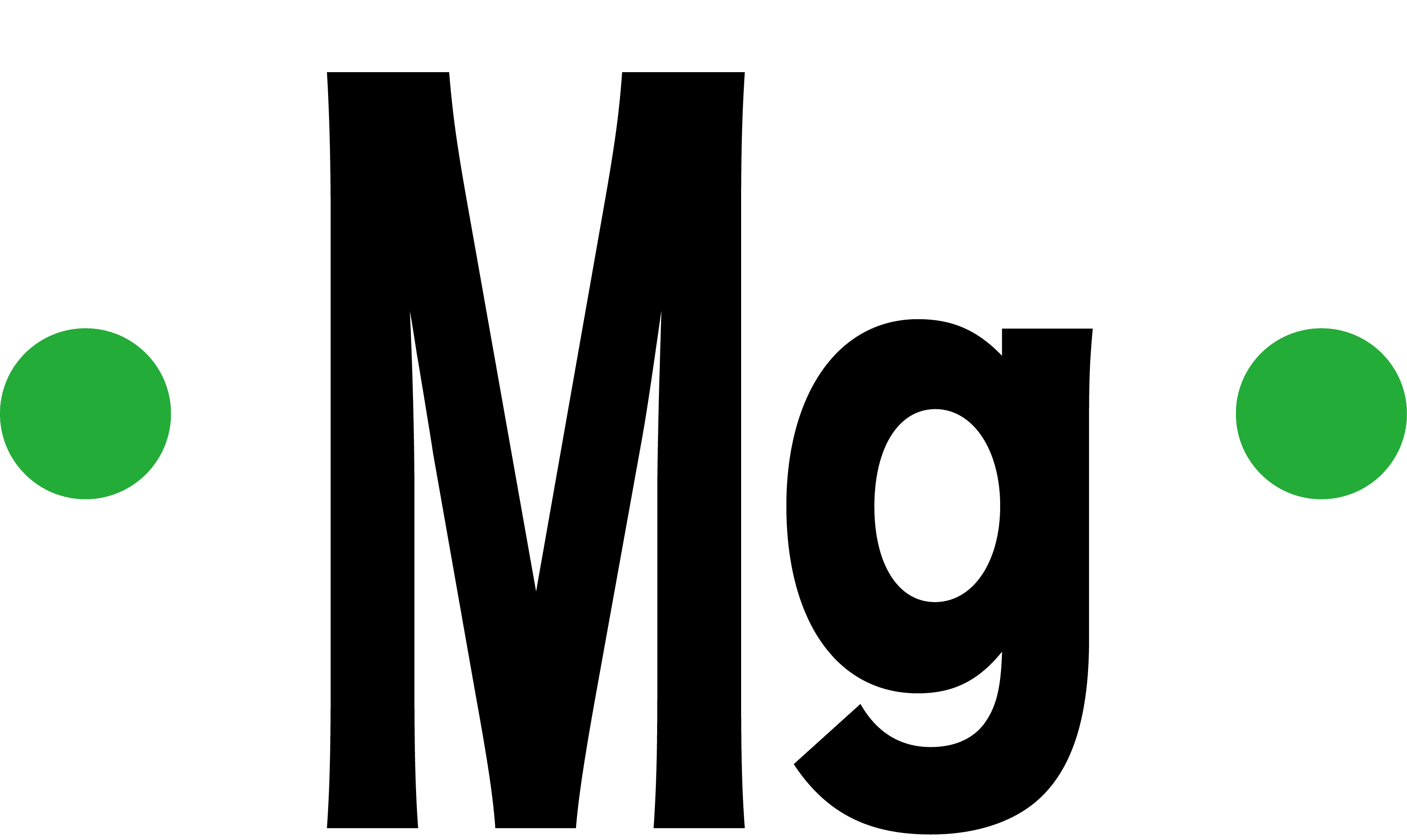 |
| アルミニウム(Al) | 13 | 3 |  |
| ケイ素(Si) | 14 | 4 |  |
| リン(P) | 15 | 5 |  |
| 硫黄(S) | 16 | 6 |  |
| 塩素(Cl) | 17 | 7 |  |
| アルゴン(Ar) | 18 | 8 |  |
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
元素記号の周りに最外殻電子をマルポチ(・)で表した式を【1】という。
解答/解説:タップで表示
解答:【1】電子式
元素記号の周りに最外殻電子をマルポチ(・)で表した式を電子式という。
問2
電子式中の電子のうち、2個の電子がペアになっているものを【1】という。
解答/解説:タップで表示
解答:【1】電子対
電子式中の電子のうち、2個の電子がペアになっているものを電子対という。
問3
電子式中の電子のうち、 1個で存在しているものを【1】という。
解答/解説:タップで表示
解答:【1】不対電子
電子式中の電子のうち、 1個で存在しているものを不対電子という。
問4
2個の原子が電子を1個ずつ出し合うことで形成される電子対を【1】という。
解答/解説:タップで表示
解答:【1】共有電子対
2個の原子が電子を1個ずつ出し合うことで形成される電子対を共有電子対という。
問5
1個の原子がもつ電子のみで形成される電子対を【1】という。
解答/解説:タップで表示
解答:【1】非共有電子対
1個の原子がもつ電子のみで形成される電子対を非共有電子対という。














