MENU
気体の溶解度(ヘンリーの法則・体積や圧力との関係・計算問題)
はじめに
【プロ講師解説】このページでは『気体の溶解度(ヘンリーの法則・体積や圧力との関係・計算問題)』について解説しています。
気体の溶解度
- 温度が高く圧力が小さいほど、気体の溶解度は小さくなる。
温度(高) ・ 圧力(小) → 溶解度(小)
ヘンリーの法則
- 温度が一定のとき、気体の溶解度はその気体の圧力に比例する。これをヘンリーの法則という。
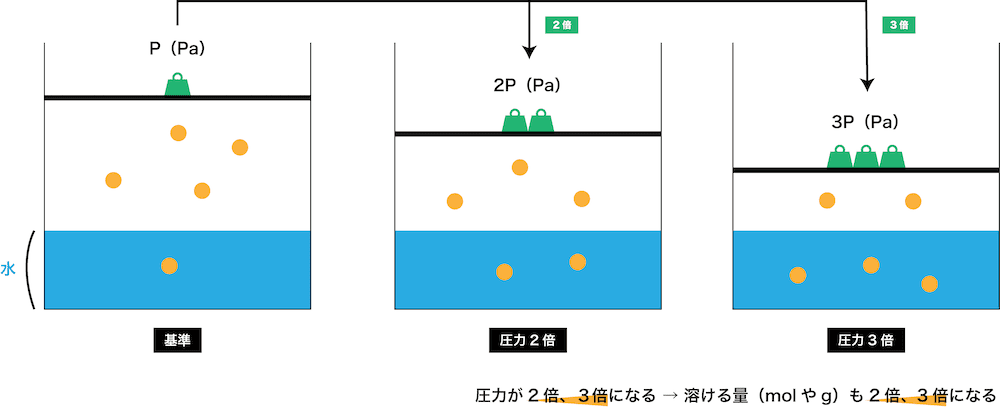
- ヘンリーの法則は、水への溶解度が小さい(=水との反応性が小さい)気体において成立する。(アンモニアNH3や塩化水素HClなど、水に溶けやすい気体には適用不可)
気体の溶解度計算(ヘンリーの法則を使った計算)
- ヘンリーの法則を用いた気体の溶解度計算について、「1種類の気体を溶解させるパターン」と「2種類の気体を溶解させるパターン」に分けて解説する。
1種類の気体を溶解させるパターン
0℃で酸素の圧力を2.0×105Paにした。このとき2.0Lの水に溶ける酸素は何Lか。ただし、酸素は0℃、1.0×105Paにおいて、水1.0Lに4.9×10ー2L溶けるものとする。
- ヘンリーの法則より、気体の溶ける量は圧力に比例する。また、当然水量にも比例する。
- したがって、この問題は次のような式を使って解くことができる。
基準の量 × 圧力比 × 水量比
\[ \begin{align}&4.9×10^{-2}(\mathrm{L})×\color{#3ADF00}{ \frac{ 2.0×10^{5}(\mathrm{Pa}) }{ 1.0×10^{5}(\mathrm{Pa}) }}× \color{#01DFD7}{\frac{ 2.0(\mathrm{L}) }{ 1.0(\mathrm{L}) }}\\
&≒0.20(\mathrm{L})\end{align} \]
2種類の気体を溶解させるパターン
酸素と窒素が1:4の体積比で混合した標準状態(0℃、1.0×105Pa)の空気がある。
このとき、次の問いに答えなさい。
ただし、0℃、1.0×105Paのもとで1.0Lの水に窒素は23mL、酸素は49mL溶けるものとする。
(1)この空気と接している水2.0Lに溶解している窒素の体積(mL)を求めよ。
(2)この空気と接している水3.0Lに溶解している酸素の物質量(mol)を求めよ。
(3)この空気と接している水10Lに溶解している窒素と酸素の質量比(N2/O2)を求めよ。
(1)
- 分圧・全圧・モル分率にある「分圧=全圧×モル分率」の公式より、窒素の分圧は次のようになる。
\[ 1.0×10^{5}×\frac{ 4 }{ 5 } \]
- これを用いて、次のような式をたてることができる。
\[ \begin{align}&23(\mathrm{mL})×\color{#3ADF00}{ \frac{ 1.0×10^{5}(\mathrm{Pa})×\frac{ 4 }{ 5 } }{ 1.0×10^{5}(\mathrm{Pa}) }}× \color{#01DFD7}{\frac{ 2.0(\mathrm{L}) }{ 1.0(\mathrm{L}) }}\\
&≒37(\mathrm{mL}) \end{align}\]
(2)
- 酸素の分圧を上と同様に求めると、次のようになる。
\[ 1.0×10^{5}×\frac{ 1 }{ 5 } \]
- これを用いて、次のような式をたてることができる。
\[ \begin{align}&\frac{ 49(\mathrm{mL})×\color{#3ADF00}{ \frac{ 1.0×10^{5}(\mathrm{Pa})×\frac{ 1 }{ 5 } }{ 1.0×10^{5}(\mathrm{Pa}) }}× \color{#01DFD7}{\frac{ 3.0(\mathrm{L}) }{ 1.0(\mathrm{L}) }}}{ 22400(\mathrm{mL/mol}) }\\
&≒1.3×10^{-3}(\mathrm{mol}) \end{align}\]
(3)
- 分母がO2のg、分子がN2のgになるように単位を揃えて約分すれば良い。
\[ \begin{align}&\frac{w_{N_{2}}(\mathrm{g})}{w_{O_{2}}(\mathrm{g})}\\
&=\frac{
\frac{ 23(\mathrm{mL})×\color{#3ADF00}{ \frac{ 1.0×10^{5}(\mathrm{Pa})×\frac{ 4 }{ 5 } }{ 1.0×10^{5}(\mathrm{Pa}) }}× \color{#01DFD7}{\frac{ 10(\mathrm{L}) }{ 1.0(\mathrm{L}) }}}{ 22400(\mathrm{mL/mol}) }×28(\mathrm{g/mol}) }
{
\frac{ 49(\mathrm{mL})×\color{#3ADF00}{ \frac{ 1.0×10^{5}(\mathrm{Pa})×\frac{ 1 }{ 5 } }{ 1.0×10^{5}(\mathrm{Pa}) }}× \color{#01DFD7}{\frac{ 10(\mathrm{L}) }{ 1.0(\mathrm{L}) }}}{ 22400(\mathrm{mL/mol}) }×32(\mathrm{g/mol}) }\\
&≒1.6\end{align} \]
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
気体の溶解度は【1(高 or 低)】温・【2(高 or 低)】圧で大きくなる。
解答/解説:タップで表示
解答:【1】低【2】高
温度(高) ・ 圧力(小) → 溶解度(小)
温度が高く圧力が小さいほど、気体の溶解度は小さくなる。
温度が一定のとき、気体の溶解度はその気体の圧力に比例する。これを【1】の法則という。
【1】の法則は、水への溶解度が【2(大き or 小さ)】い気体において成り立つ。
解答/解説:タップで表示
解答:【1】ヘンリー【2】小さ
温度が一定のとき、気体の溶解度はその気体の圧力に比例する。これをヘンリーの法則という。

ヘンリーの法則は、水への溶解度が小さい(=水との反応性が小さい)気体において成立する。(アンモニアNH3や塩化水素HClなど、水に溶けやすい気体には適用不可)













