MENU
【多糖類】デンプン(アミロース・アミロペクチン)/セルロースの構造・還元性・加水分解など
はじめに
【プロ講師解説】このページでは『【多糖類】デンプン(アミロース・アミロペクチン)/セルロースの構造・還元性・加水分解など』について解説しています。
多糖類とは
- 多数の単糖が縮合重合してできた糖(高分子化合物)を多糖類という。
- n個の単糖が縮合重合すると、(n-1)ヶ所で水が取れるため、多糖の分子式は(C6H10O5)nとなる。
栄養多糖と構造多糖
- 多糖類にはデンプンやグリコーゲンのように栄養源(エネルギー源)として貯蔵するためにつくられたものがあり、それらを栄養多糖という。
- 一方、セルロースは植物の細胞壁に存在し、植物体を支え、構造を維持する役割を果たしているため、構造多糖という。
デンプン
- デンプンはα-グルコースが縮合重合してできる多糖である。
- デンプンはその構造により「アミロース」と「アミロペクチン」に分けることができる。
\[ \begin{eqnarray}
デンプン
\begin{cases}
アミロース & \mathrm{( 20〜25 \% )} \\
アミロペクチン & \mathrm{( 75〜80 \% )}
\end{cases}
\end{eqnarray} \]
- デンプンのうち、20〜25%はアミロース、75〜80%はアミロペクチンである。
- アミロースおよびアミロペクチンについてそれぞれ解説する。
アミロース
- アミロースは、多数のα-グルコースがマルトース(麦芽糖)のように、1位と4位のヒドロキシ基(-OH)の間で脱水縮合した構造をしている。
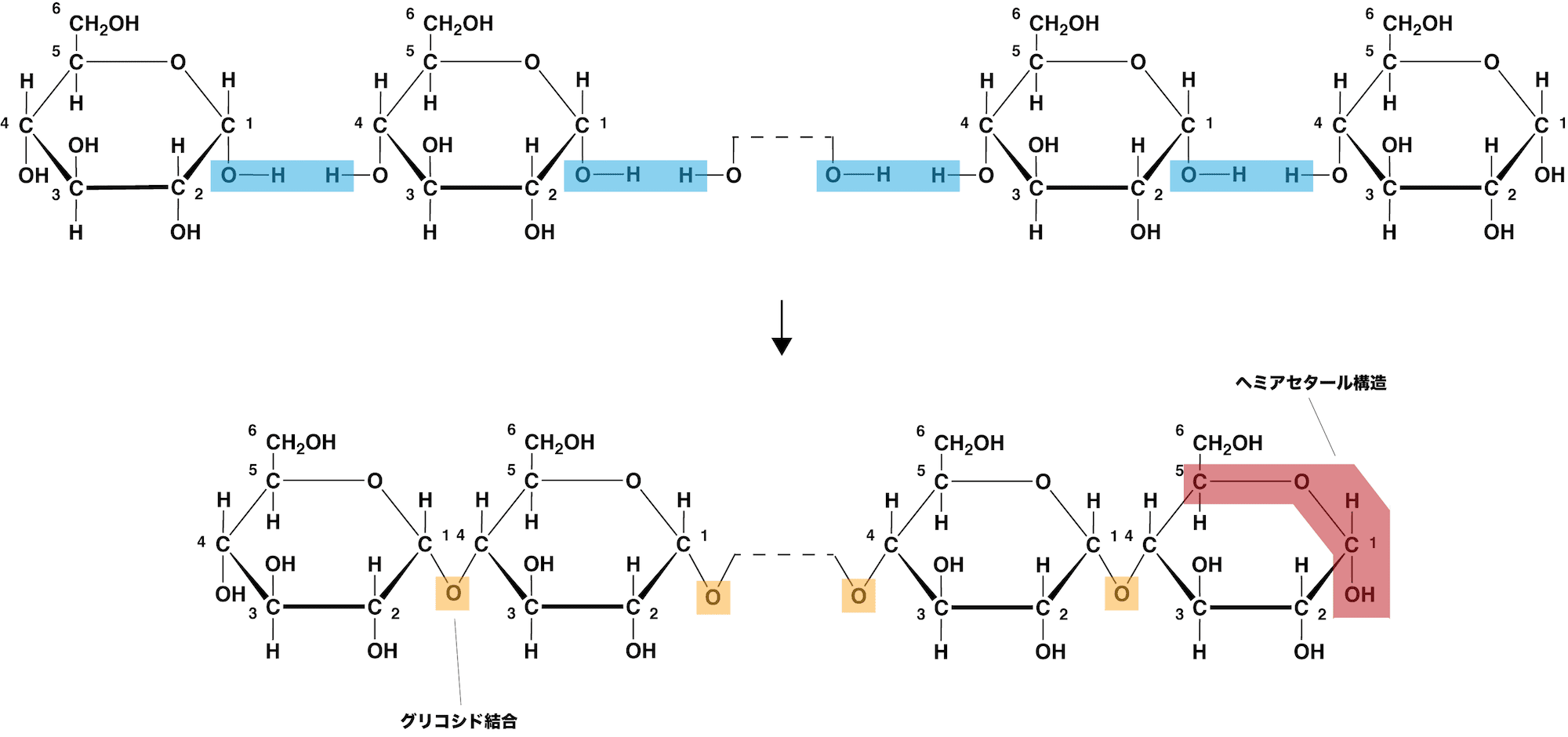
- このとき生じたエーテル結合をグリコシド結合(α-1,4-グリコシド結合)という。
- 一見まっすぐ延びた直鎖状だが、マルトースのような折れ曲がった繋がり方をしているため、実際には直鎖状のらせん構造をしている。
- 分子内の-OHはらせん構造を補強する「分子内水素結合」に使われる。
アミロペクチン
- アミロペクチンは、多数のα-グルコースが1位と4位の-OHの間、及び1位と6位の-OHの間で脱水縮合した構造をしている。
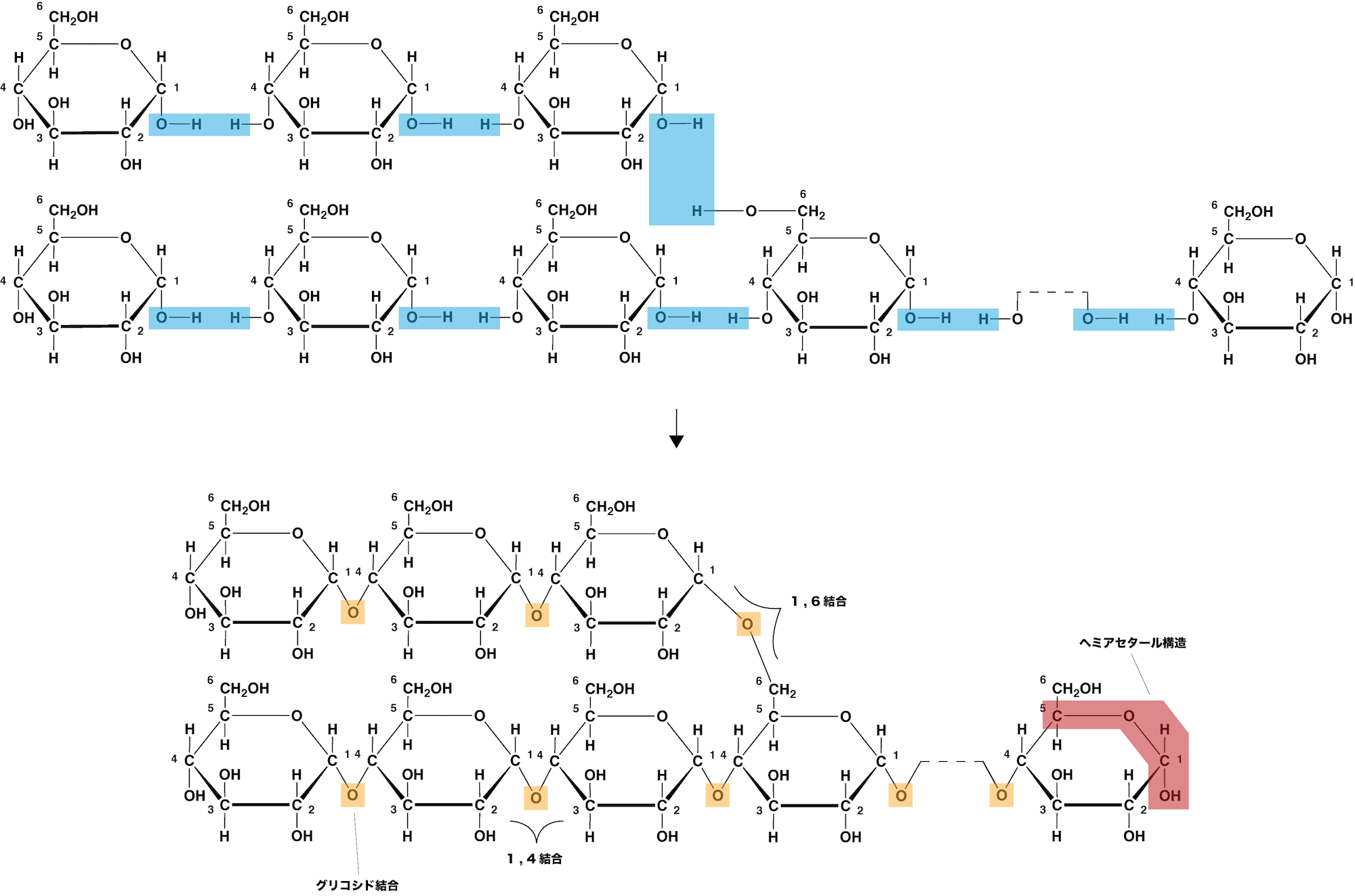
- このとき生じたエーテル結合をそれぞれα-1,4-グリコシド結合、α-1,6-グリコシド結合という。
- 1,4結合と1,6結合が存在するため、(アミロースと異なり)分枝状らせん構造をしている。
- 分子中の1つの枝は20個程度のグルコースが縮合したもので、らせんの長さはアミロースよりも短めである。
グリコーゲン
- アミロペクチンとほぼ同じ構造をしている。ただし、アミロペクチンに比べて平均重合度が大きく(数万程度)、枝分かれの比率が高いという特徴がある。
セルロース
- セルロースは、多数のβ-グルコースがセロビオースのように1位と4位の-OHの間で脱水縮合した構造をしている。
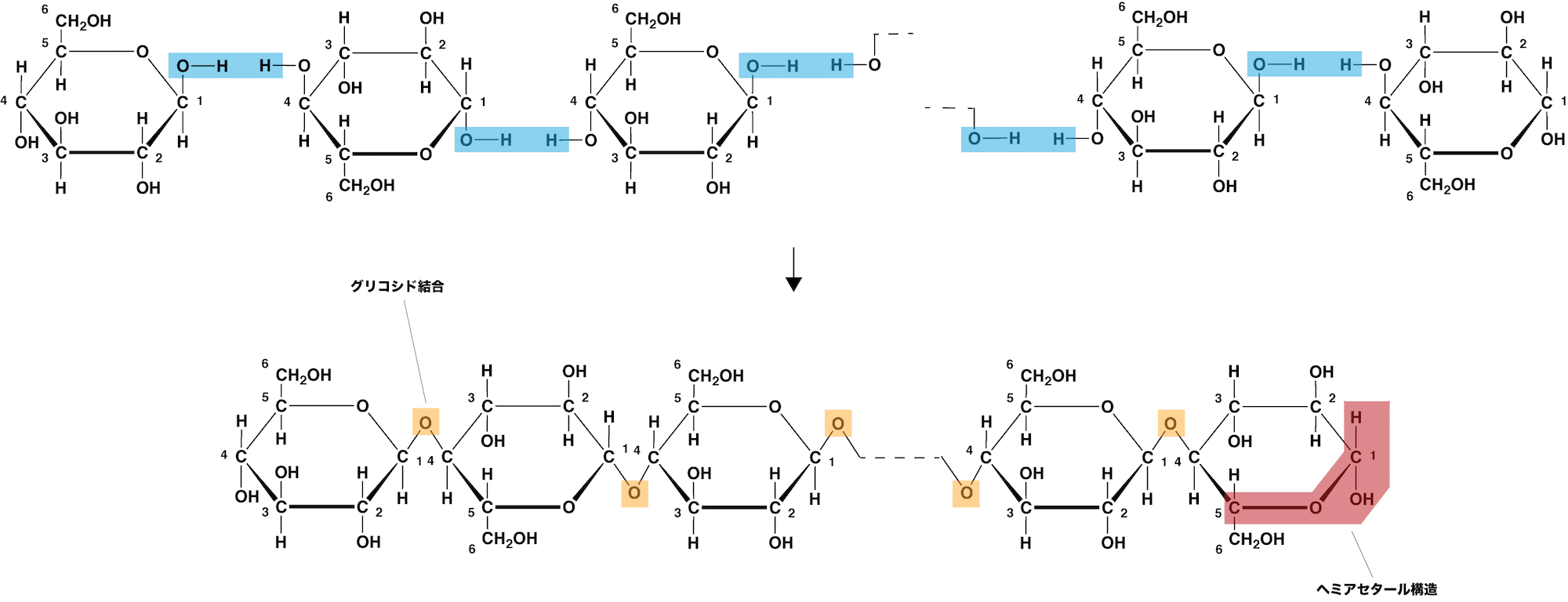
- このとき生じたエーテル結合をβ-1,4-グリコシド結合という。
- β-グルコース単位が表・裏・表・裏・・・とセロビオースのようなまっすぐな繋がり方をしているため、デンプンとは異なり直線構造となっている。
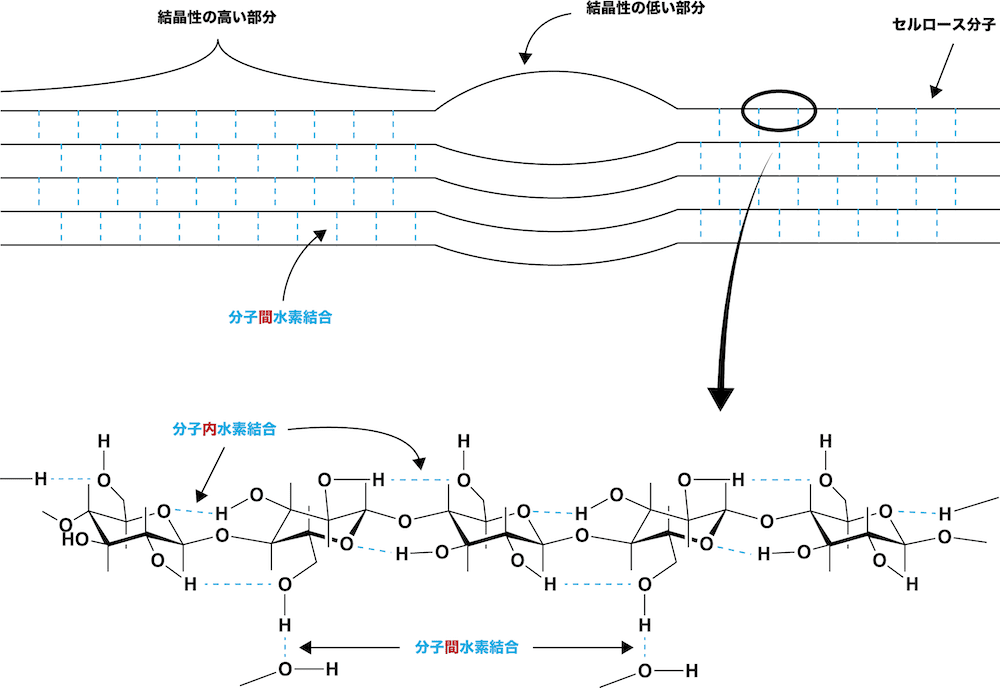
- 分子内の-OHは直線構造を補強する「分子内水素結合」だけではなく、分子同士を結びつける「分子間水素結合」も形成している。
多糖類の性質
- 多糖類は多数の単糖が脱水縮合してできた高分子化合物である。
- 単糖類や二糖類のような低分子化合物と異なり、分子量が非常に大きく複雑な立体構造をもつため、その点に基づき性質を理解する必要がある。
- 代表的な多糖類の性質は次の通りである。
●多糖の性質
- 吸湿性
- 水溶性
- ヨウ素デンプン反応
- 還元性がない
- 加水分解する
- セルロースの利用
❶ 吸湿性
- 多糖類は化合物内にヒドロキシ基(-OH)が多いため、吸湿性が非常に高い。
❷ 水溶性
- デンプンとセルロースに分けて解説する。
デンプン
冷水には溶けにくいが、熱水には溶ける
- アミロースの-OHはらせん構造を形成するための「分子内水素結合」に使われるため、多数の-OHがあるにも関わらず、冷水には溶けにくい。
- しかし、熱すると分子内水素結合が切れてらせん構造が崩れ、水分子と水素結合を形成することができる。その結果、熱水によく溶ける。
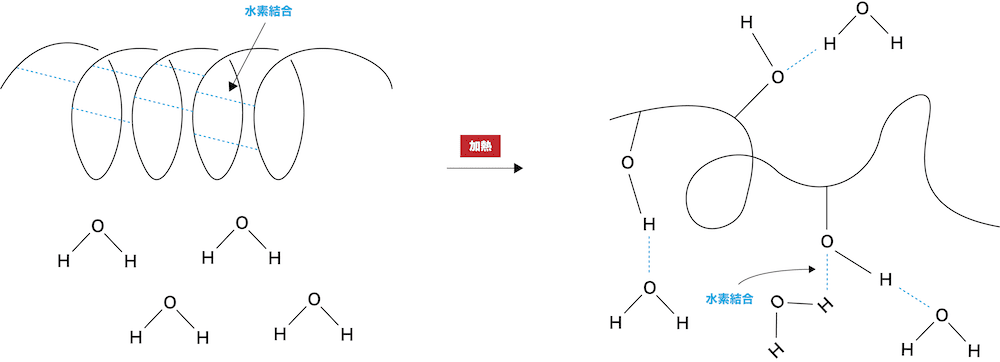
- 一方、アミロペクチンは枝分かれが多く、アミロースに比べて分子量も大きいため、熱水の場合も溶けにくく、白くなって下に沈む(白色沈殿)。
セルロース
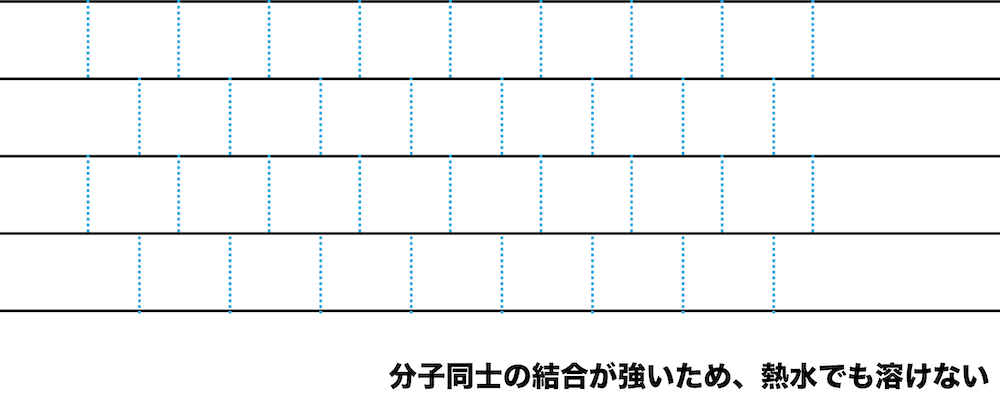
- セルロースの-OHは、分子内だけではなく、分子間での水素結合にも使われている。
- 規則正しく生じた水素結合によって分子同士が強く結びついているため、熱水に対しても結晶部分が崩れないので、溶けることはほとんどない。
水に不溶であり、ほぼ全ての溶媒に溶けない
- セルロースの-OHは、分子内だけではなく、分子間での水素結合にも使われている。
- 規則正しく生じた水素結合によって分子同士が強く結びついているため、熱水に対しても結晶部分が崩れないので、溶けることはほとんどない。
セルロースは基本的に溶媒に溶けにくいですが、特殊な方法を用いると溶かすことができます。セルロースを溶かす方法について詳しくはシュバイツァー試薬や二硫化炭素を用いてセルロースを溶かす方法を確認しましょう。
❸ ヨウ素デンプン反応
デンプン → 呈色する
セルロース → 呈色しない
- デンプンのアミロースやアミロペクチンにヨウ素ヨウ化カリウム溶液を加えると青〜青紫色を呈する。この反応をヨウ素デンプン反応という。
- 一方、セルロースはらせん構造をもたないので呈色しない。
❹ 還元性がない
- 多糖類は高分子化合物であり、還元性を示す「末端」の分子全体に対する比率が極めて小さい。したがって、実質的に還元性を示さない。
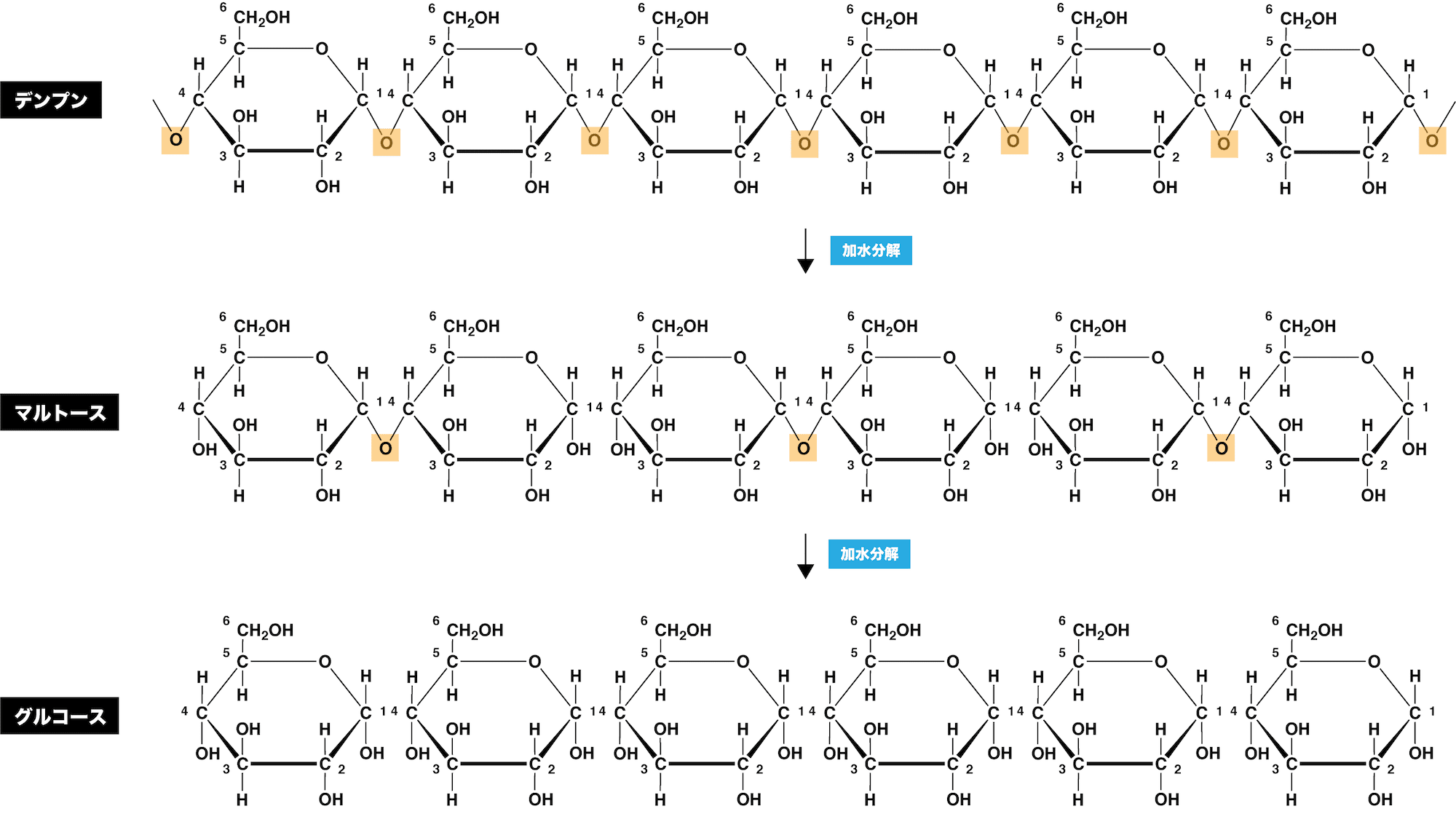
❺ 加水分解する
- 多糖類は、酵素又は酸の触媒作用により加水分解し、二糖または単糖となる。
\[ \begin{align}
&\mathrm{\underbrace{(C_{6}H_{10}O_{5})_{n} }_{ 多糖 }+(\frac{ n }{ 2 }-1)H_{2}O \overset{酵素}{\longrightarrow} \underbrace{ \frac{ n }{ 2 }C_{12}H_{22}O_{11} }_{ 二糖 } }\\
&\mathrm{\underbrace{(C_{6}H_{10}O_{5})_{n} }_{ 多糖 }+(n-1)H_{2}O \overset{酸}{\longrightarrow} \underbrace{ nC_{6}H_{12}O_{6} }_{ 単糖 }} \end{align}\]
- デンプンは酵素アミラーゼにより加水分解され、途中分解生成物であるデキストリンを経て、マルトース(麦芽糖)になる(ここにマルターゼを加えるとさらにグルコースまで分解される:二糖の加水分解)。
- 一方、酸を用いるとマルトースで止まらず、グルコースまで一気に分解される。
- セルロースは酵素セルラーゼにより加水分解されてセロビオースになる(ここにセロビアーゼを加えるとさらにグルコースまで分解される:二糖の加水分解)。
- 一方、酸を用いるとセロビオースで止まらずに、グルコースまで一気に分解される。
❻ セルロースの利用
- セルロースは再生繊維(レーヨン)やエステル化した化合物として利用される。
- この辺りについて詳しくは次のページを参照のこと。
参考:ビスコースレーヨンと銅アンモニアレーヨン(合成法/作り方・原理・構造式・具体的な用途など)
参考:ニトロセルロースとアセチルセルロース(合成法/作り方や構造、用途など)














