MENU
フェノール類(名称・製法・性質・反応など)
目次
はじめに
【プロ講師解説】このページでは『フェノール類(名称・製法・性質・反応など)』について解説しています。
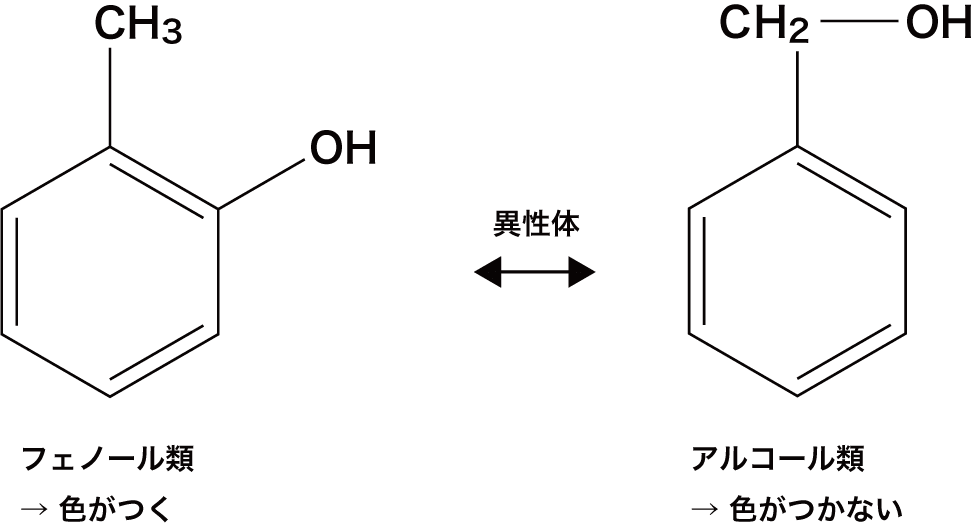
フェノール類とは
- ベンゼン環の水素H原子がヒドロキシ基(-OH)で置換されたものをフェノール類という。

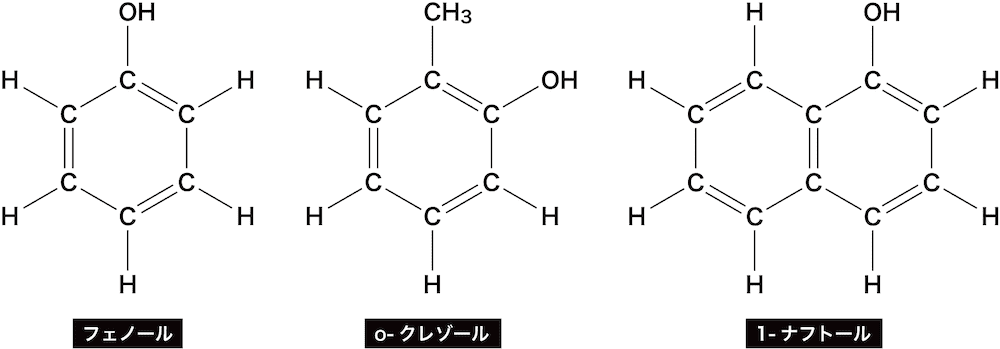
フェノール類の名称
- フェノール類はアルコールと同様に語尾が「オール(ol)」になる。
フェノールの製法
- 代表的なフェノールの製法を解説する。
●フェノールの製法
- クメン法(現代の工業的製法)
- アルカリ融解法(昔の工業的製法)
- ダウ法(クロロベンゼンの加水分解)
❶ クメン法(現代の工業的製法)
- フェノールの現代の工業的製法であるクメン法の流れを示す。
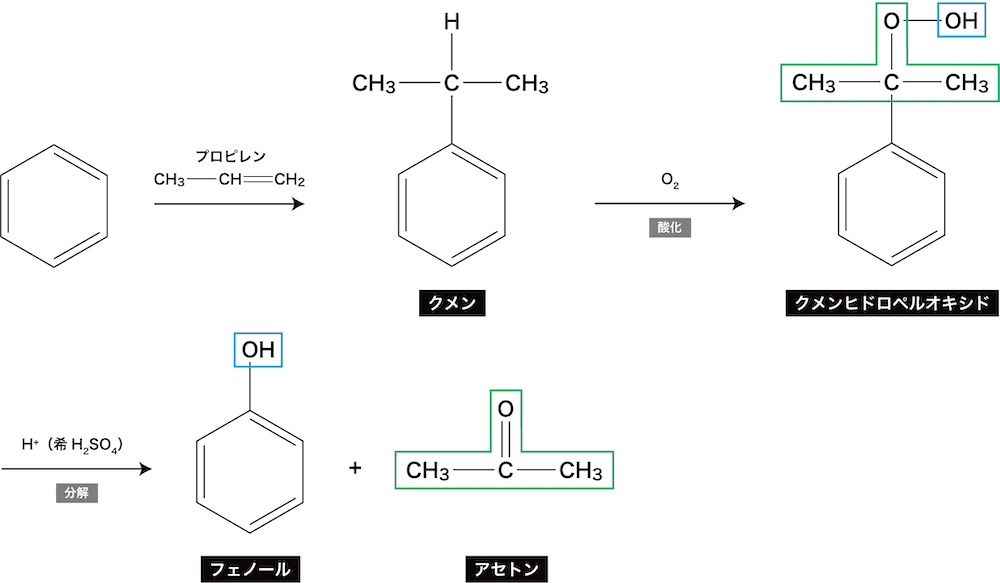
- プロピレンでベンゼンのHを置換し、クメンを得る(正確にはプロピレンにH+を付加後ベンゼンのHを置換)。
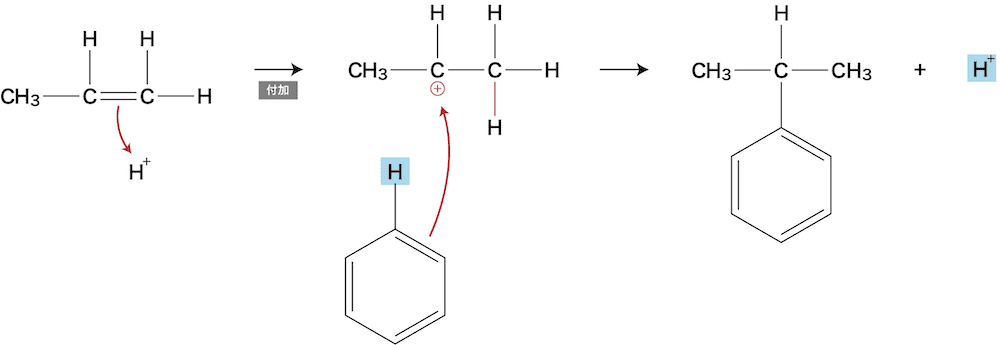
- クメンを酸素で穏やかに酸化してクメンヒドロペルオキシドという過酸化物が生じる。
- 希硫酸中で-O-O-結合が切断され、複雑な反応を経て、アセトンとフェノールが得られる。
❷ アルカリ融解法(昔の工業的製法)
- フェノールの昔の工業的製法であるアルカリ融解法の流れを示す。
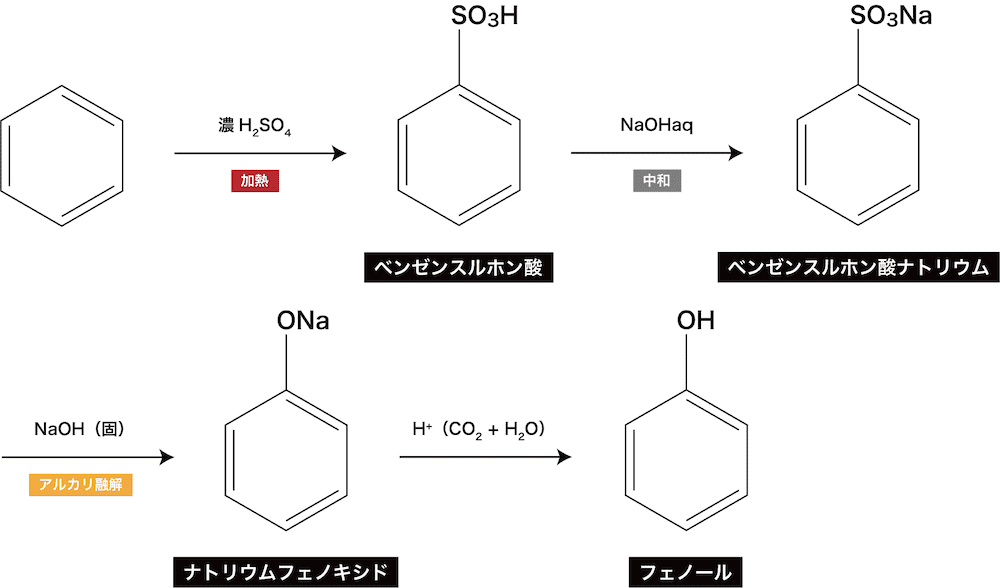
- ベンゼンを濃硫酸とともに加熱するとベンゼンスルホン酸が生じる。
- ベンゼンスルホン酸と水酸化ナトリウム水溶液を混ぜてベンゼンスルホン酸ナトリウムを得る。
- ベンゼンスルホン酸ナトリウムと水酸化ナトリウム(固体)を混ぜて約300℃に加熱し、ナトリウムフェノキシドを得る。固体が融解した状態で反応が進むのでこの過程はアルカリ融解とよばれる。
- ナトリウムフェノキシドに塩酸や炭酸のようなフェノールよりも強い酸を加えることで弱酸遊離反応によってフェノールを得る(詳しくは後述)。
❸ ダウ法(クロロベンゼンの加水分解)
- クロロベンゼンの加水分解を利用するダウ法の流れを示す。
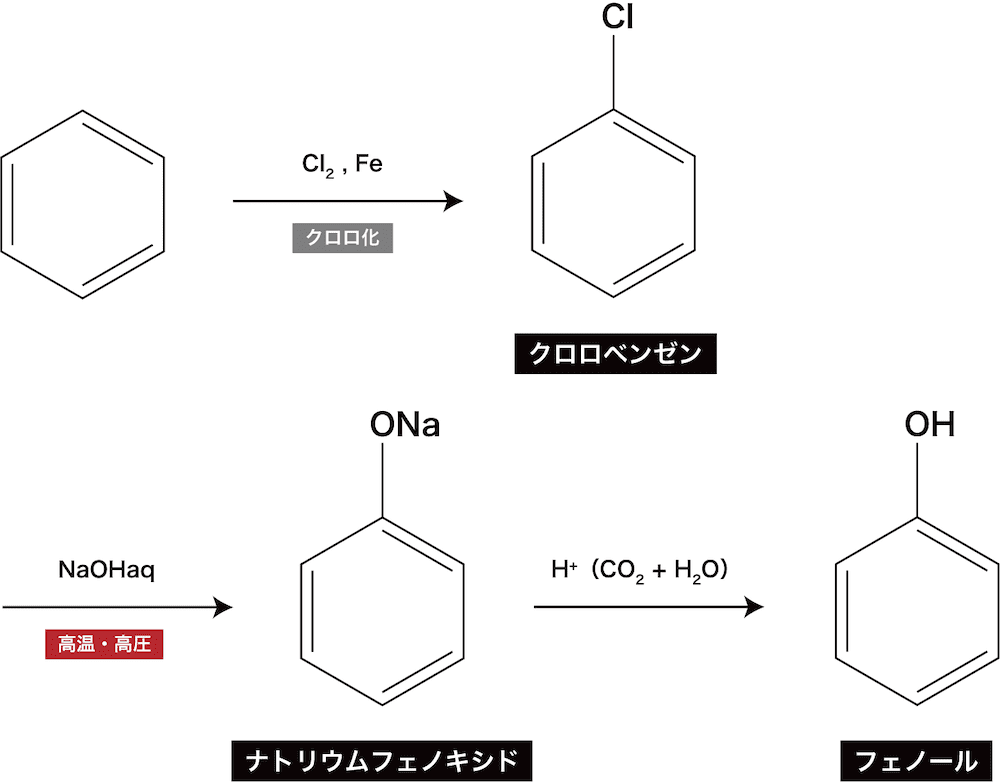
- ベンゼンを塩素と反応させてクロロ化し、クロロベンゼンを得る。
- クロロベンゼンを水酸化ナトリウム水溶液と混ぜ、300℃に加熱し、ナトリウムフェノキシドを得る。この際(クロロベンゼンは揮発性の液体なので)2.0×107程度の圧力をかけて蒸発を防ぐ必要がある。また、高圧下では、水も蒸発しにくいので、(アルカリ融解法と異なり)液体同士で混ぜやすい水酸化ナトリウム”水溶液”を用いる。
- アルカリ融解法と同様、ナトリウムフェノキシドに塩酸や炭酸のようなフェノールよりも強い酸を加えることで弱酸遊離反応によってフェノールを得る(詳しくは後述)。
フェノールの性質
- フェノールの性質として知っておくべきは次の3つである。
●フェノールの性質
- 弱酸性
- 沸点/融点が高い
❶ 弱酸性
- フェノールは僅かに電離して水素イオンH+を出すため、弱酸性である。

フェノールが酸性になる理由
- 同じようにヒドロキシ基-OHをもつ化合物のアルコールは中性なのに、フェノールはなぜ酸性になるの?という質問をよく受けるので解説する。
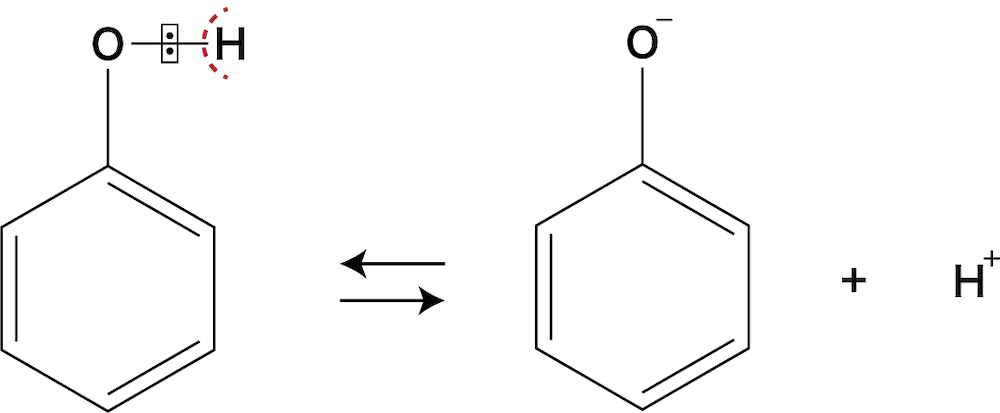
- フェノールが弱酸性、アルコールが中性なのは「フェノキシドイオンはO原子上の余剰な負電荷をベンゼン環に与えることによって安定化できるから」である。
- H+が脱離したときにできるイオンが安定したものだとH+が脱離しやすくなる。
フェノールからH+が脱離してできるフェノキシドイオンは、余っている負電荷をベンゼン環の方に流すことによって安定化できるため、比較的H+が脱離しやすく、酸性となる。 - 一方、アルコールからH+が脱離してできるアルコキシドイオンは負電荷を分散することができないため、H+が脱離しづらく、中性となる。
- また、フェノールはあくまで弱酸であり、カルボン酸や炭酸などと比較して弱い酸であることも知っておこう。
塩酸,硫酸 > カルボン酸 > 炭酸(第1電離) > フェノール
(塩酸,硫酸のみ強酸、後は弱酸)
❷ 沸点/融点が高い
- フェノールはヒドロキシ基-OHをもっており、分子間で水素結合を形成するため、沸点・融点が非常に高く常温常圧で白色結晶である。
フェノールの反応①(中和反応)
- 先述の通り、フェノールは水に溶けて僅かに酸性を示す。
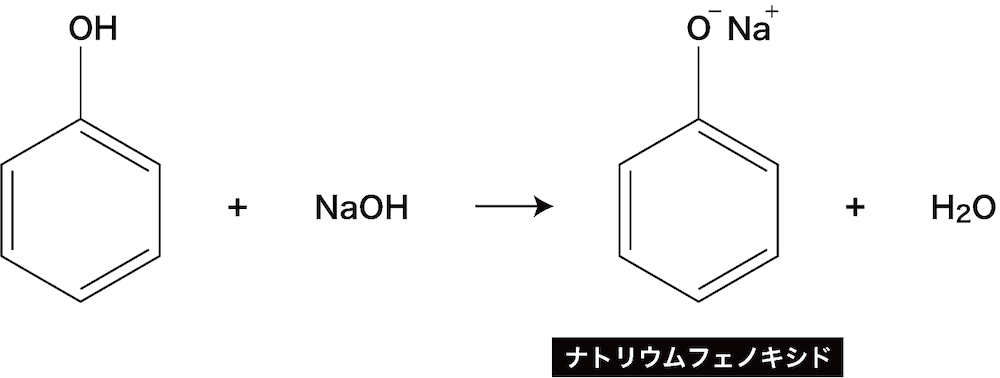
- 酸であるフェノールに塩基である水酸化ナトリウムNaOHを反応させると、中和反応が起こり、ナトリウムフェノキシドとよばれる塩が生成する。
フェノールの反応②(弱酸遊離反応)
- ナトリウムフェノキシドとH2CO3を反応させるとフェノールが遊離する。
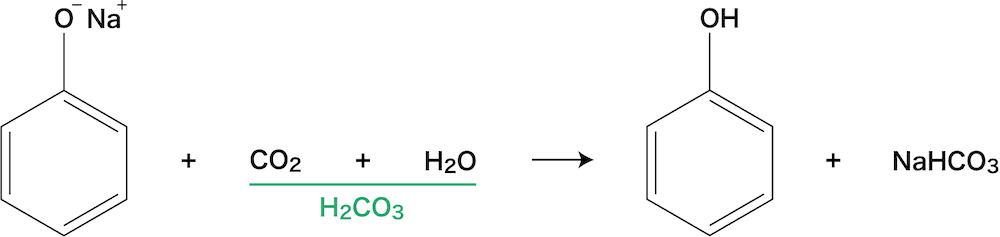
- この反応は酸としての強さが「H2CO3>フェノール」であるために起こる弱酸遊離反応である。
フェノールの反応③(置換反応)
- 代表的なフェノールの反応を2つ紹介する。
●フェノールの反応
- ブロモ化
- ニトロ化
❶ ブロモ化
- フェノールと臭素Br2を反応させると2.4.6-トリブロモフェノールの白色沈殿が生成する。

ベンゼンの臭素化では鉄などの触媒が必要でしたが、フェノールの臭素化(ブロモ化)は触媒なしでOKです。
❷ ニトロ化
- フェノールを混酸(濃硝酸+濃硫酸)とともに加熱するとニトロフェノールが得られる。(-OHは電子供与性の官能基なので、オルトニトロフェノール・パラニトロフェノールが主生成物)
- これをさらに続けると2.4.6-トリニトロフェノール(ピクリン酸)の黄色沈殿が得られる。
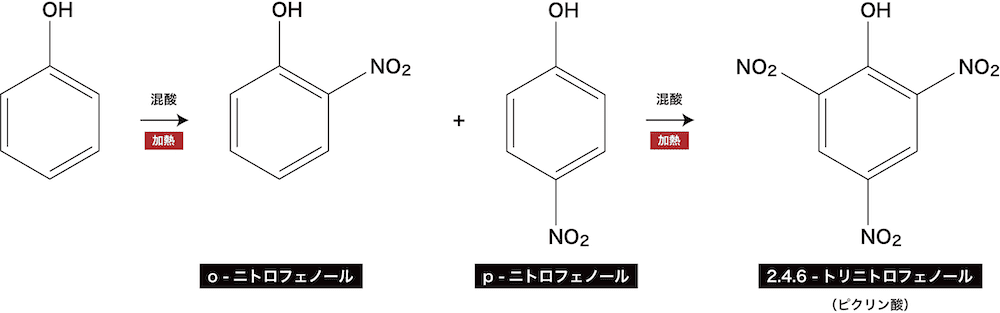
- ピクリン酸は水に溶けて弱酸性を示す。
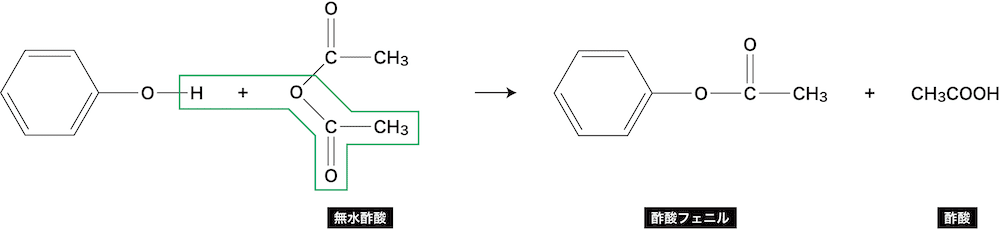
フェノールの反応④(エステル化(アセチル化))
- フェノールは無水酢酸(CH3CO)2Oと反応してエステルを形成する。
フェノールの反応⑤(検出反応)
- ベンゼン環に直接結合したヒドロキシ基-OHをフェノール性ヒドロキシ基という。
- このフェノール性ヒドロキシ基をもつ物質(フェノール類)はFe3+と錯イオンを形成して呈色する。
| 化合物 | FeCl3水溶液を加えた際の呈色 |
|---|---|
| フェノール | 紫 |
| クレゾール | 青紫 |
| 1-ナフトール | 紫 |
| 2-ナフトール | 緑 |
- この反応はフェノール性ヒドロキシ基の検出反応として用いられる。
- なお、ヒドロキシ基があっても、ベンゼン環に直接結合していないとフェノール性ヒドロキシ基ではないため呈色しない。