MENU
緩衝液(仕組み・共通イオン効果・濃度を使ったpH計算の解き方など)
はじめに
【プロ講師解説】このページでは『緩衝液(仕組み・共通イオン効果・濃度を使ったpH計算の解き方など)』について解説しています。
緩衝液とは
- 弱酸とその塩の混合液、また弱塩基とその塩の混合液を緩衝液という。
- 緩衝液は酸や塩基を多少加えてもそのpHを変化させない性質(=緩衝作用)をもっている。
緩衝液の仕組み
- 緩衝液(緩衝作用)の仕組みについて、酢酸と酢酸ナトリウムの混合液を例に解説する。
酸を加える
- 酢酸と酢酸ナトリウムの混合液にHCl(酸)を加えると、次のような反応が起こる。
\[ \mathrm{CH_{3}COONa + HCl → CH_{3}COOH + NaCl} \]
- (HClから出た)H+が(CH3COONaから出た)CH3COOーと反応してCH3COOHとなり、結果的に溶液中のH+の濃度にはほとんど変化がない(=pHにほとんど変化がない)。
塩基を加える
- 次に、酢酸と酢酸ナトリウムの混合液にNaOH(塩基)を加えた場合を考える。
\[ \mathrm{CH_{3}COOH + NaOH → CH_{3}COONa + H_{2}O} \]
- これも、(NaOHから出た)OHーが(CH3COOHから出た)H+と反応して無くなり、溶液中のOHーの濃度に変化はない(=pHにほとんど変化がない)。
- このように、多少の酸や塩基が入ってきてもpHを変化させない性質を緩衝作用という。
共通イオン効果
- 次は共通イオン効果というものについて、先ほどと同様酢酸と酢酸ナトリウムの混合溶液を使って解説する。
- 一般的に、水溶液中で酢酸ナトリウム、酢酸は次のような反応を起こす。
\[ \begin{align}
&\mathrm{CH_{3}COONa → CH_{3}COO^{-} + Na^{+}}\\
&\mathrm{CH_{3}COOH → CH_{3}COO^{-} + H^{+}}
\end{align} \]
- 酢酸ナトリウムは塩のため、完全に電離する(上の式)。酢酸も(電離度を考慮しなくてはならないが)電離する(下の式)。
- しかし、これらが混合液になったとき、普段とは少し異なった反応を示す。酢酸ナトリウムの方は、通常通り電離する。
\[ \mathrm{CH_{3}COONa → CH_{3}COO^{-} + Na^{+}} \]
- 酢酸も電離しようとするが、酢酸ナトリウムから酢酸イオン(CH3COOー)が大量に出ているため抑制される。
\[ \mathrm{CH_{3}COOH ← CH_{3}COO^{-} + H^{+}} \]
- このように「共通しているイオンの放出が抑制される」ことを共通イオン効果という。
ヘンダーソン・ハッセルバルヒの式
- 緩衝液のpHを計算する前準備として、ヘンダーソン・ハッセルバルヒの式について解説する。
●ヘンダーソン・ハッセルバルヒの式
\[\mathrm{pH=p}K_{\mathrm{a}}+\mathrm{log}_{10}\frac{ C_{s} }{ C_{a} }\]
- 酢酸ナトリウムの濃度をCs、酢酸の濃度をCaとすると次のように近似できる。
\[\begin{align}
& [\mathrm{CH_{3}COO^{-}}]≒C_{s}\\
&\mathrm{[CH_{3}COOH]}≒C_{a}
\end{align}\]
- これは、CH3COONaが完全電離すること、また共通イオン効果により、CH3COOHの電離が抑制されることから理解できるはずである。さらに、これを使うと次のような式変形を行うことができる。
\[ \begin{align}K_{a}&=\mathrm{\frac{ [CH_{3}COO^{-}][H^{+}] }{ [CH_{3}COOH] }}\\
↔︎\mathrm{[H^{+}]}&=K_{a}×\mathrm{\frac{ [CH_{3}COOH] }{ [CH_{3}COO^{-}] }}\\
&=K_{a}×\frac{ C_{a} }{ C_{s} } \end{align} \]
\[ \begin{align}
\mathrm{pH}&\mathrm{=-log_{10}[H^{+}]}\\
&\mathrm{=-\mathrm{log}_{10}}(\frac{ K_{a}×C_{a} }{ C_{s} })\\
&\mathrm{=-\mathrm{log}}_{10}K_{a}-\mathrm{log}_{10}( \frac{ C_{a} }{ C_{s} })\\
&=\mathrm{p}K_{a}-\mathrm{log}_{10}(\frac{ C_{a} }{ C_{s} })\\
&=\mathrm{p}K_{a}+\mathrm{log}_{10}(\frac{ C_{s} }{ C_{a} }) \end{align} \]
- 一番最後の式をヘンダーソン・ハッセルバルヒの式とよび、緩衝液のpHを求める際に使うことが多い。
緩衝液のpH計算
- 入試頻出の緩衝液が絡んだpH計算の解き方を解説する。
参考:【pH計算】定義から公式、求め方、希釈や混合が絡む問題など
緩衝液のpHの求め方
0.20mol/L酢酸水溶液20mlと0.20mol/L酢酸ナトリウム水溶液10mlを混合して、1.0Lの混合溶液とした。このとき、この溶液のpHを求めよ。ただし、酢酸のpKaは4.7、log2=0.30とする。
\[ \begin{align}
\mathrm{pH}&=\mathrm{p}K_{a}+\mathrm{log}_{10}(\frac{ C_{s} }{ C_{a} }) \\
&=4.7+\mathrm{log}_{10}(\frac{ \frac{ 0.20×\frac{ 10 }{ 1000 } }{ 1.0 } }{ \frac{ 0.20×\frac{ 20 }{ 1000 } }{ 1.0 } }) \\
&=4.7-0.30\\
&=4.4
\end{align} \]
緩衝液に酸を加えた場合のpHの求め方
酢酸と酢酸ナトリウムが0.12molずつ含まれた1.0Lの混合溶液がある。
(1)この混合溶液のpHを求めよ。ただし、酢酸のpKaは4.7とする。
(2)この混合溶液に、1.0mol/Lの塩酸を40mL加えた。このときの混合溶液のpHを求めよ。ただし、log2=0.30とする。
(1)
- ヘンダーソン・ハッセルバルヒの式に与えられた値を当てはめる。
\[ \begin{align}
\mathrm{pH}&=\mathrm{p}K_{a}+\mathrm{log}_{10}(\frac{ C_{s} }{ C_{a} }) \\
&=4.7+\mathrm{log}_{10}(\frac{ \frac{ 0.12 }{ 1.0 } }{ \frac{ 0.12 }{ 1.0 } } ) \\
&=4.7-0\\
&=4.7
\end{align} \]
(2)
- 緩衝液に酸または塩基を加えたときのpHは以下のSTEPで求める。
●STEP1
反応量シートを書く。
→酸(塩基)と塩のmolを求める。
●STEP2
STEP1で求めたmolをヘンダーソン・ハッセルバルヒの式に当てはめる。
→混合溶液のpHを求める。
→酸(塩基)と塩のmolを求める。
まずは、反応量シートを書く。(反応量シートの書き方については化学反応式(係数・作り方・書き方・計算問題の解き方など)を参照)
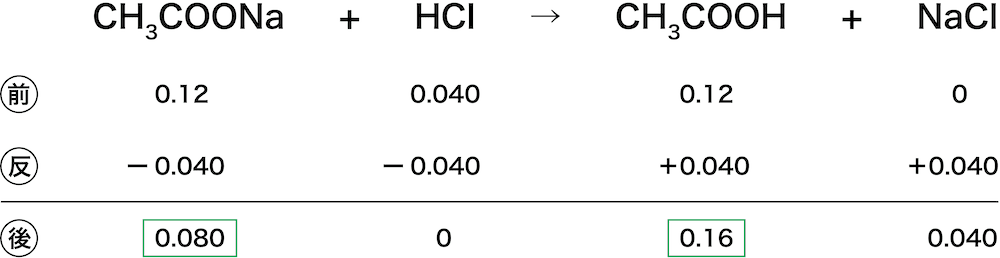
このシートにより、酸(CH3COOH)と塩(CH3COONa)のmol数が分かる。
→混合溶液のpHを求める。
次に、STEP1で出したmolをヘンダーソン・ハッセルバルヒの式に代入する。(ここでは一応濃度に変換しているが、同じ溶液中にいる=体積が同じなので、molのまま使ってもOK)
\[ \begin{align}
\mathrm{pH}&=\mathrm{p}K_{a}+\mathrm{log}_{10}(\frac{ C_{s} }{ C_{a} }) \\
&=4.7+\mathrm{log}_{10}(\frac{ \frac{ 0.080 }{ 1 } }{ \frac{ 0.16 }{ 1 } } ) \\
&=4.7-0.30\\
&=4.4
\end{align} \]
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
弱酸とその塩の混合液、また弱塩基とその塩の混合液を【1】という。
解答/解説:タップで表示
解答:【1】緩衝液
弱酸とその塩の混合液、また弱塩基とその塩の混合液を緩衝液という。
緩衝液は酸や塩基を多少加えてもそのpHを変化させない性質(=【1】)をもっている。
解答/解説:タップで表示
解答:【1】緩衝作用
緩衝液は酸や塩基を多少加えてもそのpHを変化させない性質(=緩衝作用)をもっている。
塩化銀AgClの飽和水溶液に塩化ナトリウムNaClを加えると塩化物イオンClーの濃度が高くなるため、Clーの濃度が【1(増加 or 減少)】する方向に平衡が移動し、AgClの固体が析出する。この現象を【2】という。
解答/解説:タップで表示
解答:【1】減少【2】共通イオン効果
塩化銀AgClの飽和水溶液に塩化ナトリウムNaClを加えると塩化物イオンClーの濃度が高くなるため、Clーの濃度が減少する方向に平衡が移動し、AgClの固体が析出する。この現象を共通イオン効果という。
\[ \mathrm{AgCl⇄Ag^{+}+Cl^{-}} \]
0.20mol/L酢酸水溶液20mlと0.20mol/L酢酸ナトリウム水溶液10mlを混合して、1.0Lの混合溶液とした。このとき、この溶液のpHを求めよ。ただし、酢酸のpKaは4.7、log2=0.30とする。
解答/解説:タップで表示
解答:4.4
\[ \begin{align}
\mathrm{pH}&=\mathrm{p}K_{a}+\mathrm{log}_{10}(\frac{ C_{s} }{ C_{a} }) \\
&=4.7+\mathrm{log}_{10}(\frac{ \frac{ 0.20×\frac{ 10 }{ 1000 } }{ 1.0 } }{ \frac{ 0.20×\frac{ 20 }{ 1000 } }{ 1.0 } }) \\
&=4.7-0.30\\
&=4.4
\end{align} \]














