MENU
電離平衡(公式の導出・例・pHが絡む計算問題の解き方など)
はじめに
【プロ講師解説】このページでは『電離平衡(公式の導出・例・pHが絡む計算問題の解き方など)』について解説しています。
電離平衡・電離定数とは
- 電離平衡と電離定数について、酢酸CH3COOHとアンモニアNH3を例に解説する。
酢酸の電離平衡
- 弱電解質(弱酸や弱塩基)を水に溶かすと、完全には電離せず次のような平衡状態に達する。
\[ \mathrm{CH_{3}COOH+H_{2}O⇄CH_{3}COO^{-}+H_{3}O^{+}} \]
- このような平衡を(酢酸の)電離平衡という。
- ここで、上の式を平衡定数の式で表すと、次のようになる。
\[ K=\mathrm{\frac{ [CH_{3}COO^{-}][H_{3}O^{+}] }{ [CH_{3}COOH][H_{2}O] }=一定} \]
- この式中で、H2Oは他の化学種に比べて多量に存在しているため、電離や平衡によって消費・生成する量は(相対的に)ムシすることができる。そこで、[H2O]を一定とみなすと、次のようになる。
\[ K\mathrm{[H_{2}O]=\frac{ [CH_{3}COO^{-}][H_{3}O^{+}] }{ [CH_{3}COOH] }=一定} \]
- K[H2O]を改めてKaとおき、また[H3O+]は[H+]の形で表しても良いことを考慮すると…
\[ K_{a}=\mathrm{\frac{ [CH_{3}COO^{-}][H^{+}] }{ [CH_{3}COOH] } }\]
- このような式が導き出される。このKaを(酢酸の電離平衡における)電離定数という。
アンモニアの電離平衡
- アンモニアも弱電解質であり、水に溶かすと電離平衡の状態になる。
\[\mathrm{ NH_{3}+H_{2}O⇄NH_{4}^{+}+OH^{-} }\]
- これを平衡定数の式で表すと、次のようになる。
\[ K=\mathrm{\frac{ [NH_{4}^{+}][OH^{-}] }{ [NH_{3}][H_{2}O] }=一定} \]
- この式中でH2Oは他の化学種に比べて多量に存在しているため電離や平衡によって生成する量は(相対的に)ムシすることができる。そこで、[H2O]を一定とみなすと、次のようになる。
\[ K\mathrm{[H_{2}O]=\frac{ [NH_{4}^{+}][OH^{-}] }{ [NH_{3}] }=一定} \]
- K[H2O]を改めてKbとおくと…
\[ K_{b}=\mathrm{\frac{ [NH_{4}^{+}][OH^{-}] }{ [NH_{3}] }} \]
- このような式が得られる。このKbを(アンモニアの電離平衡における)電離定数という。
電離平衡の公式(導出・まとめ)
- 電離平衡の分野で有名な公式について、概要や導出方法をまとめる。
酢酸の電離平衡
- 酢酸のモル濃度をc(mol/L)、電離度をαとすると、電離平衡時の各物質の変化量は次のように表すことができる。

- 電離定数の式にこれらを代入すると、次のようになる。
\[ \begin{align}
K_{a}&\mathrm{=\frac{ [CH_{3}COO^{-}][H^{+}] }{ [CH_{3}COOH] }}\\
&=\frac{ cα×cα }{ c(1-α) }\\
&=\frac{ cα^{2} }{ 1-α }
\end{align} \]
- ここで、酢酸の電離度はα<<1(1よりめっちゃ小さい)なので「1ーα≒1」と近似できる。 したがって、次の3つの公式が成り立つ。
\[ \begin{align}&【公式1】\\
K_{a}&=cα^{2}\\
\ \\
&【公式2】\\
α&=\sqrt{ \frac{ K_{a} }{ c } }\\
\ \\
&【公式3】\\
\mathrm{[H^{+}]}&=cα\\
&=c×\sqrt{ \frac{ K_{a} }{ c } }\\
&=\sqrt{ cK_{a} }
\end{align}
\]
アンモニアの電離平衡
- アンモニアのモル濃度をc(mol/L)、電離度をαとすると、電離平衡時の各物質の変化量は次のように表すことができる。
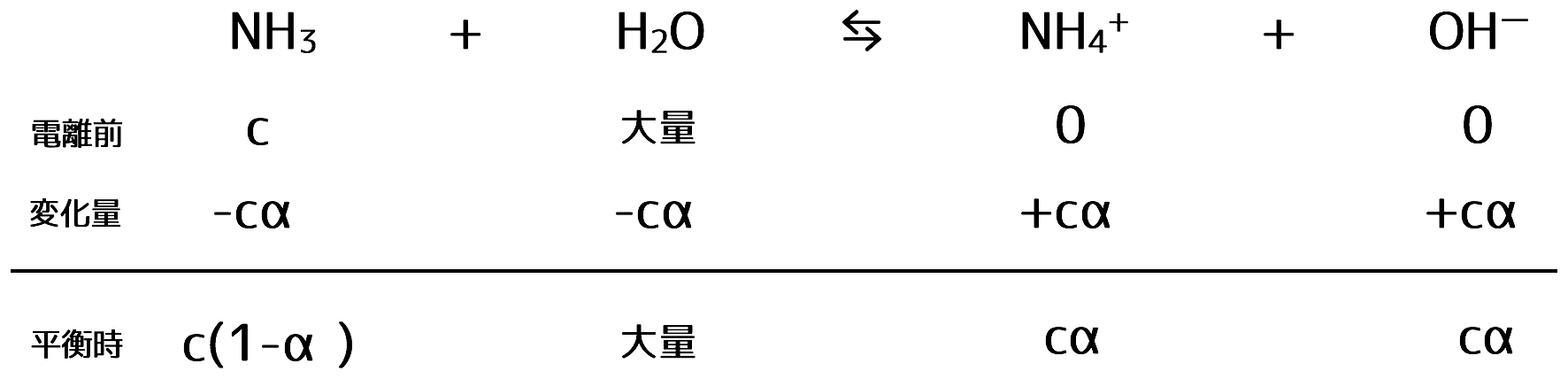
- 電離平衡の式にこれらを代入すると、次のようになる。
\[ \begin{align}
K_{b}&\mathrm{=\frac{ [NH_{4}^{+}][OH^{-}] }{ [NH_{3}] }}\\
&=\frac{ cα×cα }{ c(1-α) }\\
&=\frac{ cα^{2} }{ 1-α }
\end{align} \]
- 酢酸同様、アンモニアの電離度はα<<1なので「1ーα≒1」と近似できる。 したがって、次の3つの公式が成り立つ。
\[ \begin{align}&【公式1】\\
K_{b}&=cα^{2}\\
\ \\
&【公式2】\\
α&=\sqrt{ \frac{ K_{b} }{ c } }\\
\ \\
&【公式3】\\
\mathrm{[OH^{-}]}&=cα\\
&=c×\sqrt{ \frac{ K_{b} }{ c } }\\
&=\sqrt{ cK_{b} }
\end{align}
\]
電離平衡の計算問題
- 電離平衡に関する計算問題の解き方について解説する。
次の問いに答えよ。ただし、酢酸・アンモニアの電離度はどちらも0.010、水のイオン積([H+][OHー])は1.0×10ー14、log102=0.3とする。
(1)0.20mol/Lの酢酸水溶液の電離定数Ka、水素イオン濃度[H+]、pHを求めよ。
(2)0.10mol/Lのアンモニア水溶液の電離定数Kb、水酸化物イオン濃度[OHー]、pHを求めよ。
(1)
- まずは電離定数Kaから求める。問題文に酢酸の電離度は0.010と書いてあるので、上で紹介した【公式1】を用いると、次のようにKaを求めることができる。
\[ \begin{align}
K_{a}&=cα^{2}\\
&=0.20×(0.010)^{2}\\
&=2.0×10^{-5}
\end{align} \]
- 次に、公式3を使って水素イオン濃度[H+]を求める。
\[ \begin{align}
[\mathrm{H^{+}}]&=\sqrt{ cK_{a} }\\
&=\sqrt{ 0.20×2.0×10^{-5} }\\
&=2.0×10^{-3}
\end{align} \]
この場合は、[H+]=cαの公式を使っても求めることもできます。
- 最後に【pH計算】定義から公式、求め方、希釈や混合が絡む問題などで紹介した公式を用いてpHを求める。
\[ \begin{align}
\mathrm{pH}&\mathrm{=-log_{10}[H^{+}]}\\
&\mathrm{=-log_{10}(2.0×10^{-3})}\\
&=2.7
\end{align} \]
(2)
- まずは電離定数Kbから求める。問題文にアンモニアの電離度は0.010と書いてあるので、上でやった【公式1】を用いると、次のようにKbを求めることができる。
\[ \begin{align}
K_{b}&=cα^{2}\\
&=0.10×(0.010)^{2}\\
&=1.0×10^{-5}
\end{align} \]
- 次に公式3を使って水酸化物イオン濃度[OH–]を求める。
\[ \begin{align}
[\mathrm{OH^{-}}]&=\sqrt{ cK_{b} }\\
&=\sqrt{ 0.10×1.0×10^{-5} }\\
&=1.0×10^{-3}
\end{align} \]
- 最後にpHを求める。pHを求めるためにまずは問題文にある[H+][OHー]=1.0×10ー14の関係を用いて[H+]を導く。
\[ \begin{align}
\mathrm{[H^{+}][OH^{-}]}&=1.0×10^{-14}\\
↔︎\mathrm{[H^{+}]}&=\frac{ 1.0×10^{-14} }{ \mathrm{[OH^{-}]} }\\
&=\frac{ 1.0×10^{-14} }{ 1.0×10^{-3} }\\
&=1.0×10^{-11}
\end{align} \]
- この[H+]を【pH計算】定義から公式、求め方、希釈や混合が絡む問題などで紹介した公式に当てはめることでpHを求める。
\[ \begin{align}
\mathrm{pH}&\mathrm{=-log_{10}[H^{+}]}\\
&\mathrm{=-log_{10}(1.0×10^{-11})}\\
&=11
\end{align} \]













