MENU
濃度計算の公式・解き方(質量パーセント濃度・モル濃度・質量モル濃度)
はじめに
【プロ講師解説】このページでは『濃度計算の公式・解き方(質量パーセント濃度・モル濃度・質量モル濃度)』について解説しています。
溶質・溶媒・溶液
- まずは、濃度を学ぶ基礎となる「溶質」・「溶媒」・「溶液」の違いを押さえよう。
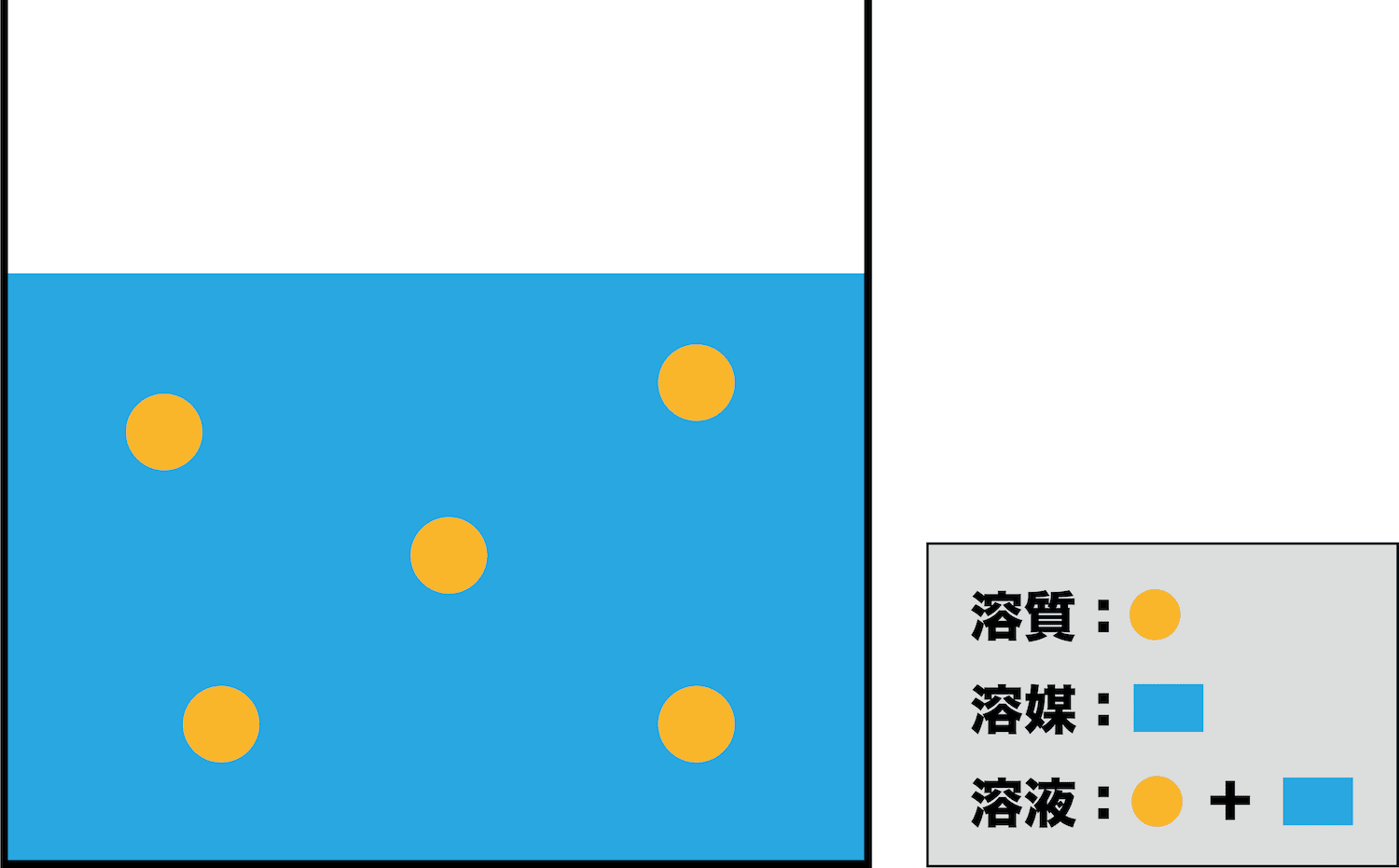
- 物質が溶けて均一な溶液になることを溶解という。
- また、溶けている物質を溶質、溶質を溶かしている液体を溶媒、溶媒と溶質を合わせたものを溶液という。
- 例えば食塩水の場合、食塩が溶質、水が溶媒、食塩水全体が溶液となる。
モル濃度
- 溶液1Lに含まれる溶質のmolをモル濃度という。
- モル濃度の単位はmol/Lである。
\[ \mathrm{モル濃度(mol/L) = \frac{ 溶質(mol) }{ 溶液(L) }} \]
質量モル濃度
- 溶媒1kgに含まれる溶質のmolを質量モル濃度という。
- モル濃度の単位はmol/kgである。
\[ \mathrm{質量モル濃度(mol/kg) = \frac{ 溶質(mol) }{ 溶媒(kg) } }\]
質量パーセント濃度
- 溶液に含まれる溶質の割合を%で表したものを質量パーセント濃度という。
\[ \mathrm{質量パーセント濃度(\%) = \frac{ 溶質(g) }{ 溶液(g) } \times 100} \]
濃度まとめ
この『濃度計算の公式・解き方(質量パーセント濃度・モル濃度・質量モル濃度)』のページで解説した内容をまとめる。
- 物質が溶けて均一な溶液になることを溶解という。
- 溶けている物質を溶質、溶質を溶かしている液体を溶媒、溶媒と溶質を合わせたものを溶液という。
- 溶液1Lに含まれる溶質のmolをモル濃度という。
- 溶媒1kgに含まれる溶質のmolを質量モル濃度という。
- 溶液に含まれる溶質の割合を%で表したものを質量パーセント濃度という。
演習問題
物質が溶けて均一な溶液になることを【1】という。
解答/解説:タップで表示
解答:【1】溶解
物質が溶けて均一な溶液になることを溶解という。
溶けている物質を【1】という。
解答/解説:タップで表示
解答:【1】溶質
溶けている物質を溶質という。
溶質を溶かしている液体を【1】という。
解答/解説:タップで表示
解答:【1】溶媒
溶質を溶かしている液体を溶媒という。
溶媒と溶質を合わせたものを【1】という。
解答/解説:タップで表示
解答:【1】溶液
溶媒と溶質を合わせたものを溶液という。
溶液1Lに含まれる溶質のmolを【1】という。
解答/解説:タップで表示
解答:【1】モル濃度
溶液1Lに含まれる溶質のmolをモル濃度という。
溶媒1kgに含まれる溶質のmolを【1】という。
解答/解説:タップで表示
解答:【1】質量モル濃度
溶媒1kgに含まれる溶質のmolを質量モル濃度という。
溶液に含まれる溶質の割合を%で表したものを【1】という。
解答/解説:タップで表示
解答:【1】質量パーセント濃度
溶液に含まれる溶質の割合を%で表したものを質量パーセント濃度という。
1.0molの水酸化ナトリウムNaOHを水に溶かして全体で2.0Lにしたときのモル濃度(mol/L)を求めよ。
解答/解説:タップで表示
解答:0.50mol/L
\[ \begin{align} \mathrm{モル濃度(mol/L)} &\mathrm{=\frac{ 溶質(mol) }{ 溶液(L) } }\\
&\mathrm{=\frac{ 1.0(mol) }{ 2.0(L) }} \\
&\mathrm{≒0.50(mol/L) }\end{align} \]
2.0molの水酸化ナトリウムNaOHを4.0kgの水に溶かしたときの質量モル濃度を求めよ。
解答/解説:タップで表示
解答:0.50mol/kg
\[ \begin{align} 質量モル濃度\mathrm{(mol/kg)} &\mathrm{=\frac{ 溶質(mol) }{ 溶媒(kg) } }\\
&\mathrm{=\frac{ 2.0(mol) }{ 4.0(kg) } }\\
&\mathrm{≒0.50(mol/kg)} \end{align}
\]
8.0gの水酸化ナトリウムを水に溶かして40gにしたときの質量パーセント濃度を求めよ。
解答/解説:タップで表示
解答:20%
\[ \begin{align} 質量パーセント濃度 &\mathrm{=\frac{ 溶質(g) }{ 溶液(g) } × 100}\\
&\mathrm{=\frac{ 8.0(g) }{ 40(g) } × 100}\\
&\mathrm{=20(\%) }\end{align} \]














