MENU
単体と化合物(定義・違い・見分け方・一覧など)
目次
はじめに
【プロ講師解説】このページでは『単体と化合物(定義・違い・見分け方・一覧など)』について解説しています。
物質の分類
- 物質は大きく,純物質と混合物に分けられる。また,純物質はさらに,単体と化合物に分けられる。
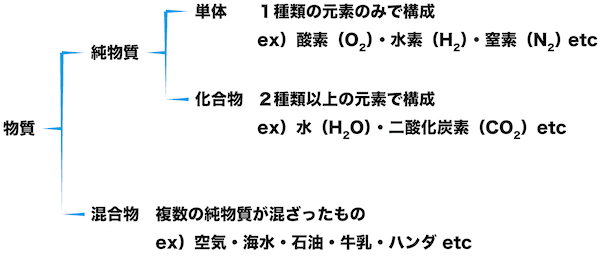
- このページでは,単体と化合物について詳しく解説する。
純物質と混合物については次のページを参照しましょう。
参考:純物質と混合物(定義・違い・見分け方・例など)
単体
- 純物質のうち,1種類の元素のみで構成されている物質を単体という。
- 例えば,酸素(O2)・水素(H2)・窒素(N2)などは全て1種類の元素から構成されているため,単体に分類される。
化合物
- 純物質のうち,2種類以上の元素から構成されている物質を化合物という。
- 例えば,水(H2O)・二酸化炭素(CO2)・塩化水素(HCl)・グルコース(C6H12O6)などは全て2種類以上の元素から構成されているため,化合物に分類される。
- 化合物は加熱をしたり,電気を流したりすると,単体まで分解することができる。
酸化銀の分解
- 化合物である酸化銀Ag2Oを加熱すると,単体である銀Agと酸素O2に分解する。
\[ \mathrm{2Ag_{2}O → 4Ag + O_{2}} \]
塩化銅(Ⅱ)の分解
- 化合物である塩化銅(Ⅱ)CuCl2の水溶液に電気を流すと,単体である銅Cuと塩素Cl2に分解する。
\[ \mathrm{CuCl_{2} → Cu + Cl_{2}} \]
分子をつくるもの・分子をつくらないもの
- 上述の通り,純物質は単体と化合物に分けることができるが,別の分類法として「分子をつくるもの」と「分子をつくらないもの」とに分ける方法もある。
- ここでは,単体と化合物それぞれの「分子をつくるもの」と「分子をつくらないもの」について具体例を挙げながら解説していく。
単体の場合
- 高校化学で頻出の単体を分子をつくるもの,分子をつくらないものに分類すると次の通りになる。
| 分子をつくるもの | 酸素・水素・窒素・ハロゲン(17族元素)・貴ガス(18族元素)などの気体 |
| 分子をつくらないもの | 鉄・銅・銀・マグネシウムなどの金属,炭素,硫黄 |
- ここで,単原子分子について簡単に解説する。単原子分子とは,1つの原子から成り、分子のようにふるまう化学種である。
- 原子の周りには電子が存在しており,その一番外側の電子(最外殻電子)が8個であれば、安定な電子配置となる。
- 表にある酸素,水素,窒素,ハロゲンなどは1つの原子だけでは最外殻電子が安定な電子配置とならないため,2つの原子が結合し,2原子分子として存在する。
- 一方,貴ガスは最外殻電子が1つの原子だけで安定な電子配置となるため単原子分子として存在する。
化合物の場合
- 高校化学で頻出の化合物を分子をつくるもの,分子をつくらないものに分類すると次の通りになる。
| 分子をつくるもの | 二酸化炭素・アンモニア・塩化水素などの気体,アルカンなどの鎖状脂肪族,カルボン酸,アルデヒド,アルコール,エーテル,エステル,芳香族化合物などの有機化合物 |
| 分子をつくらないもの | 酸化銅・塩化ナトリウム・硫化鉄などの金属の化合物 |
分子をつくるもの・つくらないものの見分け方
- ここでは,分子をつくるもの,分子をつくらないものの見分け方について解説する。
分子をつくるもの
- 分子をつくるものの例として,水H2Oが挙げられる。
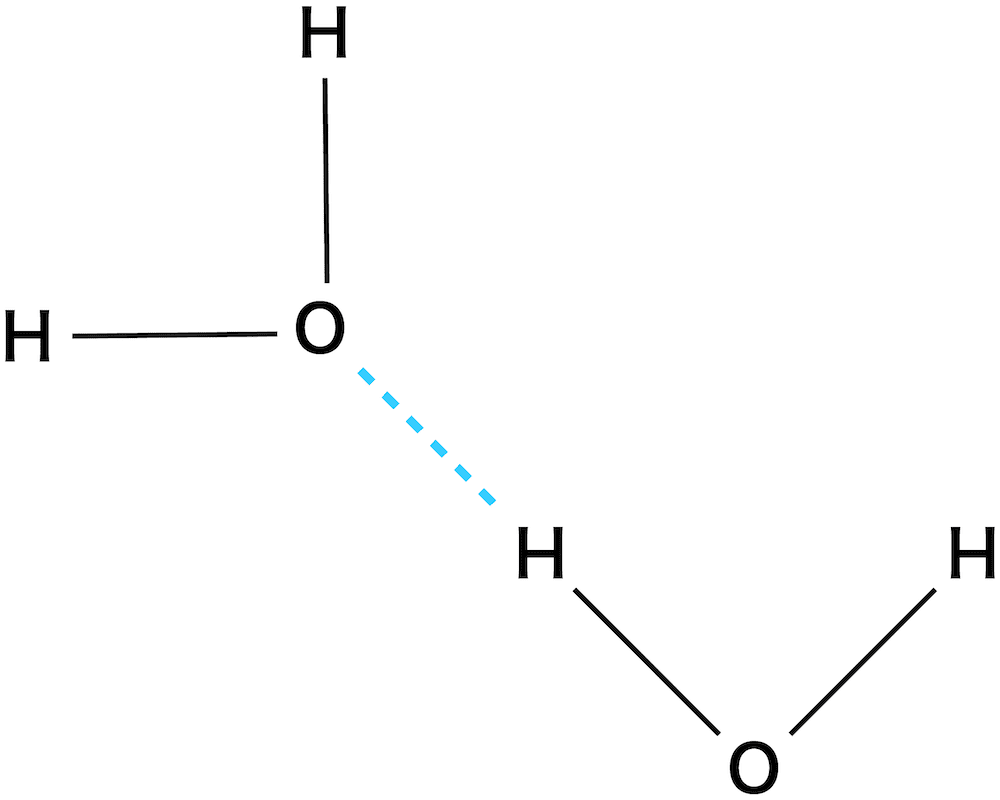
- 水分子はH-O-Hのように実際に原子が結合していて,水はH2Oの分子が1つの水分子の粒として機能している。
- 水分子と水分子の間は,分子間力という,分子をつくる際の原子同士の結合よりも弱い力で引き合っている。
参考:分子間力(水素結合・ファンデルワールス力・沸点のグラフなど)
分子をつくらないもの
- 分子をつくらないものの例としては,塩化ナトリウムNaClが挙げられる。
- 塩化ナトリウムNaClは大量のナトリウムイオンNa+と塩化物イオンCl–が交互に並んで結晶の粒をつくっている。
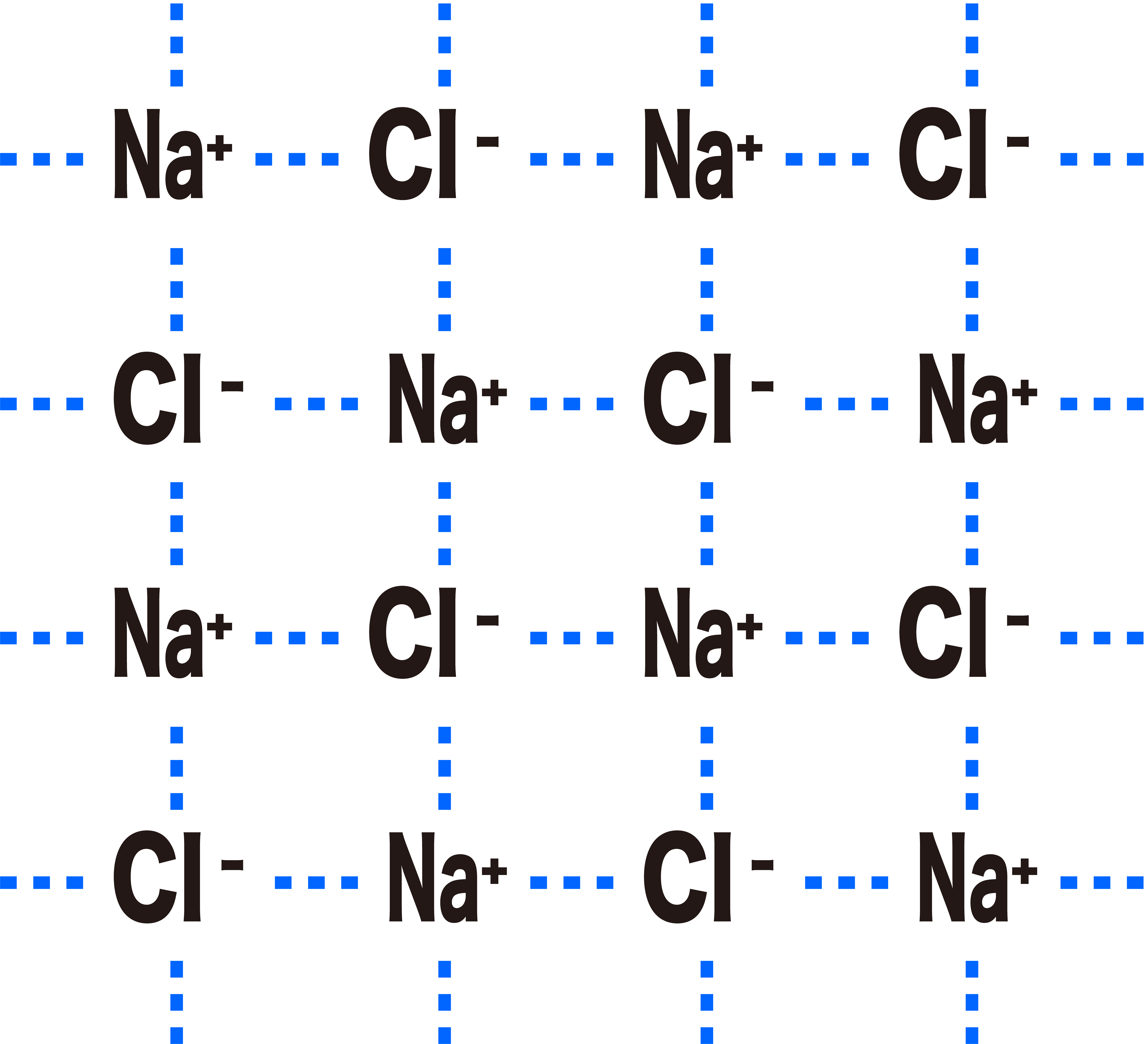
見分け方
- 分子をつくるものと分子をつくらないものの違いは「ここまでが1つの単位(分子)」という区切りの有無である。
- 分子は分子自体をつくっている結合と,分子と分子の間の結合(分子間力)の力の強さが違う。一方,分子をつくらない物質は全部の原子が同じ力で結合している。
- 塩化ナトリウムは,Naが1つとClが1つで1つの分子というわけではなく,イラストのようにNaとClが繰り返し並んでいる。したがって,これをどこで割ってもNaClの繰り返しの数が減るだけで,塩化ナトリウムという物質自体に変化はない。
単体と化合物の見分け方
- 高校化学・化学基礎における単体と化合物の見分け方について確認していく。
- まず,大前提として化合物は名前から化合物であると判断できるものが多い。例えば,酸化銀は酸素と銀,酸化鉄は酸素と鉄,塩化銅は塩素と銅からできている。
- しかし,このような方法で判断するためには,単体について,何が単体であるかという知識をある程度もっておく必要がある。したがって,高校化学・化学基礎でよく出る単体はあらかじめ覚えておくのが良い。
- 以下,高校化学・化学基礎で頻出の単体を一通り記載する。
| 金属単体 | アルカリ金属(リチウムLi、ナトリウムNa、カリウムK) ベリリウムBe マグネシウムMg アルカリ土類金属(カルシウムCa、バリウムBa) アルミニウムAl クロムCr マンガンMn 鉄Fe ニッケルNi 銅Cu 亜鉛Zn 銀Ag スズSn 金Au 鉛Pb |
| 非金属元素単体 | 水素H2 ホウ素B 炭素C 窒素N2 酸素O2 ケイ素Si リンP 硫黄S ハロゲン(フッ素F2、塩素Cl2、臭素Br2、ヨウ素I2) 貴ガス(ヘリウムHe、ネオンNe、アルゴンAr) |
- 単体は他にもたくさん存在するが,これらの単体は特によく出てくるのでこの機会に覚えておくようにしよう。
単体と化合物まとめ
この『単体と化合物(定義・違い・見分け方・一覧など)』のページで解説した内容をまとめる。
- 物質は大きく純物質と混合物に分けられる。
- 純物質はさらに単体と化合物に分けられる。
- 1種類の元素で構成される物質を単体,2種類以上の元素で構成される物質を化合物という。
- 単体はそれ以上分解することができない。化合物は加熱したり電流を流したりすることで単体まで分解することができる。
- 純物質は単体と化合物に分類することができるが,別の分類法として「分子をつくるもの」と「分子をつくらないもの」に分けることもある。
- 化合物は基本的に名前から分かる。単体は頻出のものを覚えておくべし。
演習問題
問1
酸素O2は単体・化合物・混合物のどれに分類されるか。
解答/解説:タップで表示
解答:単体
O2は,1種類の元素(O)で構成されているため,純物質の単体である。
問2
水H2Oは単体・化合物・混合物のどれに分類されるか。
解答/解説:タップで表示
解答:化合物
H2Oは,2種類の元素(HとO)で構成されているため,純物質の化合物である。
問3
グルコースC6H12O6は単体・化合物・混合物のどれに分類されるか。
解答/解説:タップで表示
解答:化合物
C6H12O6は,3種類の元素(CとHとO)で構成されているため,純物質の化合物である。
問4
海水は単体・化合物・混合物のどれに分類されるか。
解答/解説:タップで表示
解答:混合物
海水は,H2O・NaCl・MgCl2など,複数の純物質が混ざっているため,混合物である。













