MENU
純物質と混合物(定義・違い・見分け方・例など)
目次
はじめに
【プロ講師解説】このページでは『純物質と混合物(定義・違い・見分け方・例など)』について解説しています。
物質の分類
- 物質は大きく,純物質と混合物に分けられる。また,純物質はさらに,単体と化合物に分けられる。
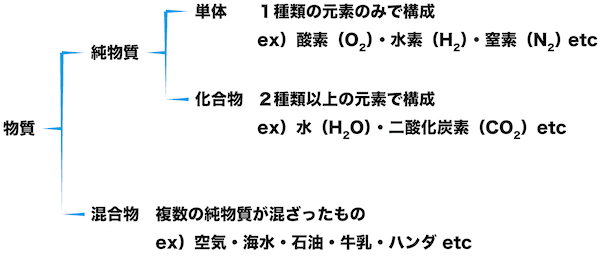
- このページでは,純物質と混合物について詳しく解説する。
単体と化合物については次のページを参照しましょう。
参考:単体と化合物(定義・違い・見分け方・一覧など)
混合物とは
- 空気や海水、岩石など2種類以上の物質が混ざってできた物質を混合物という。
- 私たちの身の回りに存在する多くの物質は、何種類かの物質が混ざり合った混合物として存在している。例えば、空気は窒素や酸素、アルゴンなどの混合物であり、海水は水や塩化ナトリウム、塩化マグネシウムなどの混合物である。
- 混合物には空気や海水のように複数の物質が均一に混ざったものと、岩石のように不均一に混ざったものがある。(例えば花崗岩では岩石を構成する”石英”や”雲母”などが含まれる組成が部分によって異なる)
- 混合物はろ過・蒸留・分留・クロマトグラフィーなどの”分離法”で複数の純物質に分けることができる。
純物質とは
- 1種類の物質からなる物質を純物質という。
- 例えば、酸素(O2)、窒素(N2)、水(H2O)、塩化ナトリウム(NaCl)などが純物質に当たる。
- 純物質はそれ以上分けることができない物質である。したがって、混合物のように分離法を使って分離を行うことはできない。
- また、純物質のうち1種類の元素のみで構成されている物質(O2 , N2など)を単体という。一方、純物質のうち2種類以上の元素で構成されている物質(H2O , NaClなど)を化合物という。
純物質と混合物の違い
- ここで、純物質と混合物の違いについてまとめる。
| 解説 | 例 | |
|---|---|---|
| 純物質 | 1種類の物質からなる | 酸素・窒素・水・エタノール |
| 混合物 | 2種類以上の物質からなる | 空気・海水・石油 |
- 入試では純物質と混合物を見分ける問題がよく出題される。見分け方を学ぶ前に、純物質と混合物の違いについて今一度確認しておこう。
- 空気や海水、石油など2種類以上の物質が混ざってできた物質を混合物という。一方、酸素や窒素、水、エタノールなど1種類の物質からなる物質を純物質という。
- つまり、それ以上分けることのできない物質を純物質といい、その純物質が複数混ざり合うことによってできる物質を混合物という。
- では、純物質と混合物をどのようにして見分ければいいのか、その見分け方について解説していく。
純物質と混合物の見分け方
- ある物質が純物質なのか混合物なのかを見分けるには、沸点に注目する。
- 純物質の沸点や融点は物質によって一定の値に決まっている。一方、混合物では、混合している物質の種類や割合によって値にばらつきが出てくる。
- ここでは、水とエタノールを例に説明する。
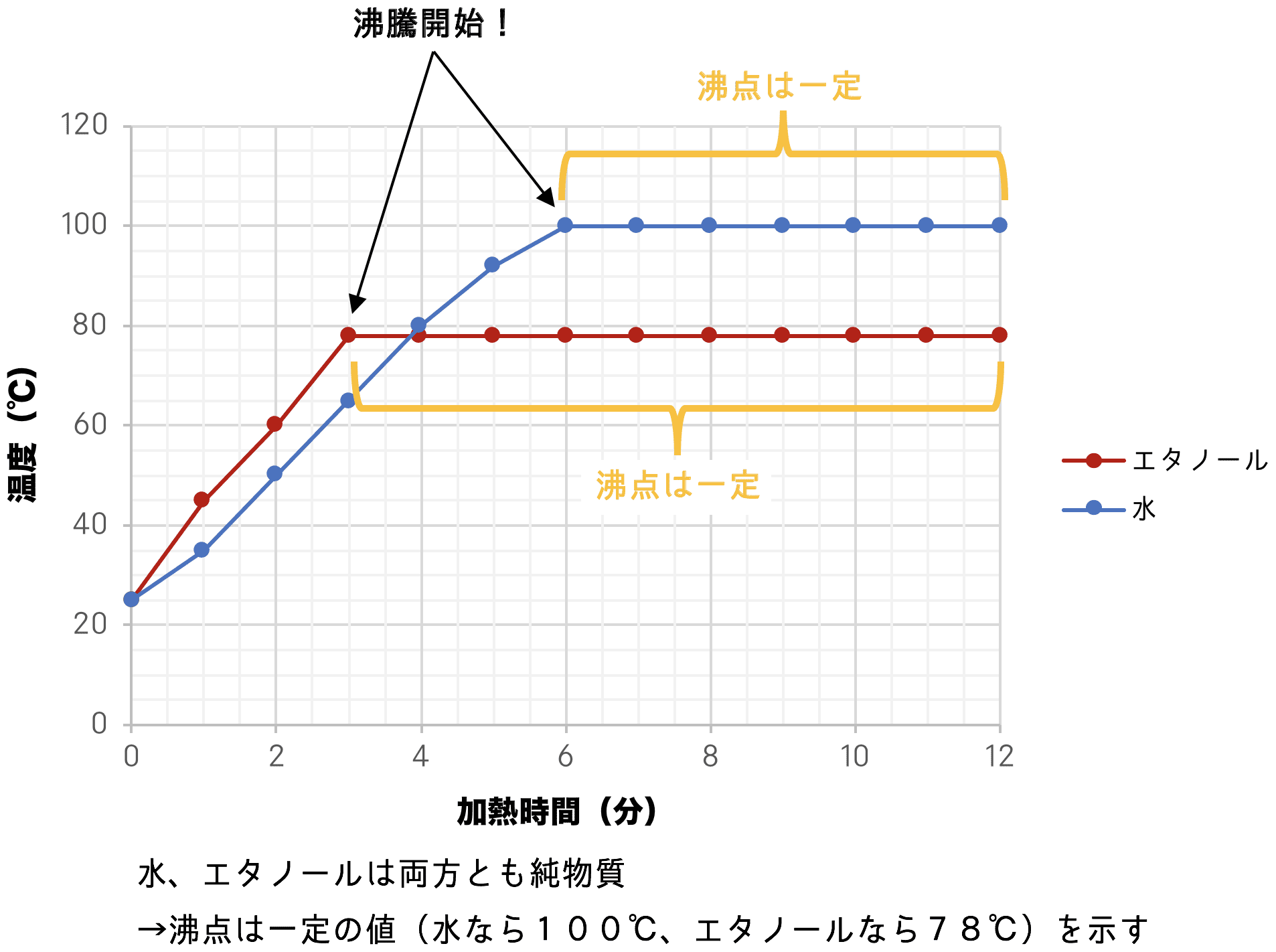
純物質の加熱
- 純物質である水とエタノールをそれぞれ加熱すると、次のように温度が変化し、水の沸点は100℃、エタノールの沸点は78℃を示す。
混合物の加熱
- 一方、水とエタノールの混合物を加熱すると、温度は次のように変化し、一定の沸点は示さない。
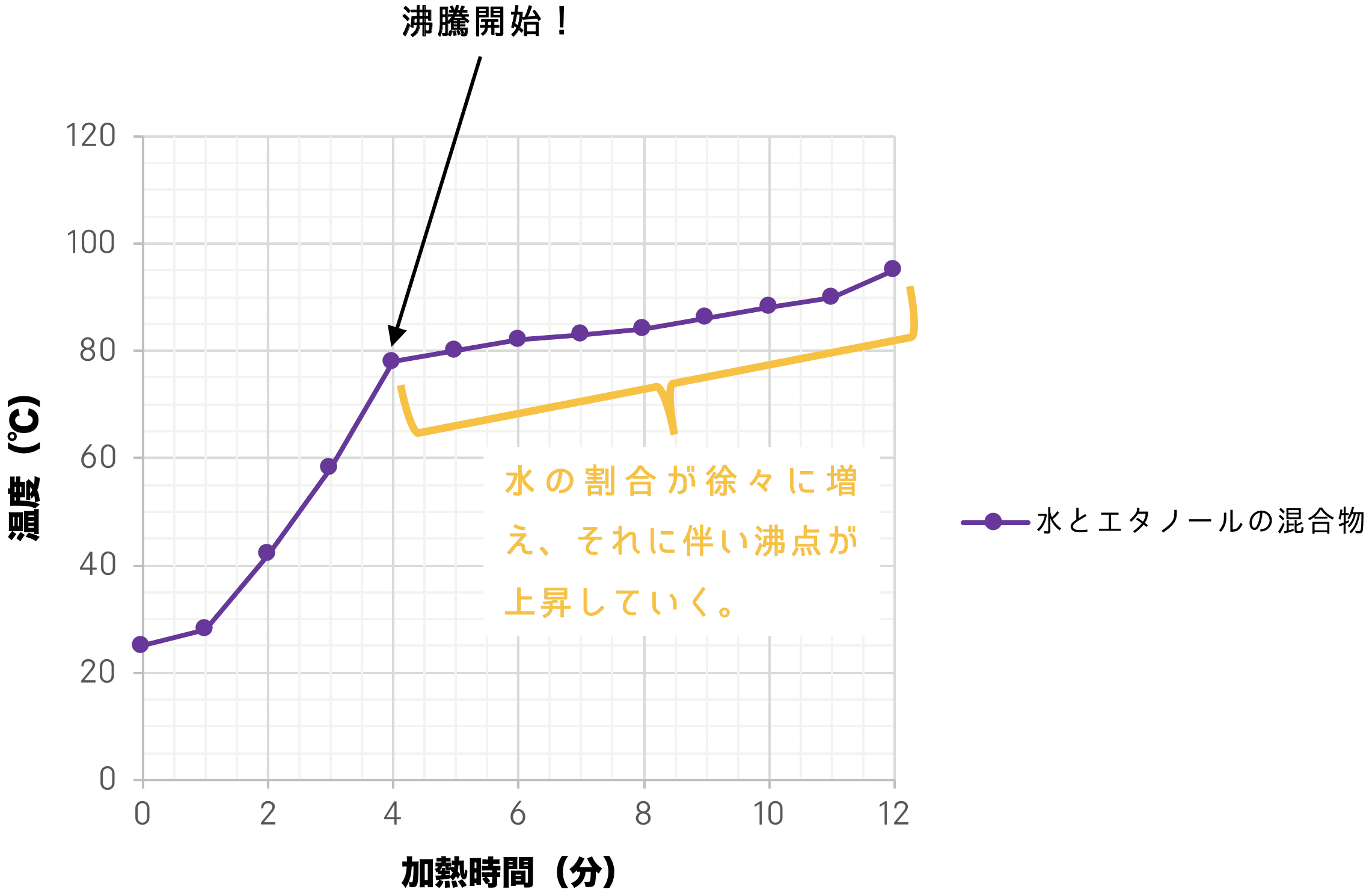
- このとき、沸点が一定の値にならない(徐々に上がっていく)のは、水よりも沸点が低いエタノールが先に沸騰し、混合物中の水の割合が徐々に高まっていくためである。
- このように、純物質は同一物質であれば沸点が一定なのに対し、混合物の沸点は(混合の割合が変われば沸点も変わるため)一定の値を示さない。
- よって、ある物質が純物質か混合物かを判断したい場合、沸点や融点が常に一定の値を示すかどうかを確認すれば良いということになる。沸点や融点が常に一定の値を示せば純物質、値に変化があれば混合物である。
混合物の分離
- 混合物はその状態に合わせた分離法を用いることで純物質に分離することができる。
- それぞれの分離法について詳しくは次のページを参考のこと。
純物質と混合物の違い/見分け方まとめ
この『純物質と混合物(定義・違い・見分け方・例など)』のページで解説した内容をまとめる。

- 物質は大きく純物質と混合物に分けられる。
- 純物質はさらに単体と化合物に分けられる。
- 1種類の物質からなる物質のことを純物質、2種類以上の物質が混ざってできた物質を混合物という。
- 混合物はその状態に合わせた分離法を用いることで複数の純物質に分離することができ、分離法にはろ過、蒸留、分留、再結晶、抽出、昇華法、クロマトグラフィーなどがある。純物質はそれ以上分けることができない。
- 純物質の沸点や融点は物質によって一定の値に決まっているが、混合物は混合している物質の種類や割合によって値にばらつきが出る。














