MENU
【分離法】蒸留と分留(違い・例・原理・図など)
目次
はじめに
【プロ講師解説】このページでは『【分離法】蒸留と分留(違い・例・原理・図など)』について解説しています。
蒸留とは
- 塩化ナトリウム水溶液を枝付きフラスコに入れ、加熱して沸騰させると塩化ナトリウム水溶液中の水だけが水蒸気となる。
- その水蒸気を管で繋がれたリービッヒ冷却器で冷却すると純粋な水(蒸留水)が得られる。
- このように、液体と固体の混合物を加熱し、液体だけを気化させ、それを冷却して純粋な液体として取り出す操作のことを蒸留という。
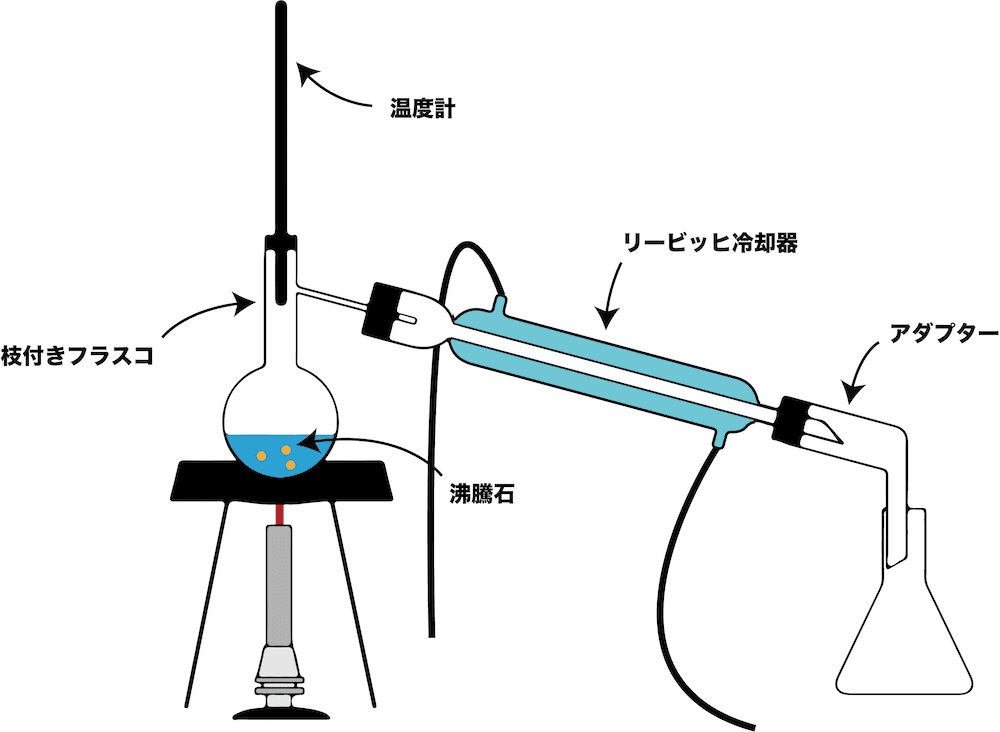
蒸留の注意点(入試頻出ポイント)
- 蒸留を行う上で注意すべき事項で、入試でもよく出題されるものをいくつか紹介する。
注意点1
枝付きフラスコに入れる溶液の量は1/2以下にする
- 枝付きフラスコに入れる溶液の量は1/2以下にする。
- これは、溶液を入れすぎると沸騰したときに液が枝側に入りリービッヒ冷却器の方に行ってしまうためである。
注意点2
枝付きフラスコを加熱する際は金網を敷く(水浴の場合もあり)
- 枝付きフラスコを加熱する際は金網を敷く必要がある。
- これは、枝付きフラスコを直接加熱するとフラスコが破損する可能性があるためである。
- 金網以外では、水を溜めた水浴に枝付きフラスコを浸けて加熱したり、水浴で加熱できない沸点が100℃以上の溶液は(水は100℃以上に加熱できないため)油浴や砂浴を使ったり、といった場合もある。
注意点3
枝付きフラスコを加熱する際は沸騰石を入れる
- 加熱する際は”沸騰石”とよばれる石を入れる必要がある。
- これは突沸(液体が沸点になっても沸騰せず、わずかに刺激を与えた時に急激に沸騰する現象:溶液が噴き出したり容器が破損する恐れがある)を防ぐためである。
注意点4
温度計は枝付きフラスコの枝元に来るようにする
- 発生した蒸気の温度を測るため枝付きフラスコに温度計を設置する必要があるが、このとき温度計の球部は「フラスコの枝元」にする。
- これは、温度計の球部を溶液につけると、(蒸気の温度ではなく)溶液の温度を測っていることになるためである。
注意点5
リービッヒ冷却器を通す冷却水は「下から上」に流す
- リービッヒ冷却器に通す冷却水は「下から上」に流す。
- これは、上から下に流すと水が溜まりづらく冷却効率が悪くなってしまうためである。
注意点6
アダプターと受け器は密閉しない
- アダプターと受け器は密閉してはならない。
- アダプターと受け器をゴム栓やガラス栓で密閉して蒸留すると装置内の圧力が上がり器具を破損する可能性がある。(ただし、外部から異物が混入するといけないのでアルミホイル等を被せて受け器の口を軽く塞ぐ必要がある)
注意点7
蒸留の始めと終わりに出る液体は捨てる
- 蒸留の始めの液と終わりの液は捨てる必要がある。
- これは、始めの液と終わりの液は不純物を含む可能性が高いためである。














