MENU
タンパク質の一次構造・二次構造(αヘリックス/βシート)・三次構造・四次構造
目次
はじめに
【プロ講師解説】このページでは『タンパク質の一次構造・二次構造(αヘリックス/βシート)・三次構造・四次構造』について解説しています。
タンパク質の構造
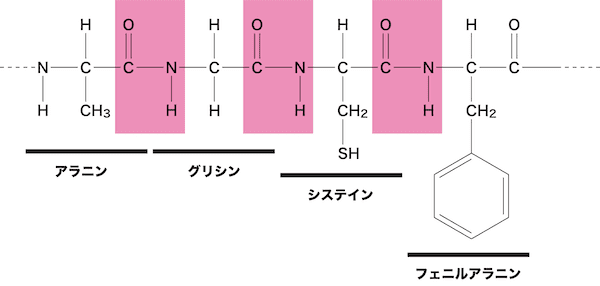
- タンパク質は何種類かのアミノ酸が様々な順序で数多く縮合した巨大な分子であり、立体的に非常に複雑な構造をしている。
- タンパク質の構造には一次構造、二次構造、三次構造、四次構造の4種類が存在する。
- これらのうち、最も簡単な構造が一次構造、最も複雑な構造が四次構造である。
- このページでは、一次構造〜四次構造について、順番に解説する。
二次構造
- ペプチド鎖において、近くにあるペプチド結合同士が水素結合を形成して、局部的に一定な構造を取る。これをタンパク質の二次構造という。
- 二次構造にはα-ヘリックス構造とβ-シート構造の2種類が存在する。
α-ヘリックス構造
- タンパク質のペプチド鎖は多くの場合、右巻きらせん構造をとる。このらせん構造をα-ヘリックス構造という。
- 一巻き3.6個のアミノ酸単位からなり、4番目ごとのアミノ酸単位のN-HとC=Oとの間で水素結合を形成して安定化している。
- α-ヘリックス構造では、全てのN-HとC=Oが水素結合するために非常に安定となるため、タンパク質はこの構造を取りやすい。
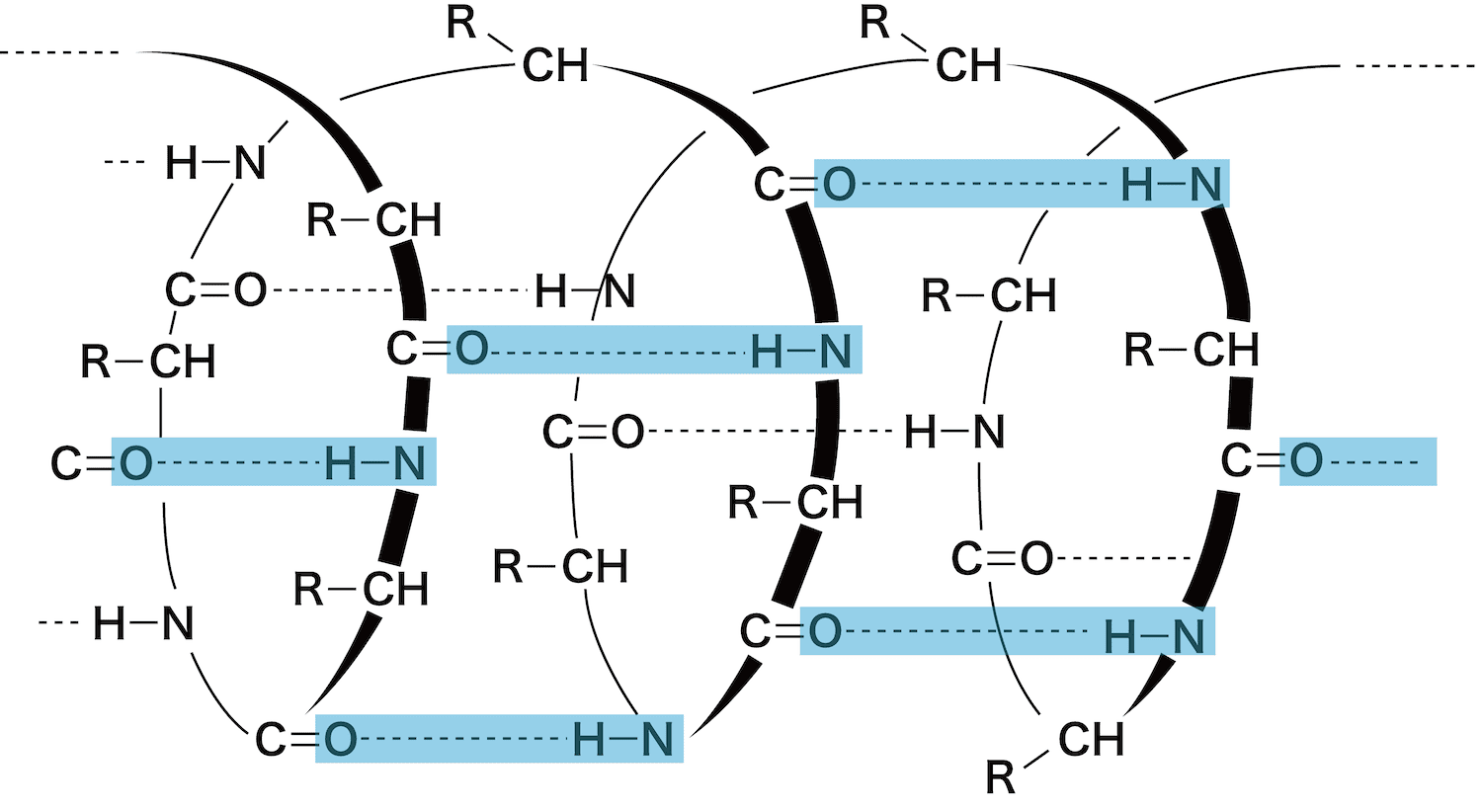
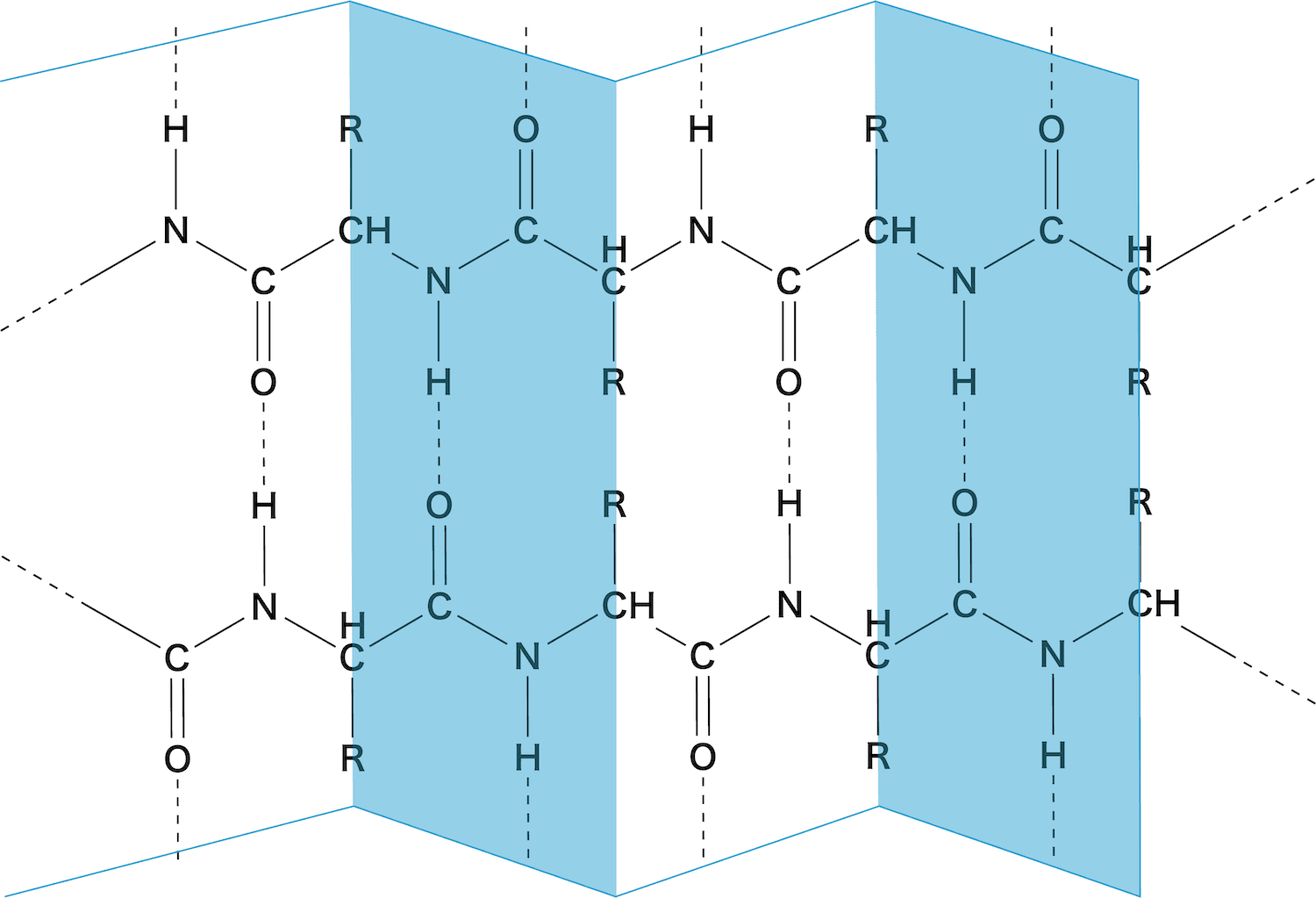
β-シート構造
- ペプチド鎖が平行(又は逆平行)に並んで配置され、また隣接した分子が水素結合で結ばれた結果、波状のシート構造になる。このシート構造をβ-シート構造という。
- 絹のフィブロインや羊毛中のケラチンなどがこの構造をとる。
三次構造
- ポリペプチド鎖が各所でα-ヘリックス構造、β-シート構造などの二次構造を形成し、それらが不規則なペプチド鎖で繋がっている場合、比較的離れたアミノ酸単位同士の「相互作用」により全体が折りたたまれた一定の構造をとるようになる。このような三次元的な空間配置まで含めた分子鎖全体の構造を三次構造という。
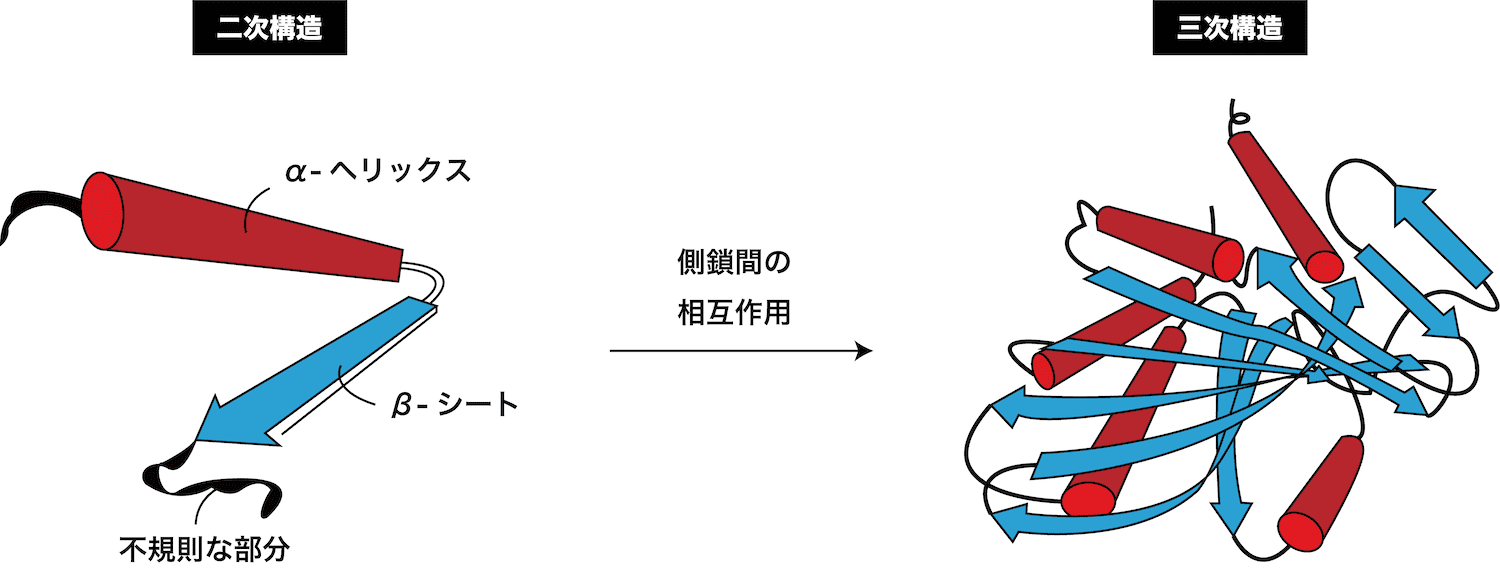
- 特定の一次構造をもつポリペプチド鎖がとり得る構造は無限に思えるかもしれないが、実際は1つの一次構造から生じる三次構造は1種類しかない。
- これは、ペプチド鎖の各部位における一次構造がそれぞれの部分でどのような二次構造をとるかを決め、さらにその二次構造における側鎖の分布をも決定するためである。
- 折りたたまれた三次構造を安定化させている”結合”は、ジスルフィド結合(S-S結合)・イオン結合・水素結合・疎水結合の4種類存在する。これらのうち最も強い結合はジスルフィド結合である。
ジスルフィド結合(S-S結合)
- タンパク質を構成しているアミノ酸にシステインが含まれるとき、その側鎖Rには-S-Hが存在する。
- -S-H同士は酸化還元反応によりジスルフィド結合(-S-S-)を形成することができる。
- この結合は、三次構造をつくる結合の中で唯一の共有結合であり、最も強い結合である。
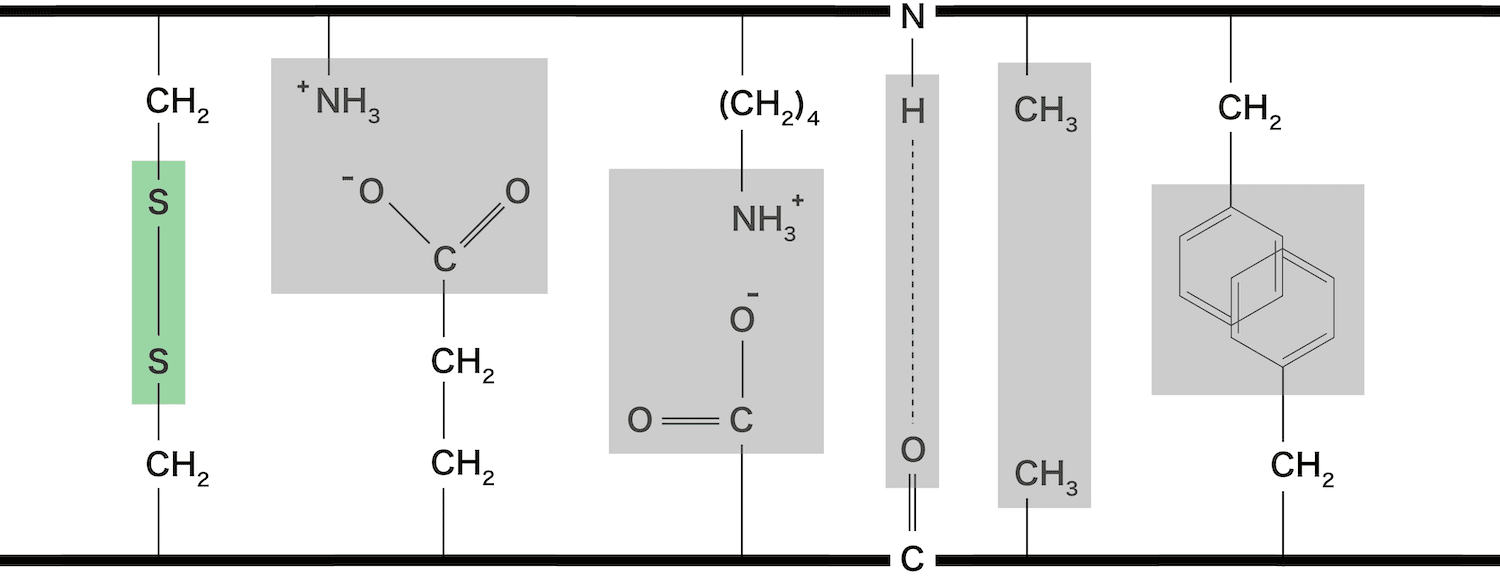
イオン結合
- ポリペプチド鎖の末端や構成アミノ酸の側鎖Rにはペプチド結合に使われないフリーな-COOHと-NH2が存在する。
- これらはpHにより、-COOーや-NH3+に変化し得るので、イオン結合によりポリペプチド鎖に含まれる他の官能基と結びつくことができる。
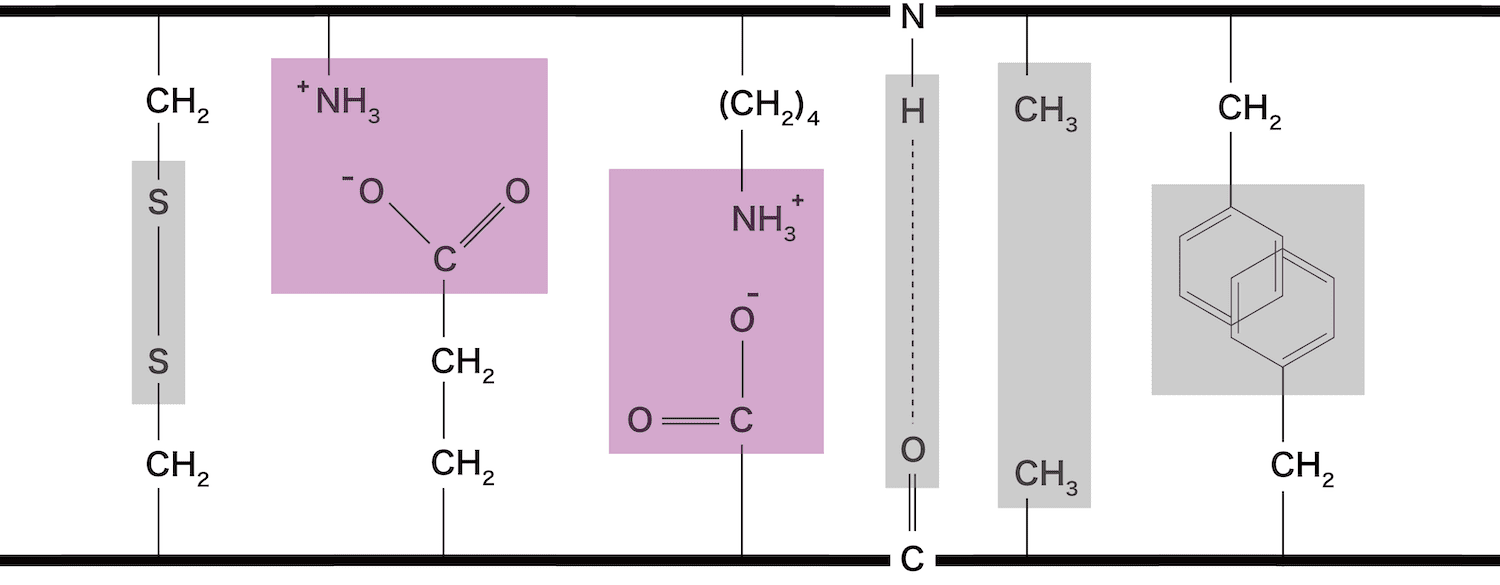
水素結合
- ペプチド結合にあるC=OやN-H、側鎖にある-OHや-COOHなどの間では、分子間力の一種である水素結合が形成されることがある。
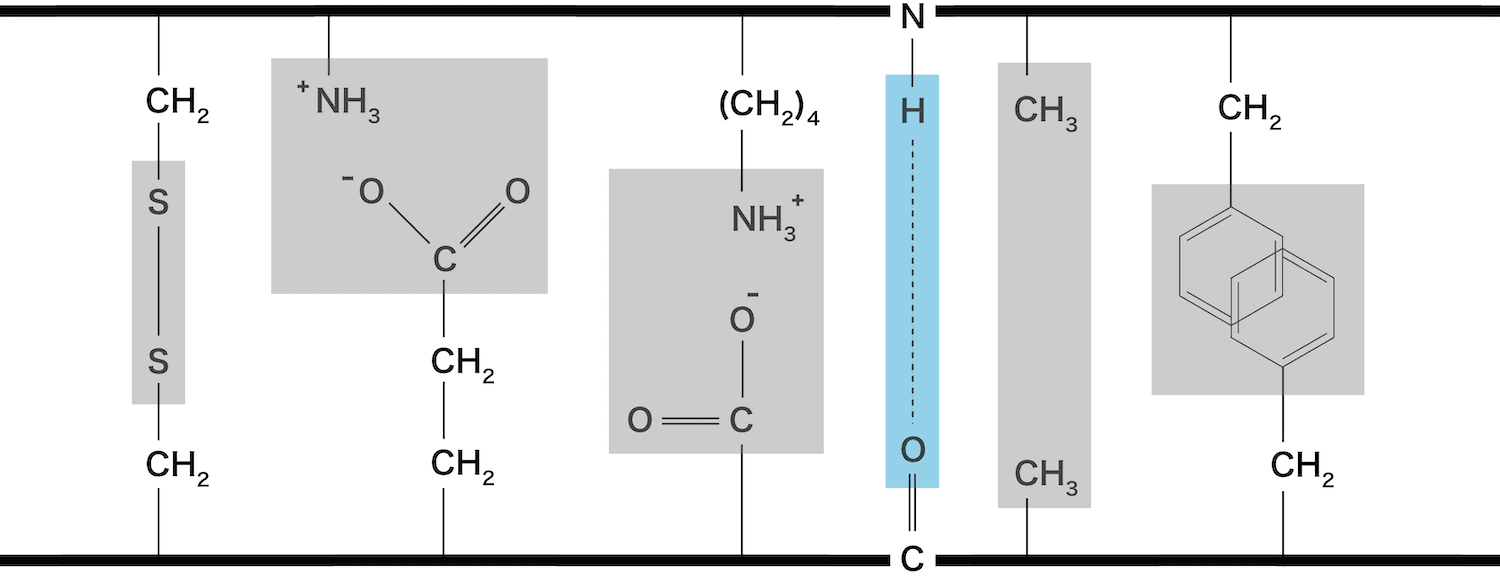
参考:分子間力(水素結合・ファンデルワールス力・沸点のグラフなど)
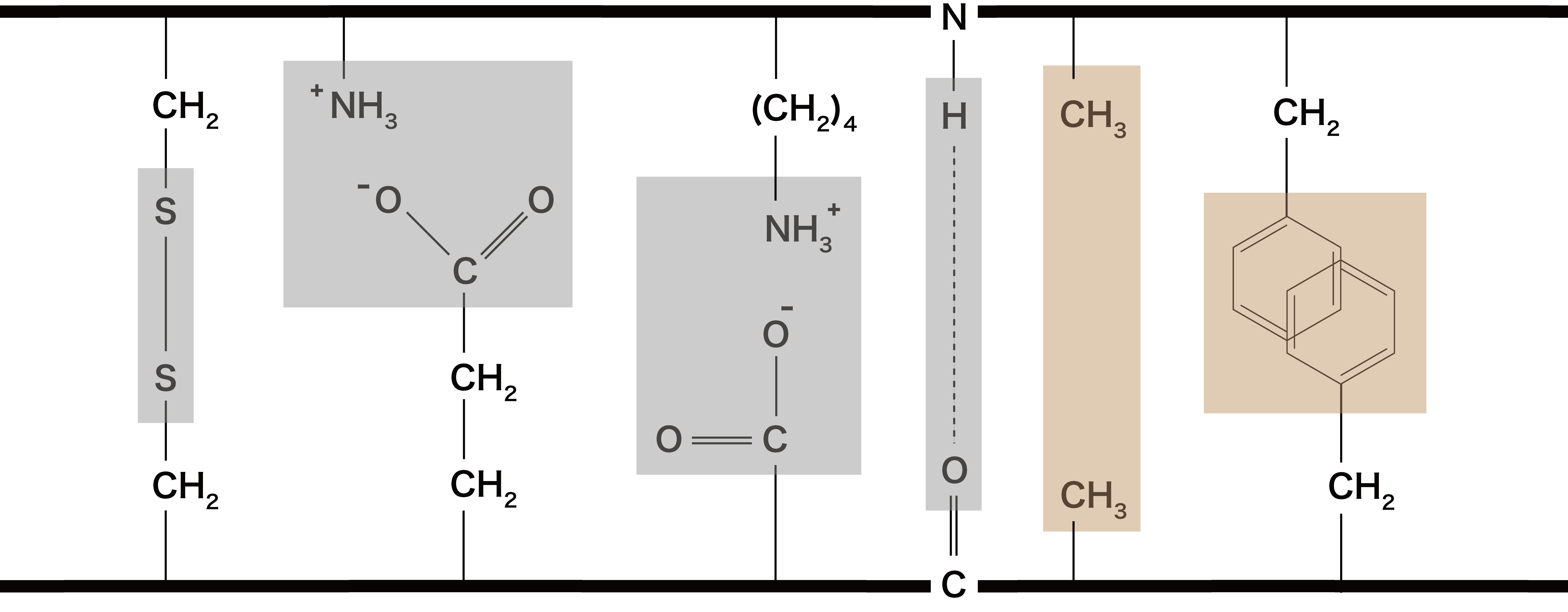
疎水結合(疎水性相互作用)
- 側鎖にある無極性で疎水性の炭化水素基やベンゼン環などは、水との接触ができる限り少なくなるように連結する。これを疎水結合という。
- 疏水結合は、疎水基の数が多くなるほど強力な結合となる。
四次構造
- 三次構造を形成したポリペプチド鎖が複数個会合して、1つの分子になる場合がある。このような分子内でのポリペプチド鎖の配列を四次構造という。
- 四次構造を構成する各ポリペプチド鎖をサブユニットという。
- 四次構造の具体例としてはヘモグロビンが挙げられる。
- ヘモグロビンは4つのサブユニット(α鎖2つ・β鎖2つ)からなり、それらの立体配座を変えることによりO2の結合力を調節している(酸素分圧が大きい肺ではO2との結合力が高まり、酸素分圧の低い組織系では結合力が弱まりO2を放出しやすくなる)。