MENU
アルカン(一般式の作り方・一覧・命名法・製法・性質・置換反応など)
はじめに
【プロ講師解説】このページでは『アルカン(一般式の作り方・一覧・命名法・製法・性質・置換反応など)』について解説しています。
アルカンの一般式の作り方
- アルカンの一般式CnH2n+2の作り方は次の通りである。
●STEP1
炭素C原子の数をn個とする。
●STEP2
Cの上下にHが1個ずつ付いているので、水素H原子の数を2n個とする。
●STEP3
両端のCにはさらにHが1個ずつ付いているので、Hの数を+2する。
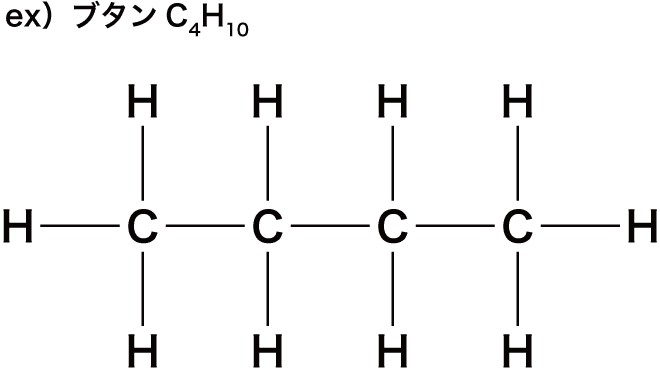
まずは、炭素C原子の数をn個とする。
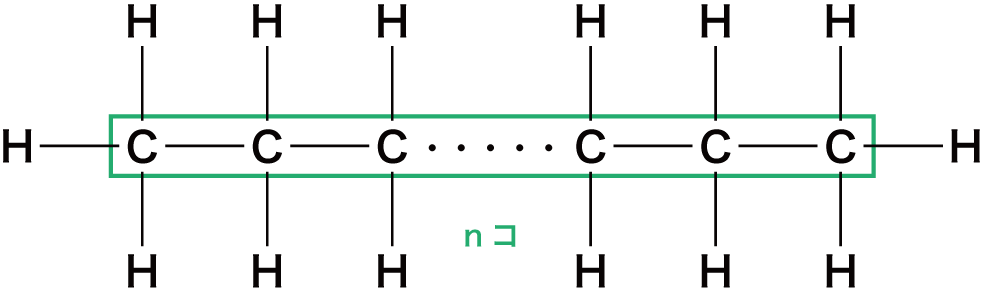
次に、Cの上下にHが1個ずつ付いているので、水素H原子の数を2n個とする。
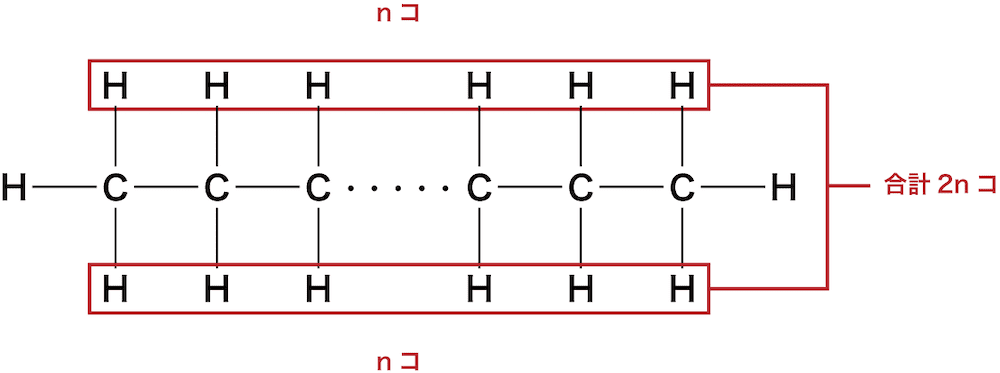
この時点で一般式はCnH2nとなる。
最後に、両端のCにはさらにHが1個ずつ付いているので、Hの数を+2する。
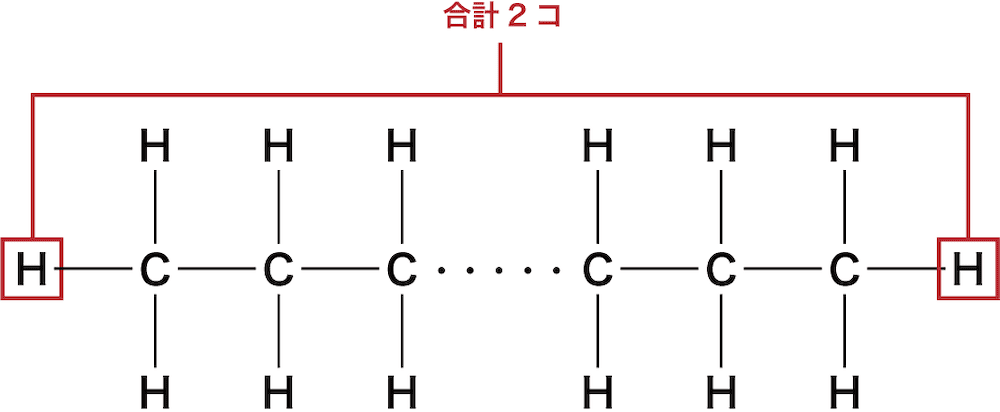
以上より、アルカンの一般式はCnH2n+2となる。
アルカン一覧
- 代表的なアルカンを次に示す。
| n(炭素数) | 化学式 | 名称 |
|---|---|---|
| 1 | CH4 | メタン |
| 2 | C2H6 | エタン |
| 3 | C3H8 | プロパン |
| 4 | C4H10 | ブタン |
| 5 | C5H12 | ペンタン |
| 6 | C6H14 | ヘキサン |
| 7 | C7H16 | ヘプタン |
| 8 | C8H18 | オクタン |
| 9 | C9H20 | ノナン |
| 10 | C10H22 | デカン |
アルカンの命名法
- アルカンの命名は次の手順で行う。
●STEP1
最も長い炭素鎖の炭素数を数えて、アルカン名のベースを決定する
●STEP2
枝分かれや官能基がある場合、枝分かれしている炭素の番号ができるだけ小さくなるように主鎖の炭素に番号をつける
●STEP3
枝分かれしている炭素の番号と置換基名をベースの前にくっつける
- ここでは次のアルカンを例に命名の手順を確認する。
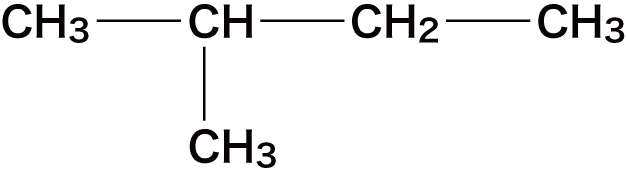
まずは、最も長い炭素鎖(主鎖)の炭素数を数えて、アルカン名のベースを決定する。(枝分かれしている短い炭素鎖は側鎖という)
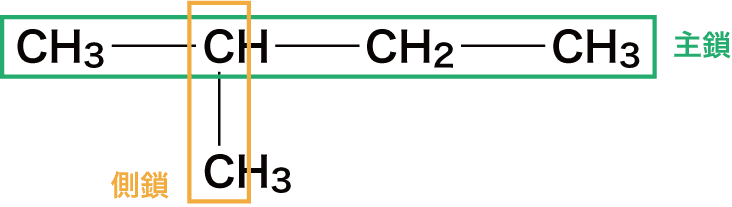
今回の場合、主鎖の炭素数は4つなので、アルカン名のベースは”ブタン”となる。
次に、枝分かれや官能基がある場合、枝分かれしている炭素の番号ができるだけ小さくなるように主鎖の炭素に番号をつける。
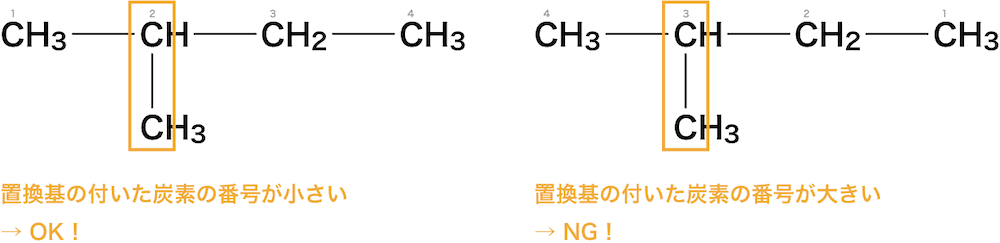
最後に、枝分かれしている炭素の番号と置換基名をベースの前にくっつける。
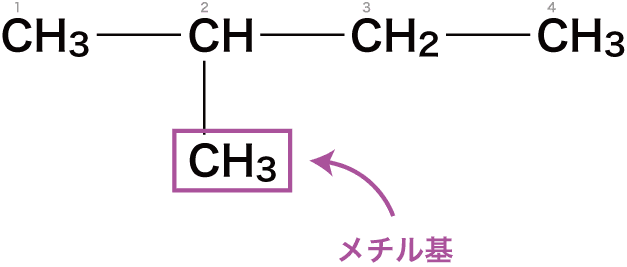
今回の場合は、2番目の炭素にメチル基がくっついているので2-メチル-ブタンとなる。
アルカンの製法
- 代表的なアルカンの製法は次の通りである。
●工業的製法
天然ガスや石油を分留する。
●実験室的製法
酢酸ナトリウムとソーダ石灰の混合物を加熱する。
- アルカンの製法のうち、頻出なのは”メタンの製法”である。
- したがって、ここではメタンの工業的製法・実験室的製法について解説する。
工業的製法
- メタンを工業的につくる際は、天然ガスや石油を分留する。
実験室的製法
- メタンを実験室内でつくる際は、酢酸ナトリウムCH3COONaとソーダ石灰(CaO+NaOH)の混合物を加熱する。
\[ \mathrm{CH_{3}COONa + NaOH → Na_{2}CO_{3} + CH_{4}} \]
アルカンの性質
- 遷移元素には次のような特徴がある。
●アルカンの性質
- 無極性 or 極性が非常に小さい。
- 直鎖アルカンでは分子量の増加に伴い沸点が高くなる。
- 水には溶けないが無極性溶媒にはよく溶ける。
❶ 無極性 or 極性が非常に小さい。
- アルカンはC-H結合、C-C結合からなるため、無極性又は極性の非常に小さな分子である。
❷ 直鎖アルカンでは分子量の増加に伴い沸点が高くなる。
- 直鎖状のアルカンでは、分子量が大きくなるにしたがってファンデルワールス力が大きくなり、沸点が高くなる。
参考:分子間力(水素結合・ファンデルワールス力・沸点のグラフなど)
❸ 水には溶けないが無極性溶媒にはよく溶ける。
- アルカンは無極性のため、極性溶媒の水には溶けないが無極性溶媒の有機溶媒(ベンゼンやジエチルエーテルなど)にはよく溶ける。
参考:極性溶媒と無極性溶媒
アルカンのように共通の一般式で表され、分子式が-CH2ずつ違う化合物グループを同族体といいます。沸点や融点は異なっていても同族体の化学的性質はよく似ています。
アルカンの反応①(燃焼反応)
- C-H結合やC-C結合は結合エネルギーが大きく、原子同士が強く結びついている。また、アルカンは極性をもたないか非常に小さいため、反応性が小さく安定している。
- ただし、十分な空気とともに加熱すると結合が切れ、酸素と結びついて二酸化炭素CO2と水H2Oに変化する。また、このとき大きな燃焼熱が生じる。
\[ \mathrm{C_{n}H_{2n+2}+\frac{ 3n+1 }{ 2 }O_{2}\overset{加熱}{\longrightarrow}nCO_{2}+(n+1)H_{2}O}~~~ΔH = x\mathrm{kJ} \]
ex)メタンCH3の燃焼反応
- メタンCH4の燃焼反応(燃焼熱:890kJ/mol)の熱化学反応式は次の通りである。
\[ \mathrm{CH_{4}(気)+2O_{2}(気)\longrightarrow CO_{2}(気)+2H_{2}O(液)}~~~ΔH = -890\mathrm{kJ} \]
アルカンの反応②(置換反応)
- メタンCH4と塩素Cl2の混合気体に光を照射(または加熱)すると激しく反応し、C-H結合がC-Cl結合に変化する。
- メタンCH4の塩素Cl2による置換反応について、次の手順で解説する。
●STEP1
メタンCH4に結合している水素H原子のうち、1つが塩素Cl原子に置き換わる
→ クロロメタンCH3Clが生成
●STEP2
残っている3つのHのうち、1つがClに置き換わる
→ ジクロロメタンCH2Cl2が生成
●STEP3
残っている2つのHのうち、1つがClに置き換わる
→ トリクロロメタンCHCl3が生成
●STEP4
残っている1つのHがClに置き換わる
→ テトラクロロメタンCCl4が生成
→ クロロメタンCH3Clが生成
まずは、メタンCH4に結合している水素H原子のうち、1つが塩素Cl原子に置き換わる。
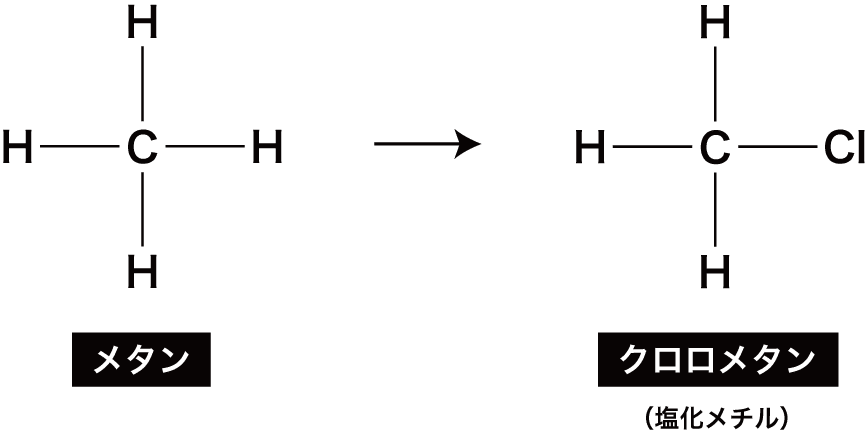
このときできる化合物をクロロメタンという。
クロロメタンは慣用的に塩化メチルともよばれる。
”クロロ”は”Cl”のことを表しています。また、慣用名とはルールに基づかない特殊な名称で、一般に暗記する必要があります。
→ ジクロロメタンCH2Cl2が生成
次に、残っている3つのHのうち、1つがClに置き換わる。
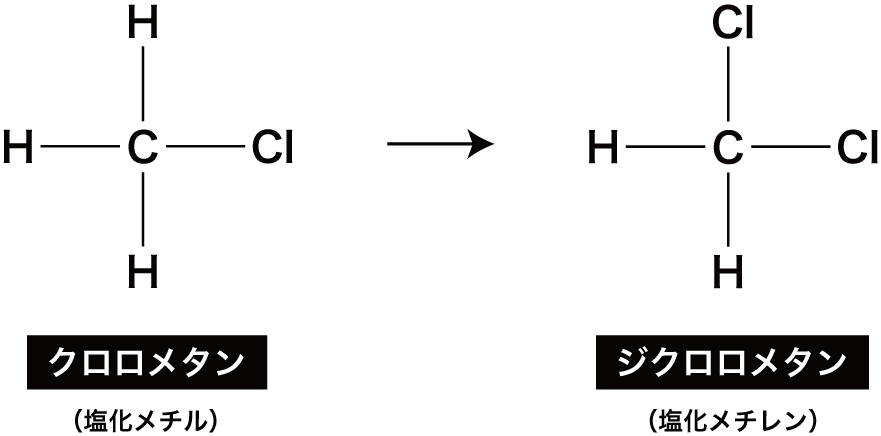
このときできる化合物はジクロロメタンという。
ジクロロメタンの慣用名は塩化メチレンである。
“ジ”というのはギリシャ語で”2″を表すので、”ジクロロ”で「2個のClがついている」という意味になります。
1→モノ
2→ジ
3→トリ
4→テトラ
5→ペンタ
6→ヘキサ
→ トリクロロメタンCHCl3が生成
次に、残っている2つのHのうち、1つがClに置き換わる。
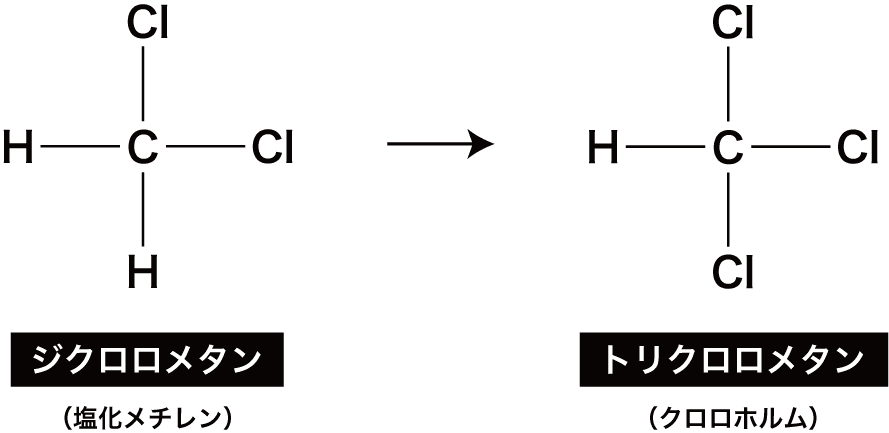
このときできる化合物は(Clが3個なので)トリクロロメタンという。
慣用的にはクロロホルムとよばれ、かつて麻酔薬として用いられた。
→ テトラクロロメタンCCl4が生成
最後に、残っている1つのHがClに置き換わる。
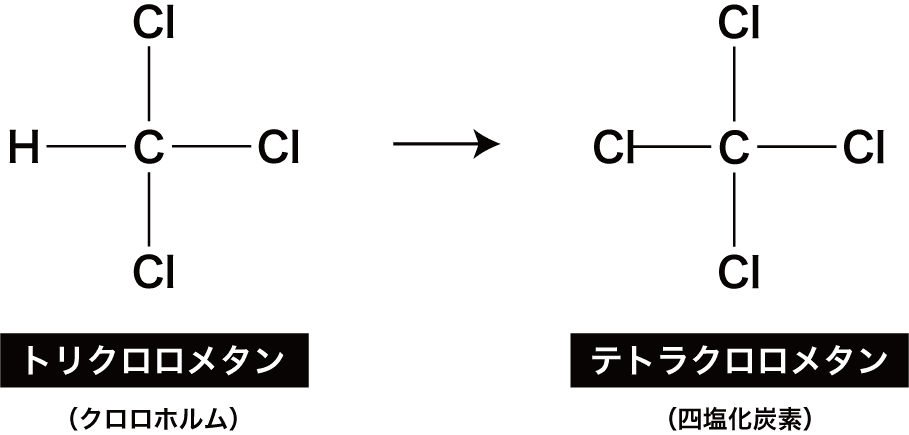
このときできる化合物はテトラクロロメタンという。
テトラクロロメタンの慣用名は四塩化炭素である。
シクロアルカン
- アルカンは”鎖式”飽和炭化水素だが、”環状”飽和炭化水素はシクロアルカンとよばれる。
- シクロアルカンは、アルカンから2個のHを取って繋げることでできる。
ex)シクロヘキサンC6H12
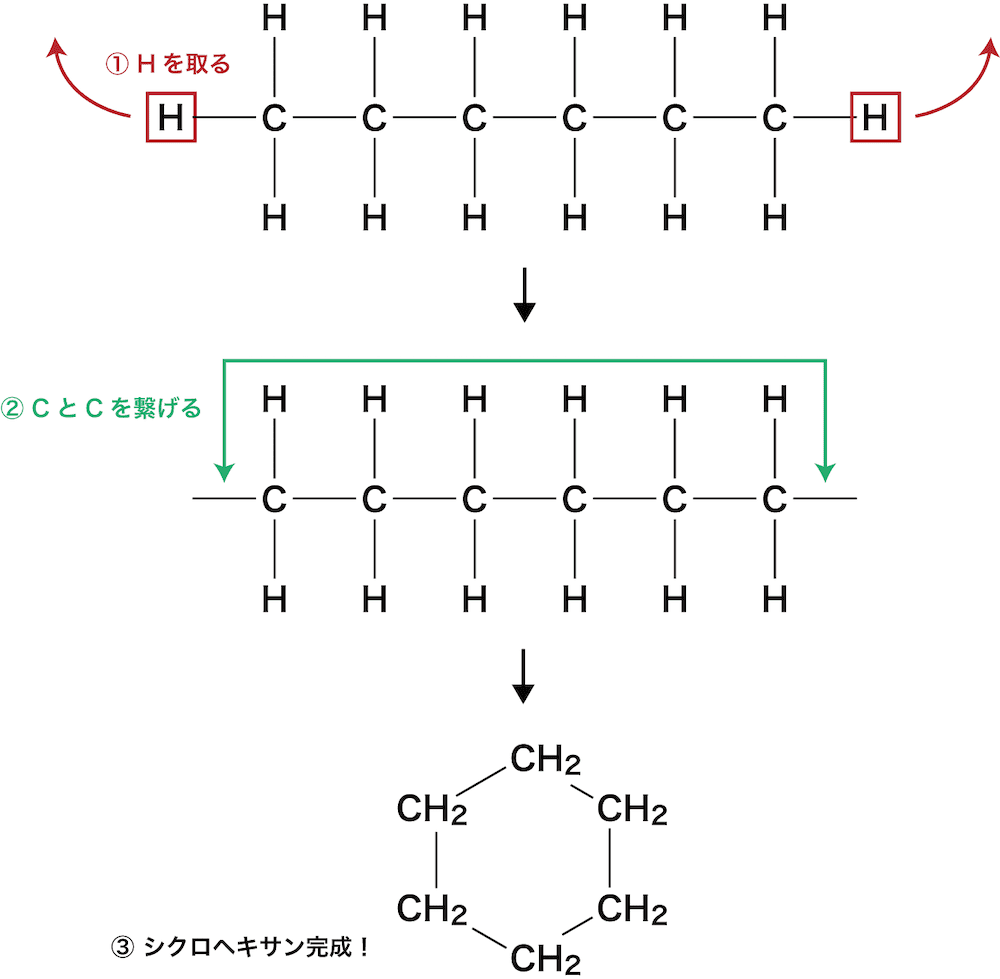
シクロアルカンは分子式CnH2nで表され、命名の際は環をつくる炭素数に対応するアルカン名の前に、環を意味する”シクロ”をつける。