MENU
極性溶媒と無極性溶媒
目次
はじめに
【プロ講師解説】このページでは『極性溶媒と無極性溶媒』について解説しています。
極性溶媒とは
- 極性をもつ分子(=極性分子)からなる溶媒を極性溶媒という。
- 極性溶媒の例としては、水H2OやエタノールC2H5OHなどが挙げられる。
無極性溶媒とは
- 極性をもたない分子(=無極性分子)からなる溶媒を無極性溶媒という。
- 無極性溶媒の例としては、ベンゼンC6H6やヘキサンC6H14、四塩化炭素CCl4などが挙げられる。
極性溶媒・無極性溶媒に溶けやすい物質
●極性溶媒
極性分子が溶けやすい
●無極性溶媒
無極性分子が溶けやすい
- 極性溶媒には極性分子が溶けやすく、無極性溶媒には無極性分子が溶けやすい。つまり、似た者同士はよく溶ける。以降この原理について解説する。
- 極性溶媒(例えば水)中に存在する分子は極性分子であり、分子内の一部はややプラスに、一部はややマイナスに電荷が偏っている。
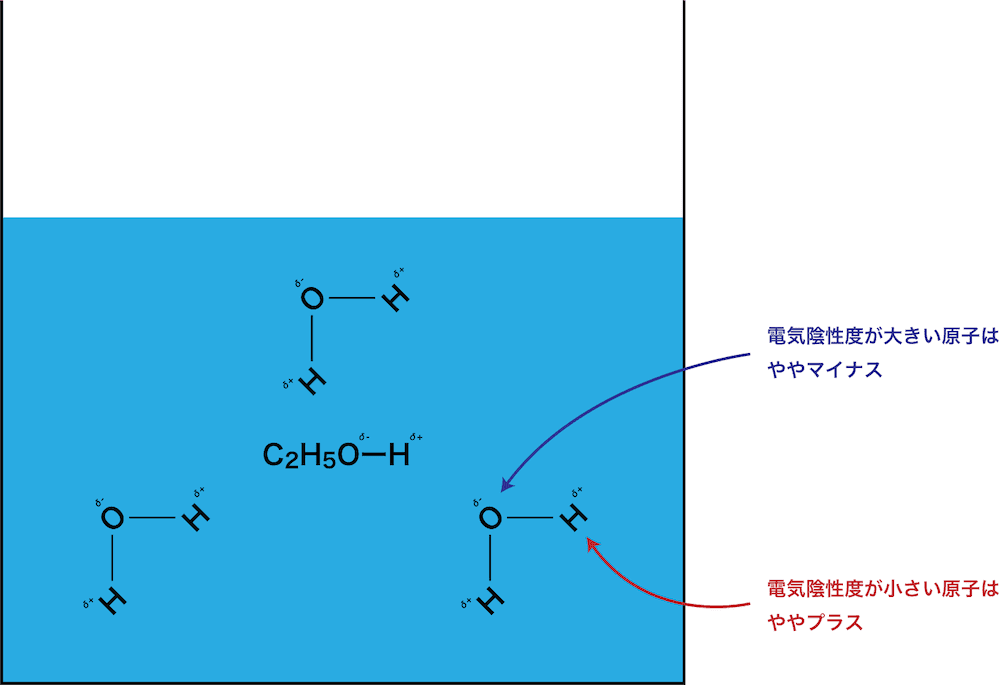
- ここに、極性分子であるエタノールを入れると、お互いの電荷がプラスの所とマイナスの所が引き合って、緩い結合(今回は水素結合を形成する原子の組み合わせなので水素結合)が形成される。
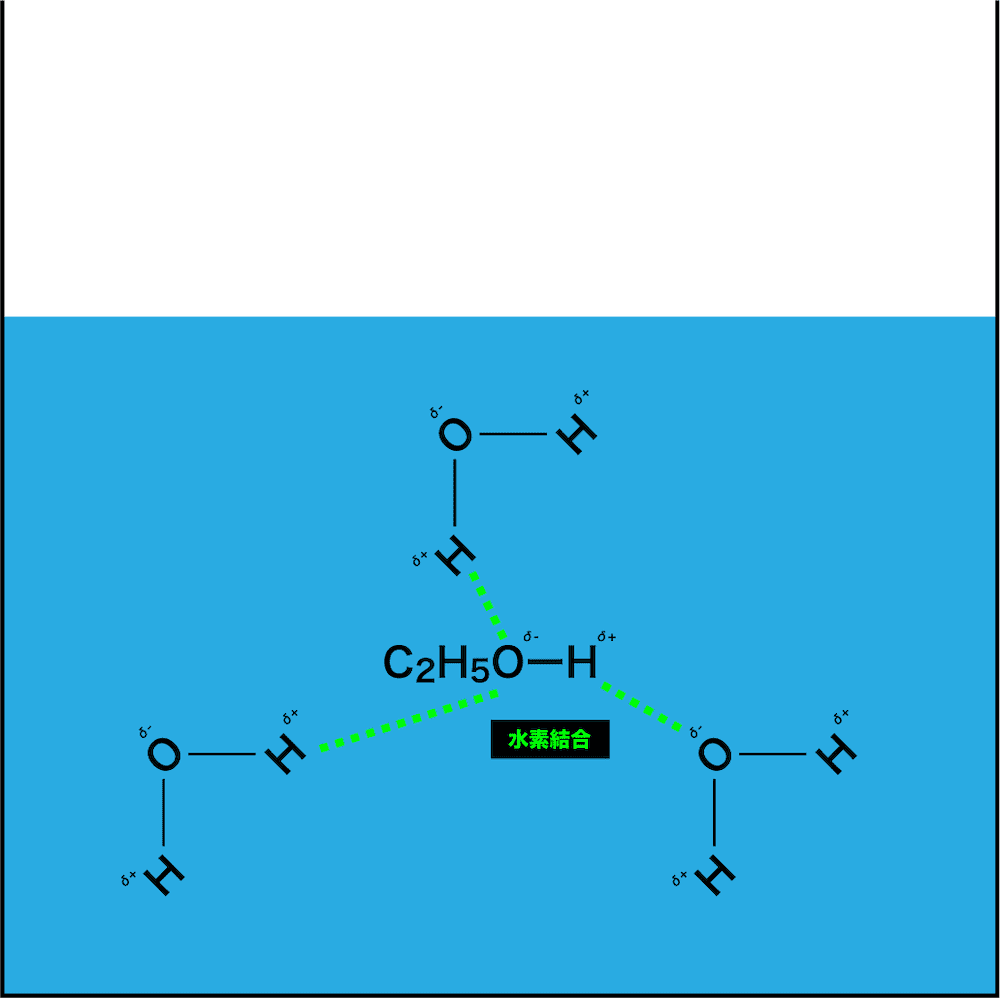
- その結果、エタノール分子が水分子に囲まれて他のエタノール分子と引き離されることになるので、いわゆる“水和した(=溶けた)”状態になる。
- ちなみに、水和した極性分子は水和分子とよばれる。
参考:分子間力(水素結合・ファンデルワールス力・沸点のグラフなど)
参考:【図解】水和・水和物(定義・例・原理・仕組みなど)
極性溶媒とイオン結晶
- 陽イオンと陰イオンにより形成される結晶をイオン結晶という。
- イオン結晶として最も有名なのは塩化ナトリウムNaClである。
NaClは水の中で次のように電離している。
\[ \mathrm{NaCl → Na^{+}+Cl^{-} }\]
- 電離により生じるナトリウムイオンNa+と塩化物イオンClーの周りには、それぞれ水分子のδー部分とδ+部分が近づいてくる。
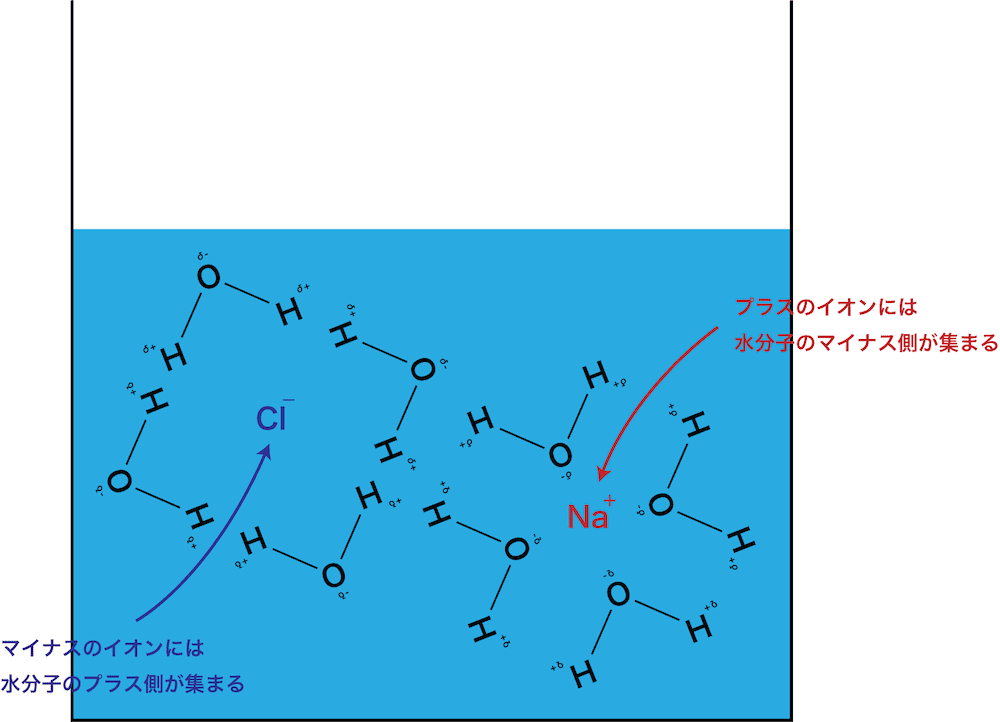
- その結果、イオンが水分子に取り囲まれ、他のイオンと引き離される。(=水和=溶解)
- ちなみに、水和したイオンは水和イオンとよばれる。
参考:【図解】水和・水和物(定義・例・原理・仕組みなど)
参考:陽イオン・陰イオン(違い・一覧・イオン式・価数・多原子イオンなど)
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
極性をもつ分子(=極性分子)からなる溶媒を【1】という。
解答/解説:タップで表示
解答:【1】極性溶媒
極性をもつ分子(=極性分子)からなる溶媒を極性溶媒という。
問2
問1で答えた溶媒の具体例を2つ挙げよ。
解答/解説:タップで表示
解答:水・エタノール
極性溶媒の例としては、水H2OやエタノールC2H5OHなどが挙げられる。
問3
極性をもたない分子(=無極性分子)からなる溶媒を【1】という。
解答/解説:タップで表示
解答:【1】無極性溶媒
極性をもたない分子(=無極性分子)からなる溶媒を無極性溶媒という。
問4
問3で答えた溶媒の具体例を2つ挙げよ。
解答/解説:タップで表示
解答:ベンゼン・四塩化炭素
無極性溶媒の例としては、ベンゼンC6H6やヘキサンC6H14、四塩化炭素CCl4などが挙げられる。
問5
分子やイオンが水分子に取り囲まれ、”溶ける”ことを【1】するという。
解答/解説:タップで表示
解答:【1】水和
分子やイオンが水分子に取り囲まれて”溶ける”ことを水和するという。
問6
水和した分子を【1】という。
解答/解説:タップで表示
解答:【1】水和分子
水和した分子を水和分子という。
問7
水和したイオンを【1】という。
解答/解説:タップで表示
解答:【1】水和イオン
水和したイオンを水和イオンという。














