MENU
元素分析(装置の原理・計算問題の解法など)
はじめに
【プロ講師解説】このページでは『元素分析(装置の原理・計算問題の解法など)』について解説しています。
元素分析の仕組み・流れ
- 化合物中の元素の組成を調べて、組成式を決定する操作を元素分析という。
- 元素分析は次のような装置を用いて行われる。
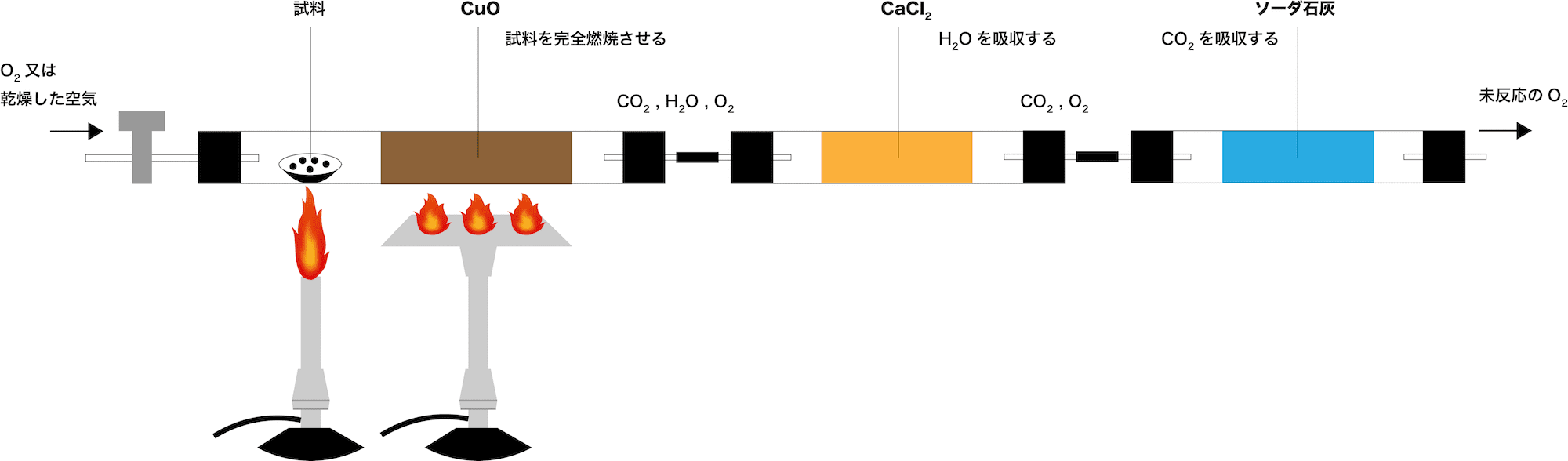
- この装置を使った元素分析の仕組みと流れについて、次の手順で解説する。
●STEP1
O2又は乾燥した空気を吹き込みながら試料(有機物:CxHyOz)を燃焼させる
●STEP2
気体(CO2・H2O・O2)がCuOを通過する
→試料の不完全燃焼を防ぐ
●STEP3
気体(CO2・H2O・O2)がCaCl2を通過する
→H2Oが吸収される
●STEP4
気体(CO2・O2)がソーダ石灰を通過する
→CO2が吸収される
まずは、O2又は乾燥した空気を吹き込みながら試料(有機物:CxHyOz)を燃焼させる。

その結果、試料中のCはCO2(気体)に、HはH2O(気体)に変化する。
→試料の不完全燃焼を防ぐ
STEP1の燃焼が不十分で、Cが本来CO2まで酸化されるところ、COまでしか酸化されていないという場合がある。
そこで、酸化剤である「CuO」中を通過させることで試料の不完全燃焼を防ぐ。

\[ \mathrm{CuO + CO → Cu + CO_{2}} \]
→H2Oが吸収される
次に、気体(CO2・H2O・O2)がCaCl2を通過する。
塩化カルシウムCaCl2は中性の乾燥剤である。
したがって、H2Oのみが吸収される。
→CO2が吸収される

ソーダ石灰(NaOH+CaO)は塩基性の乾燥剤なので、酸性気体であるCO2が吸収される。(ただし、この場合は“乾燥剤”として働いているわけではない:乾燥剤について詳しくは【乾燥剤】酸性・中性・塩基性の乾燥剤一覧や分類・仕組みなどを参照)
元素分析では、以上の手順で得た塩化カルシウム管に吸収されたH2O、及びソーダ石灰管に吸収されたCO2の質量をもとに、元の有機化合物の組成式を求める。
※具体的な計算方法については、以下で解説しているので必ずマスターしておこう。
塩化カルシウム管とソーダ石灰管を入れ替えてはいけない理由
- 中性の乾燥剤である塩化カルシウムと塩基性の乾燥剤であるソーダ石灰の順番は入れ替えてはならない。
- 全ての乾燥剤は物質に含まれるH2Oを吸収する(=物質を乾燥させる)
- 酸性の乾燥剤は(塩基性気体は吸収されるため)酸性気体の乾燥に用いられる
- 塩基性の乾燥剤は(酸性気体は吸収されるため)塩基性気体の乾燥に用いられる
- ソーダ石灰は塩基性の乾燥剤であり、H2Oや酸性気体であるCO2を吸収する。
- したがって、ソーダ石灰を先にセッティングするとH2OとCO2をいっぺんに吸収してしまい、それぞれの正確な量を量ることが出来ない。
- したがって、元素分析をする際は必ず「塩化カルシウム管→ソーダ石灰管」の順に試料を通す必要がある。
元素分析と組成式の決定
- 元素分析の結果を用いて有機化合物の組成式を決定することができる。
- 元素分析後の塩化カルシウム管の増加量(=吸収されたH2Oの質量)をAg、ソーダ石灰管の増加量(=吸収されたCO2の質量)をBgだとすると、有機化合物CxHyOzwgに含まれるC・H・Oのモル比は次のように表すことができる。
\[ \begin{align} & \mathrm{C:H:O} \\
&\mathrm{=\frac{ B×\frac{ 12 }{ 44 }(g) }{ 12(g/mol) } : \frac{ A×\frac{ 2 }{ 18 }(g) }{ 1(g/mol) } : \frac{ w-(B×\frac{ 12 }{ 44 }+A×\frac{ 2 }{ 18 })(g) }{ 16(g/mol) }} \end{align} \]
上式に関する解説
\[ \mathrm{\frac{ B×\frac{ 12 }{ 44 }(g) }{ 12(g/mol) } }\]
- まずはこの部分に注目する。
- 分子では、吸収されたCO2の質量Bgに「Cの原子量(12)/CO2の分子量(44)」をかけることで「C原子だけの質量」を導き出している。それをC原子の原子量12(g/mol)で割ることでC原子のmolが得られる。
- 同様に、次の式で吸収されたH2O(Ag)中に含まれるH原子のmolが得られる。
\[ \mathrm{\frac{ A×\frac{ 2 }{ 18 }(g) }{ 1(g/mol) }} \]
- また、O原子のmolは次のようになる。
\[ \mathrm{\frac{ w-(B×\frac{ 12 }{ 44 }+A×\frac{ 2 }{ 18 })(g) }{ 16(g/mol) } }\]
- 元の有機化合物の質量wgからH原子・C原子の質量を引いて間接的にO原子の質量を求めている。
- 最後にもう一度、C・H・Oのモル比を表す式を確認する。
\[ \begin{align} & \mathrm{C:H:O} \\
&\mathrm{=\frac{ B×\frac{ 12 }{ 44 }(g) }{ 12(g/mol) } : \frac{ A×\frac{ 2 }{ 18 }(g) }{ 1(g/mol) } : \frac{ w-(B×\frac{ 12 }{ 44 }+A×\frac{ 2 }{ 18 })(g) }{ 16(g/mol) }} \end{align} \]
- これを用いて次の例題を解いていこう。
元素分析の計算問題
- 元素分析の計算問題の解き方を解説する。
例題1
炭素、水素、酸素よりなる有機化合物4.88mgを完全燃焼させ、元素分析を行った。その結果、燃焼した気体が通過した後の塩化カルシウムを詰めた吸収管の重量は3.60mg増え、ソーダ石灰を詰めた吸収管の重量は14.08mg増えた。この有機化合物の組成式を求めよ。
『東邦大学 2001年 参考』
- 問題文で与えられている数値を先ほどの公式に入れる。
\[ \begin{align} & \mathrm{C:H:O} \\
&\mathrm{=\frac{ 14.08×\frac{ 12 }{ 44 } }{ 12 } : \frac{ 3.60×\frac{ 2 }{ 18 } }{ 1 } : \frac{ 4.88-(14.08×\frac{ 12 }{ 44 }+3.60×\frac{ 2 }{ 18 }) }{ 16 }} \\
&\mathrm{=0.32:0.4:0.04} \\
&\mathrm{=8:10:1} \end{align} \]
- よって、組成式はC8H10Oとなる。
例題2
ある有機化合物10mgを完全燃焼させたところ、二酸化炭素23.3mg、水12.2mgが得られ、残りは酸素であった。この有機化合物の組成式を求めよ。
『同志社大学 1998年 参考』
- 問題文で与えられている数値を先ほどの公式に入れる。
\[ \begin{align} & \mathrm{C:H:O} \\
&\mathrm{=\frac{ 23.3×\frac{ 12 }{ 44 } }{ 12 } : \frac{ 12.2×\frac{ 2 }{ 18 } }{ 1 } : \frac{ 10-(23.3×\frac{ 12 }{ 44 }+12.2×\frac{ 2 }{ 18 }) }{ 16 } }\\
&\mathrm{≒0.53:1.35:0.14} \\
&\mathrm{≒4:10:1} \end{align} \]
- よって、組成式はC4H10Oとなる。
例題3
炭素、水素、酸素、窒素からなる有機化合物がある。元素分析値は炭素45.6%、水素8.8%、窒素13.6%である。この有機化合物の組成式を求めよ。
『慶應大学 1995年 参考』
- 窒素Nが入っているが、やり方はほぼ一緒。問題文で与えられている数値を先ほどの公式に入れる。
\[ \begin{align} & \mathrm{C:H:N:O} \\
&\mathrm{=\frac{ 45.6 }{ 12 } : \frac{ 8.8 }{ 1 } : \frac{ 13.6 }{ 14 } : \frac{ 100-(45.6+8.8+13.6) }{ 16 } }\\
&\mathrm{≒3.8:8.8:0.97:2} \\
&\mathrm{≒4:9:1:2} \end{align} \]
- よって、組成式はC4H9NO2となる。














