MENU
凝析と塩析
目次
はじめに
【プロ講師解説】このページでは『凝析と塩析』について解説しています。
塩析とは
- 親水コロイドは、水中で多くの水分子に支えられて安定化している(=水和している)。
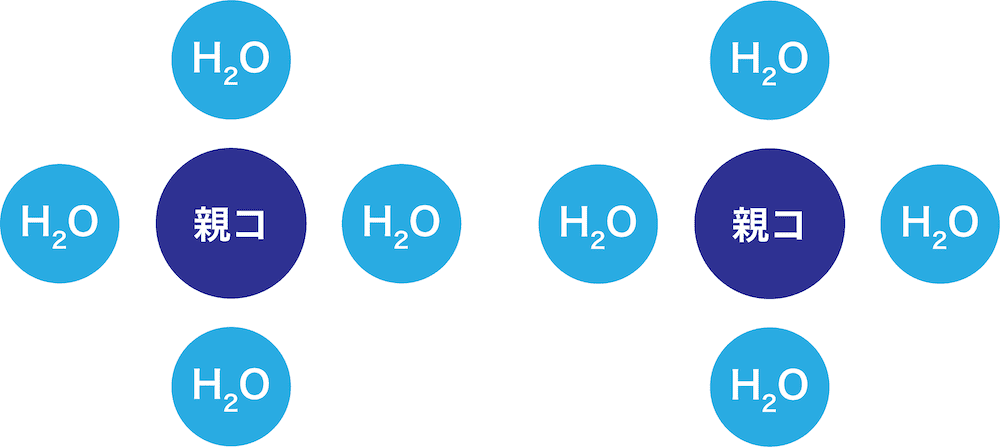
- ここに多量の電解質を加えると、次のような現象が起こる。
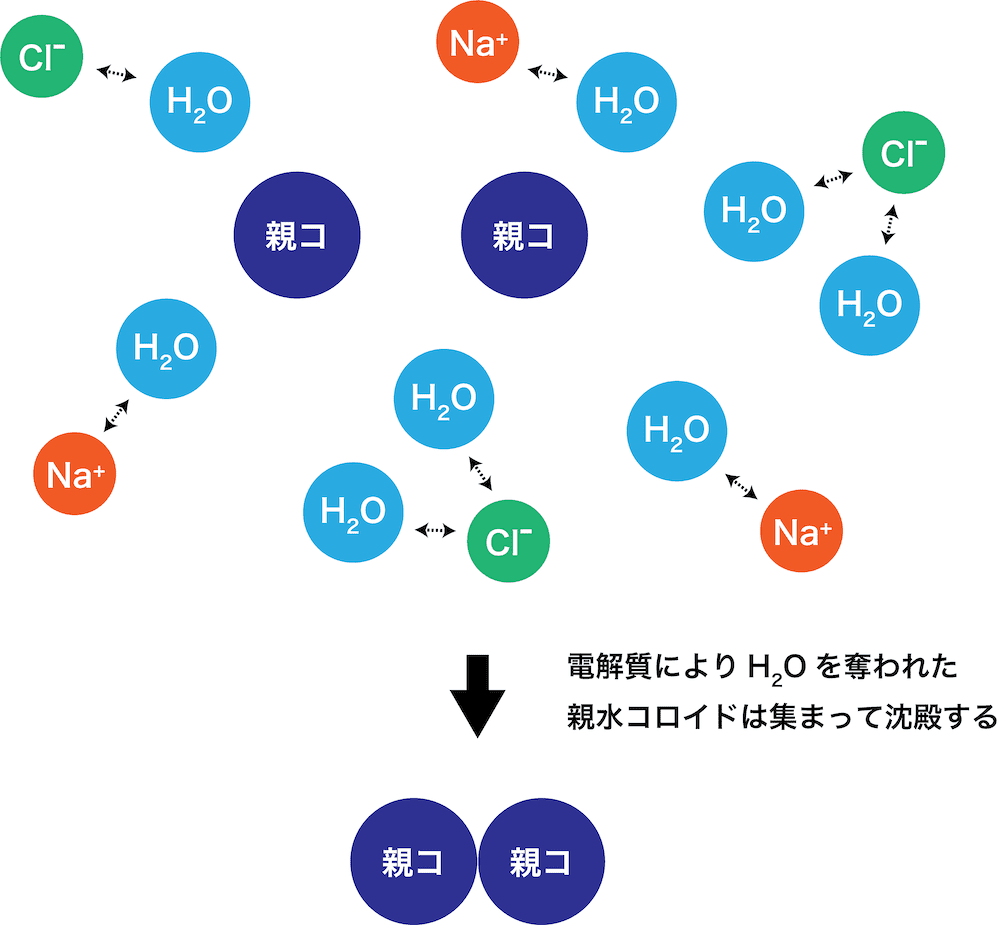
- 電解質が電離して生じた陽イオンや陰イオンに(コロイドの安定化に貢献していた)水を奪われて、親水コロイドは不安定となり沈殿する。
- このように、親水コロイドが多量の電解質によって沈殿する現象を塩析という。
凝析とは
- 疎水コロイドはその名の通り水との親和性が小さいコロイドであるため、水による安定化を受けず、コロイド同士で反発し分散している。

- この状態で少量の電解質を加えると、電解質が電離して生じた陽イオン(陰イオン)が疎水コロイドの表面の電荷に引きつけられて表面の電荷が打ち消される。
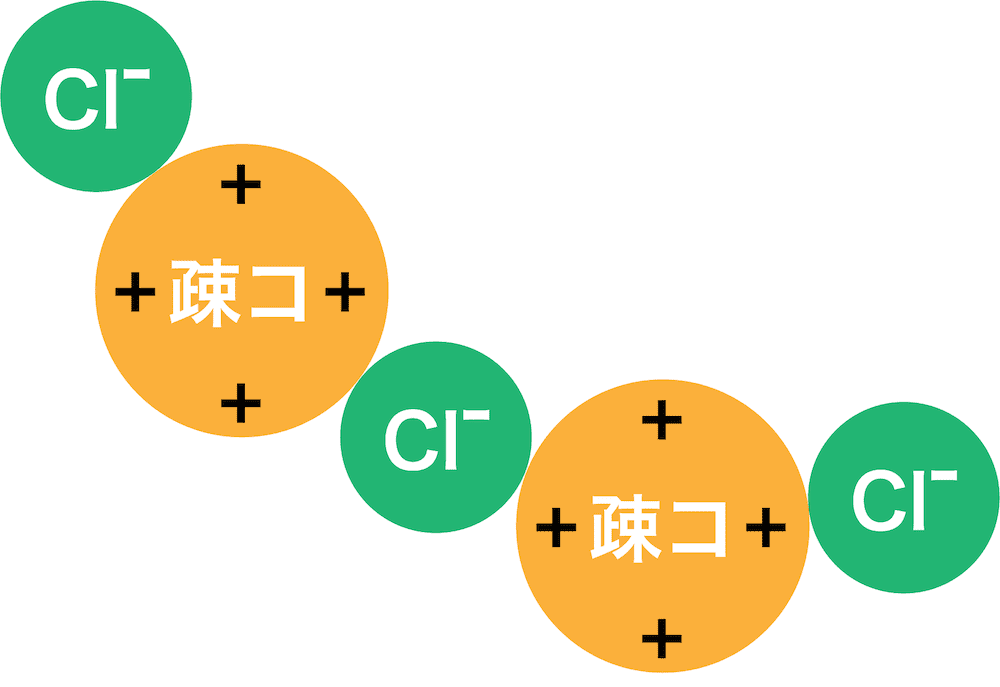
- 表面の電荷を打ち消された疎水コロイドは、反発する力を失うため分散せずに固まって沈殿する。
- このように、疎水コロイドが少量の電解質によって沈殿する現象を凝析という。
塩析と凝析の違い
- 塩析と凝析の違いを表にまとめると、次のようになる。
| 関与するコロイド | 電解質の量 | |
|---|---|---|
| 塩析 | 親水コロイド | 多い |
| 凝析 | 疎水コロイド | 少ない |
- 塩析は、水によって安定化しているコロイドから水を引きはがすわけなので、かなりの力が必要。したがって、使う電解質の量は多量になる。
- 一方、凝析では、電解質を「引きはがすため」に使うのではなく、コロイド同士をつなぐ”接着剤”として用いるため、塩析ほどの量は必要ない。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
親水コロイドが多量の電解質によって沈殿する現象を【1】という。
解答/解説:タップで表示
解答:【1】塩析
親水コロイドが多量の電解質によって沈殿する現象を塩析という。
問2
疎水コロイドが少量の電解質によって沈殿する現象を【1】という。
解答/解説:タップで表示
解答:【1】凝析
疎水コロイドが少量の電解質によって沈殿する現象を凝析という。














