MENU
【基礎知識】有機化合物の結合と立体構造、回転など
目次
はじめに
【プロ講師解説】このページでは『【基礎知識】有機化合物の結合と立体構造、回転など』について解説しています。
破線-くさび形表記法
- 有機化合物の構造は立体構造を意識して破線-くさび形表記法で表されることがある。
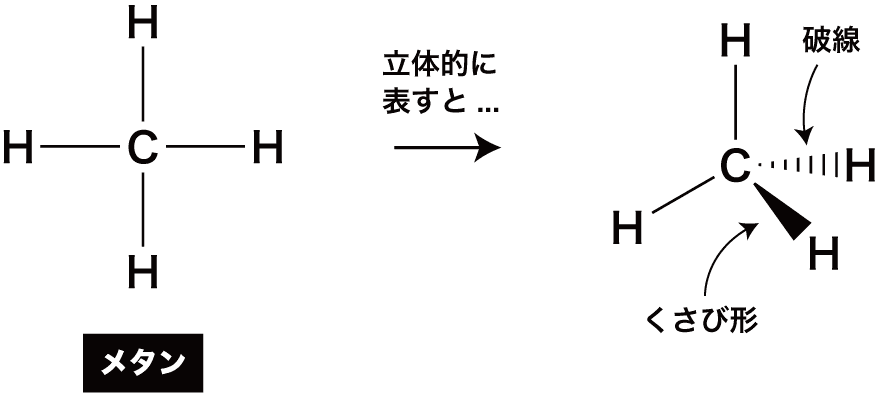
- 上図において、実線で表した結合は画面上にあり、くさび形で表した結合が画面から手前、つまりキミ自身の方へ伸びていて、破線で表した結合が画面から奥、つまりキミ自身から遠ざかるように伸びていることを意味する。
単結合・二重結合・三重結合の立体配置
- 単結合・二重結合・三重結合の立体配置について解説する。
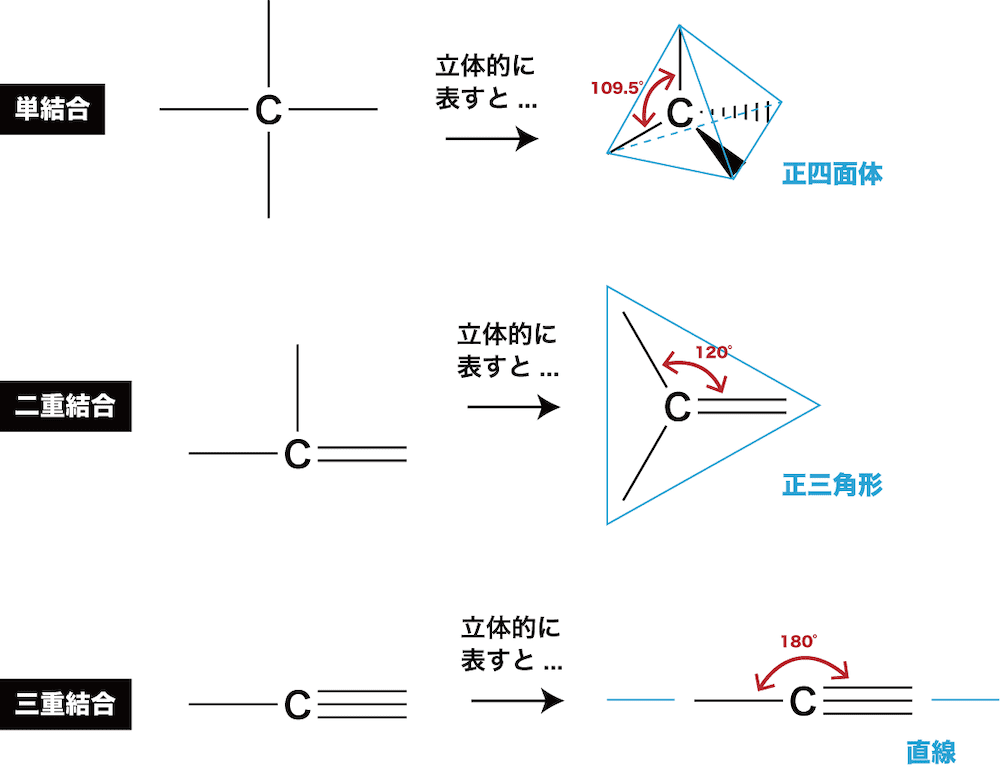
- 単結合の場合、炭素に結合している4つの原子(原子団)は立体的に四面体の頂点方向に位置する。
- 二重結合の場合、3つの原子(原子団)は立体的に正三角形の頂点方向に位置する。
- 三重結合の場合、2つの原子(原子団)は立体的に直線方向に位置する。
- つまり、炭素原子間の電子対はできるだけ離れて配置される。
- ちなみに、二重結合を作る2つの電子対のうち1つ、三重結合を作る3つの電子対のうち2つは、原子が並んだ面の上下にフワフワ漂う形で存在しており、化合物全体の形には影響しない。
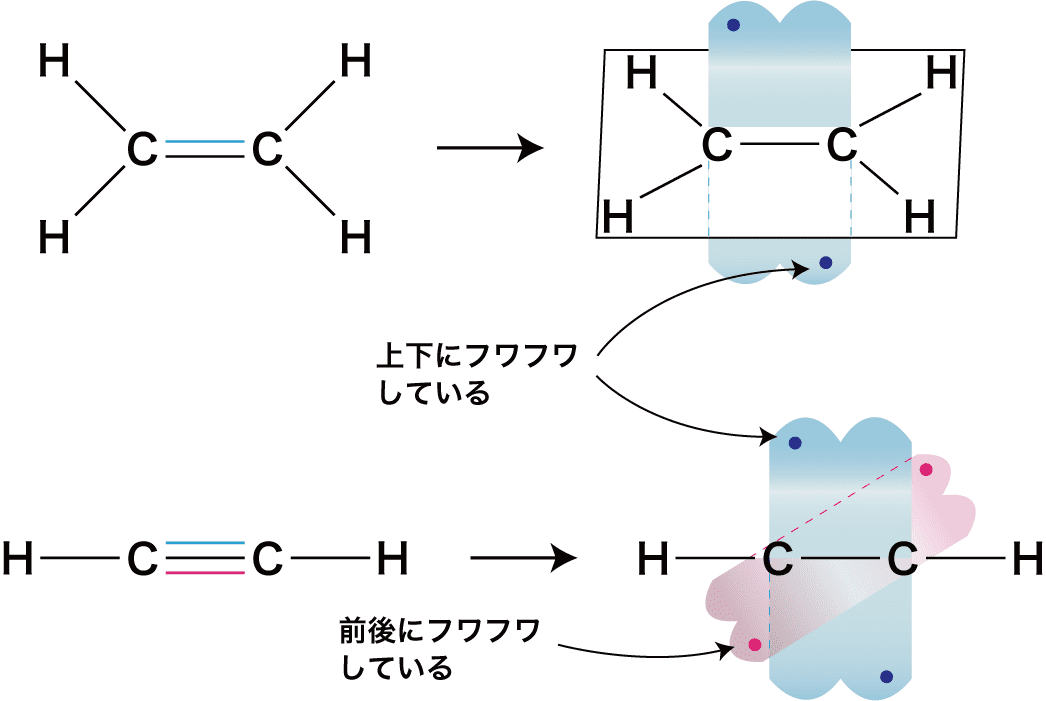
このフワフワした電子対による結合はπ(パイ)結合とよばれます。また、それ以外の通常の結合はσ(シグマ)結合とよばれます。
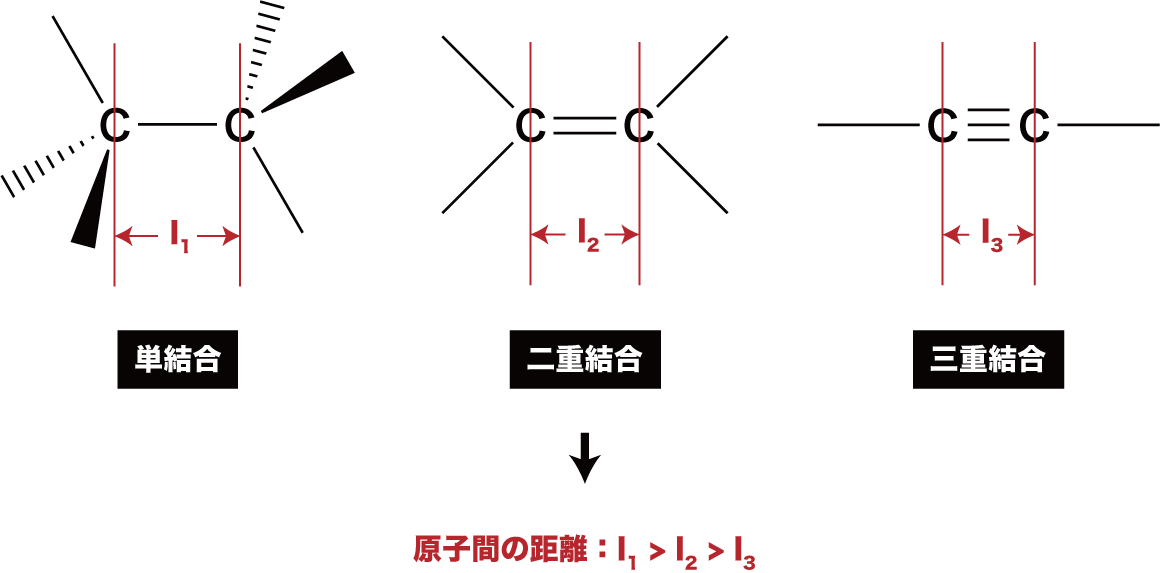
炭素原子間の距離と結合
- 炭素原子間の結合の多重度が大きくなる(単結合→二重結合→三重結合)につれ、原子間はより強く結び付けられるため、原子間の距離は短くなる。
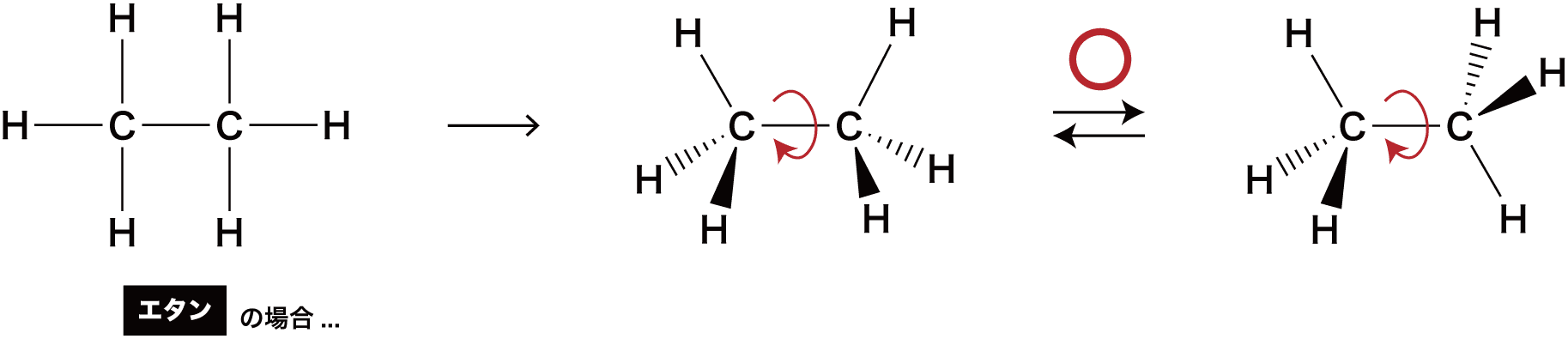
結合と回転
- 炭素-炭素単結合は回転できる。一方、炭素-炭素二重結合は回転できない。
- 例えばエタンは炭素原子間が1つの共有電子対で結びつけられている。
- この電子対はC-C軸上に存在し、結合の回転に影響がない。
- したがって、炭素-炭素単結合はC-C軸まわりの回転が可能である。
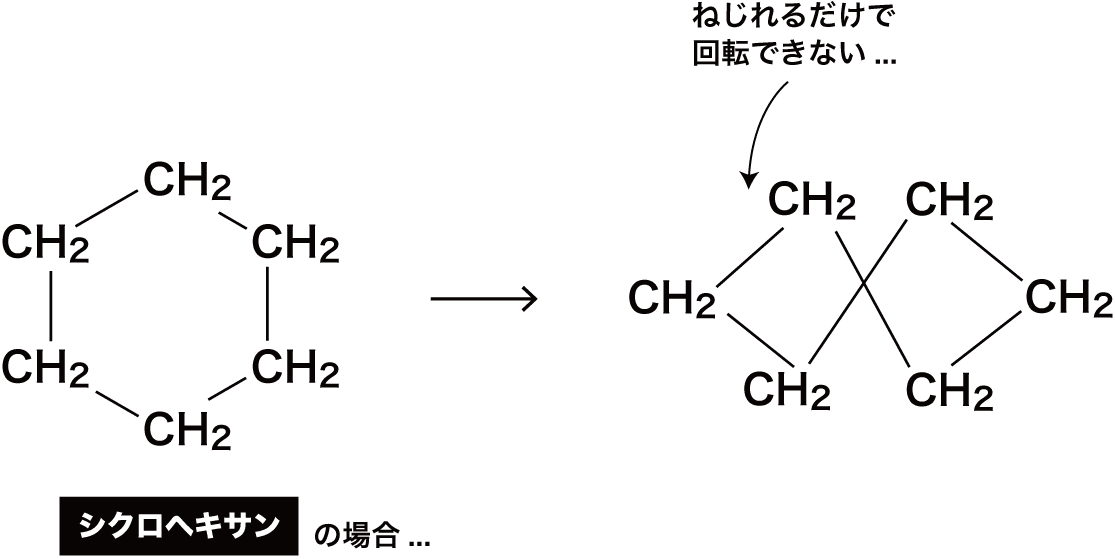
- ちなみに、環状炭化水素の環内のC-C結合は、C-C軸まわりに回転するのは困難である。(ねじれるだけで回らない)
- しかし、C-C結合の軸まわりで回転するのはできなくても、環構造の一部を折り紙のように動かすことで、いすのような形や船のような形に変形することはできる。
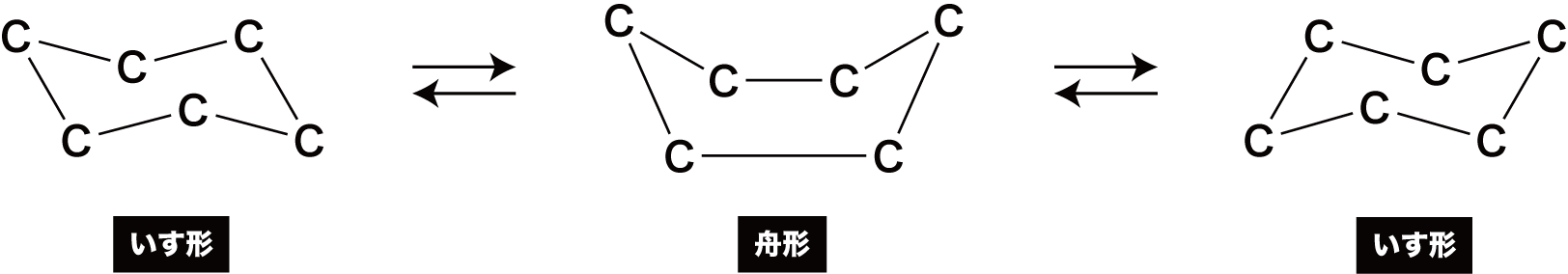
- いす形は立体障害が小さいため、舟形に比べて安定である。
- 炭素-炭素二重結合は、回転させるにはπ結合を切断しなくてはならず、切断に大きなエネルギーが必要である。したがって、単結合のように結合まわりで回転するのは難しい。
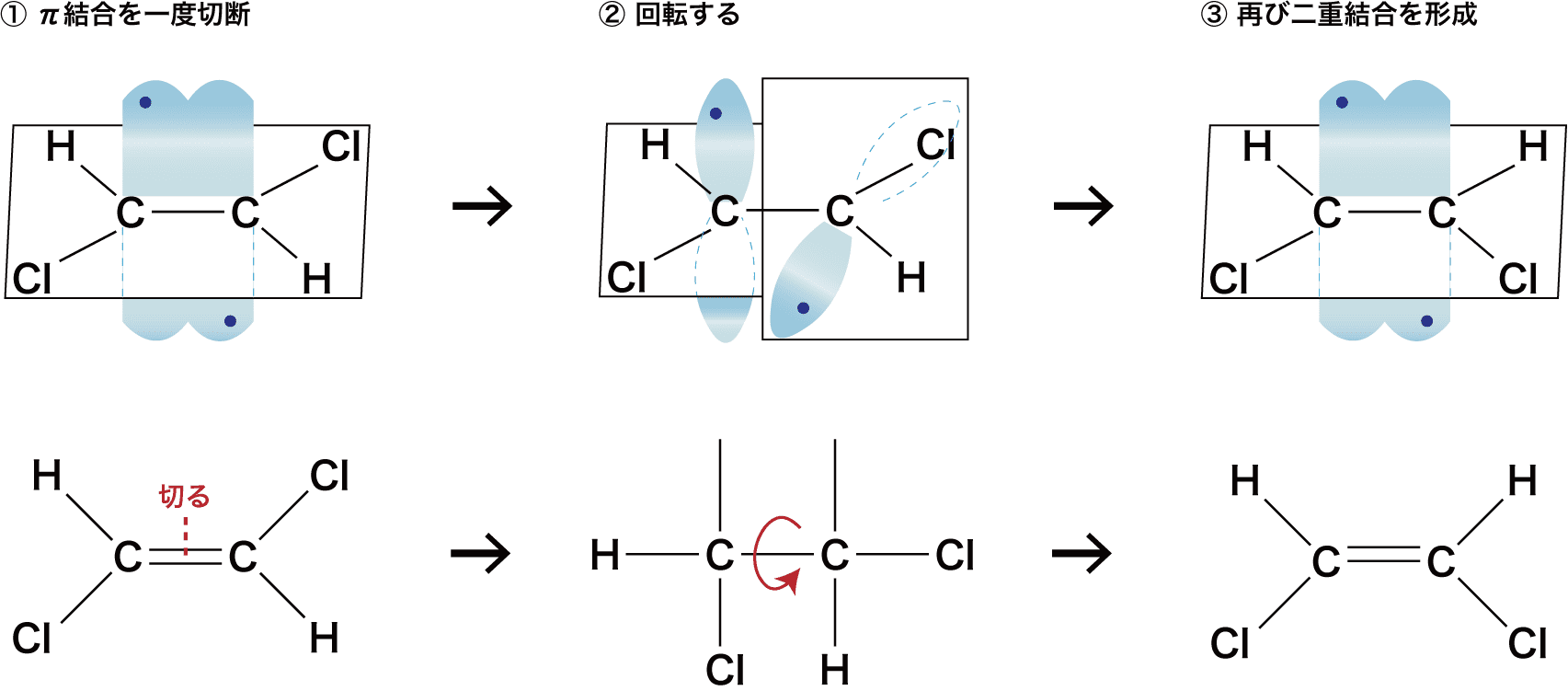
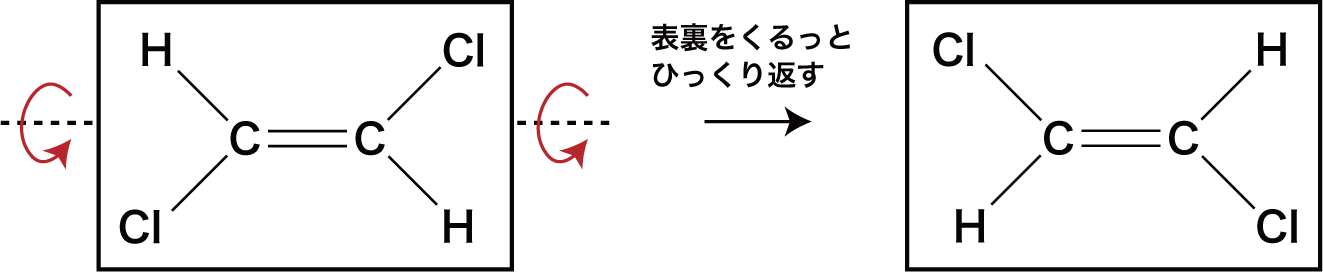
- ちなみに、炭素-炭素二重結合は、カードをめくるように表裏をひっくり返すことはできる。
- ただし、原子間の距離は変わっておらず、同じ構造式の見る方向を変えただけである。