MENU
アミノ酸の定義や構造、分類(酸性・塩基性・中性)など
目次
はじめに
【プロ講師解説】このページでは『アミノ酸の定義や構造、分類(酸性・塩基性・中性)など』について解説しています。
アミノ酸とは
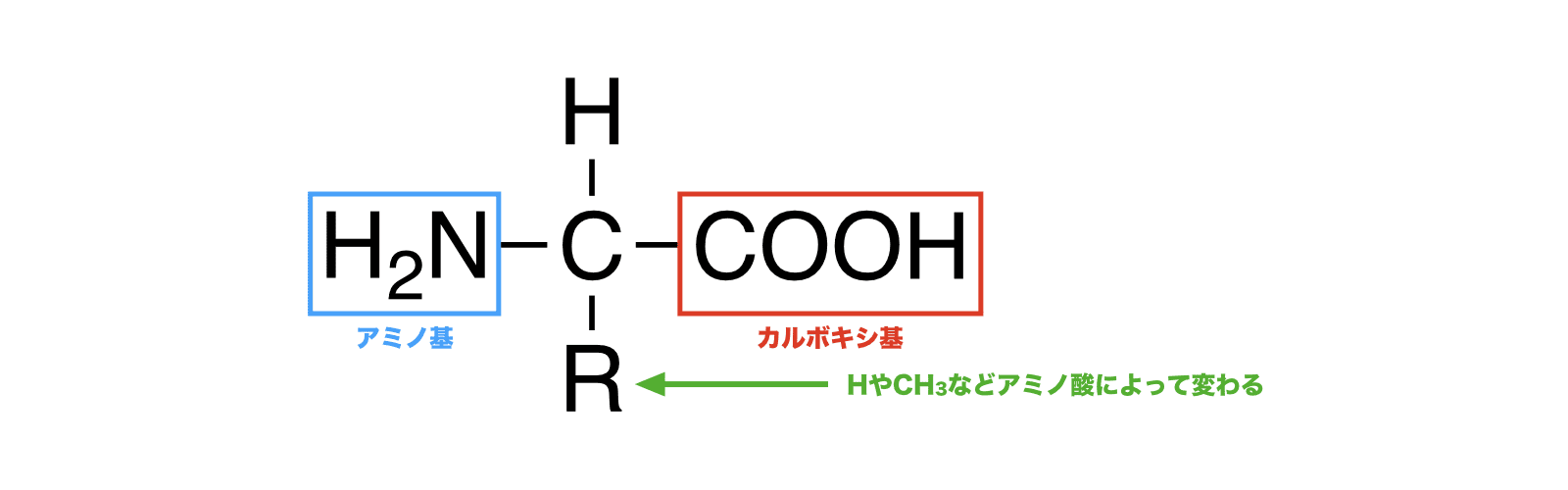
- アミノ基(-NH2)とカルボキシ基(-COOH)を併せもつ低分子化合物をアミノ酸という。
- アミノ酸のうち、アミノ基とカルボキシ基が同じ炭素原子に結合しているものをα-アミノ酸という。
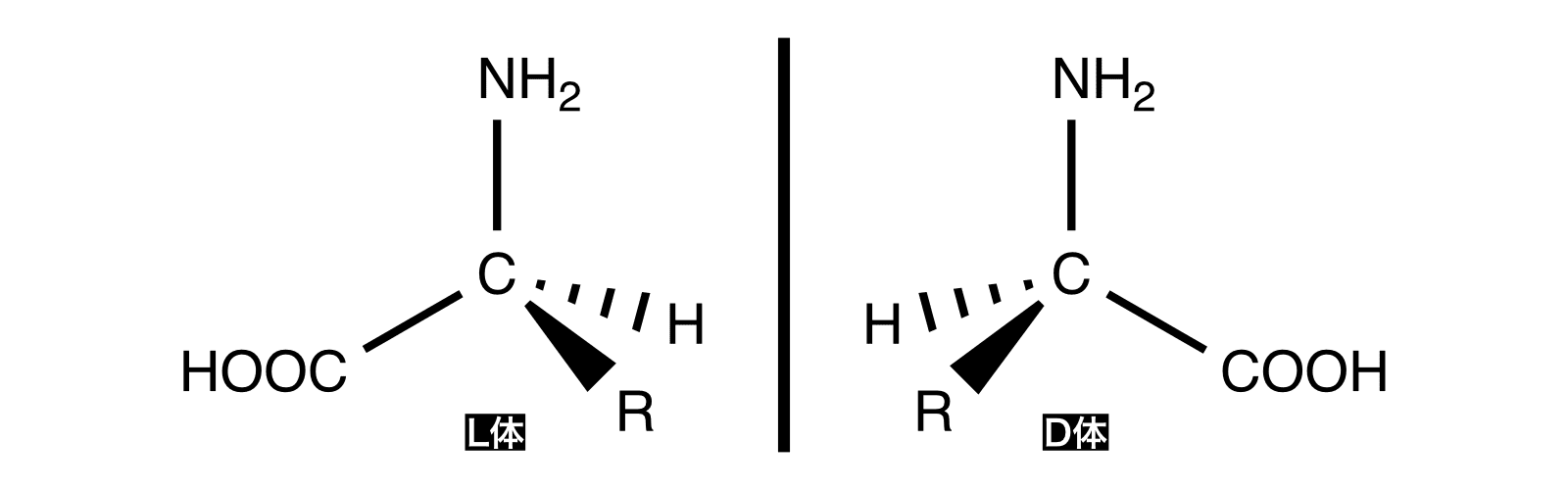
- α-アミノ酸は不斉炭素原子(C*)をもつので1対の光学異性体(鏡像異性体)が存在する。
- L体とD体のうち天然に存在するのはほぼL体のみである。
アミノ酸の分類
- アミノ基(-NH2)とカルボキシ基(-COOH)を同じ数もつアミノ酸を中性アミノ酸、カルボキシ基が多いものを酸性アミノ酸、アミノ基が多いものを塩基性アミノ酸という。
| アミノ酸 | 官能基 |
|---|---|
| 中性アミノ酸 | -NH2と-COOHの数が等しい |
| 酸性アミノ酸 | -COOHの数が多い |
| 塩基性アミノ酸 | -NH2の数が多い |

アミノ酸の構造
- α-アミノ酸は天然に約20種類存在する。
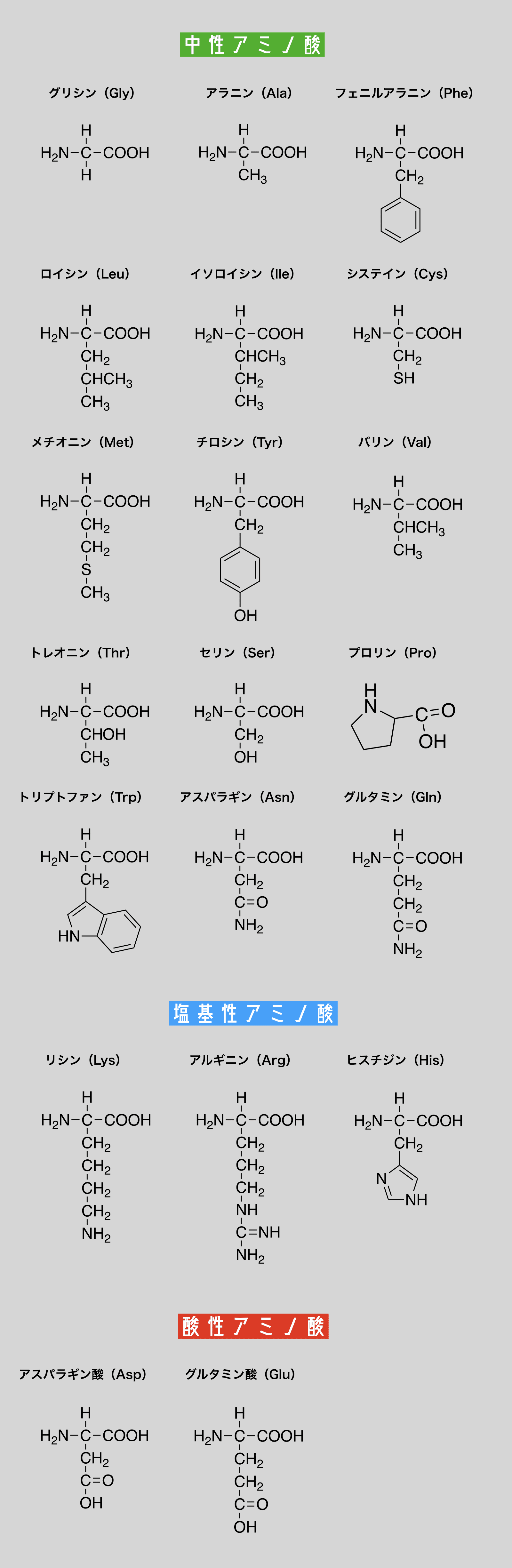
- これらアミノ酸のうち、フェニルアラニン・ロイシン・バリン・イソロイシン・スレオニン(トレオニンともいう)・ヒスチジン・トリプトファン・リシン・メチオニンの9種類は生体内で合成されにくいため食品などから摂取する必要がある。このようなアミノ酸を必須アミノ酸という。
必須アミノ酸はそれぞれの頭文字をとって「フロバイスヒトリジメ(風呂場イス独り占め)」の語呂で覚えましょう。
アミノ酸の反応・性質
- アミノ酸の代表的な反応・性質を紹介する。
●アミノ酸の性質
- 融解・溶解性
- 等電点
- 両性
- 電気泳動
- ペプチド結合を形成する
- 検出反応
❶ 融解・溶解性
- アミノ酸は結晶中でイオンとなっているため、比較的融点は高い。
- また、極性分子のため、水には溶けやすいが有機溶媒には溶けにくい。
❷ 等電点
- 水溶液中では陽イオン・陰イオン・双性イオンの間で平衡状態になっており、この平衡混合物の正負の電荷が等しくなるときのpHを等電点という。
参考:【アミノ酸】等電点(求め方・pHとの関係・計算問題の解き方など)
❸ 両性
- アミノ酸はカルボキシ基(-COOH)とアミノ基(-NH2)を併せもつ両性化合物なので両方の官能基の性質を示す。
❹ 電気泳動
- あるpHの水溶液でろ紙を湿らせ、真ん中にアミノ酸の混合物を含ませてろ紙の両端に電圧をかけると、アミノ酸が移動するのを確認できる。
- これをアミノ酸の電気泳動という。
参考:電気泳動(原理・中性/酸性/塩基性アミノ酸の移動方向など)
❺ ペプチド結合を形成する
- 1つのアミノ酸のカルボキシ基(-COOH)と、もう1つのアミノ酸のアミノ基(-NH2)が脱水縮合する。
- このときに生じるアミド結合をペプチド結合という。
❻ 検出反応
- アミノ酸にニンヒドリン水溶液を加えて加熱すると「青紫色〜赤紫色」になる。
- この反応はニンヒドリン反応とよばれ、ほとんど全てのアミノ酸及びタンパク質の検出反応となっている。














