MENU
面心立方格子(配位数・充填率・密度・格子定数・半径など)
はじめに
【プロ講師解説】このページでは『面心立方格子(配位数・充填率・密度・格子定数・半径など)』について解説しています。
面心立方格子とは
- 次のように、立体の各頂点と各面の中心に同種の粒子が配列された結晶格子を面心立方格子という。
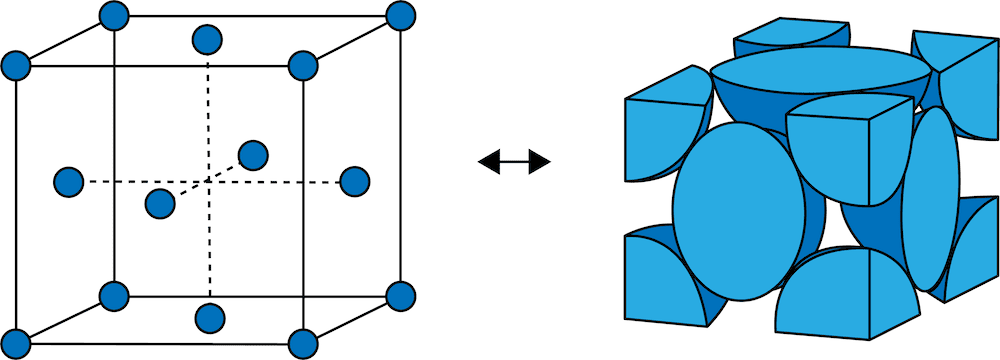
面心立方格子に含まれる原子の数
- 面心立方格子に含まれる原子の数を考える。

- 面心立方格子に含まれる原子のうち、格子の各“頂点”にあるものは原子を8分割した状態になっている。

- 8分割(1/8)したものが頂点の数分=8個あるため、頂点にある原子の数は合わせて1個である。
\[
\frac{ 1 }{ 8 }×8=1
\]
- 次に、面心立方格子の各“面”に存在する原子の数を数える。
- 格子の6面(横に4面上下に1面ずつ)にある原子は球体の原子を2分割したものになっている。
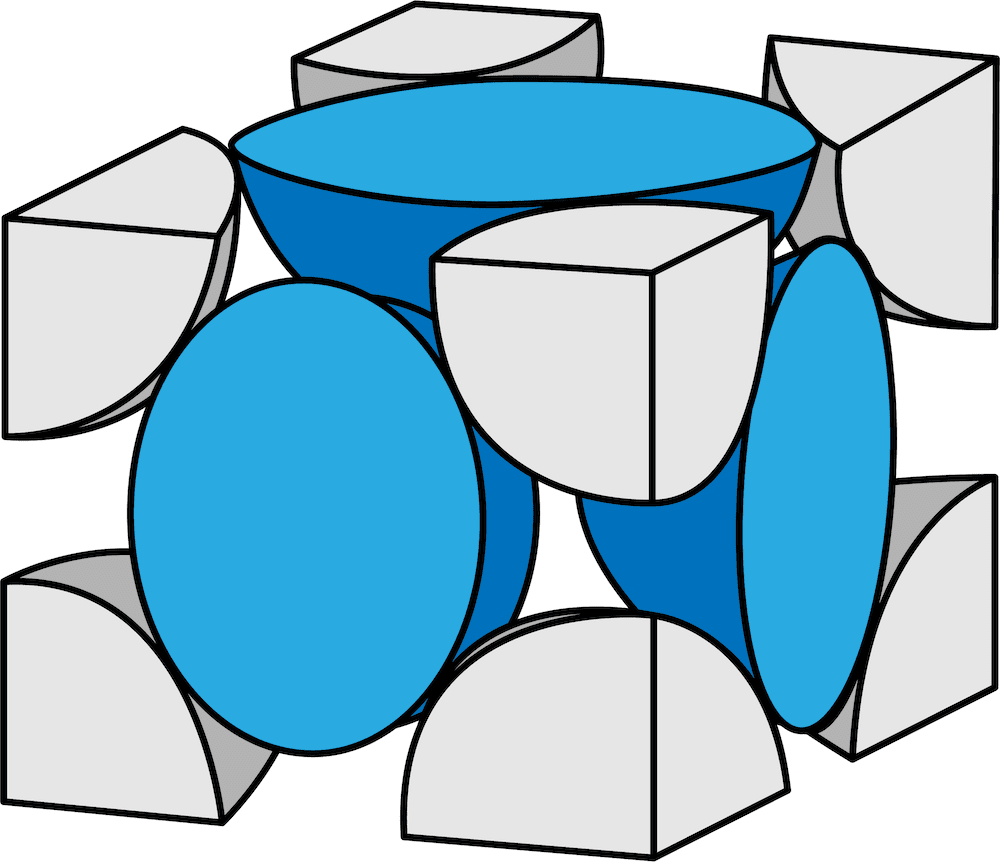
- 2分割(1/2)したものが各面の数分=6個あるので、面にある原子の数は合わせて3個である。
\[
\frac{ 1 }{ 2 }×6=3
\]
- 以上より、面心立方格子に含まれる原子の数は4個である。
\[
\underbrace{ 1 }_{ 頂点 }+\underbrace{ 3 }_{ 面 }=4
\]
面心立方格子の配位数
- 面心立方格子を2個つなぎ合わせると、次のようになる。

- 中心の部分で、左側の単位格子に含まれる原子(1/2のもの)と右側の単位格子に含まれる原子(1/2のもの)が合わさって、1個の球状の原子が出来上がっている。
- 配位数とは「1個の原子を取り囲む他の粒子の数」のことなので、図から面心立方格子の配位数は12であることがわかる。
面心立方格子の格子定数と原子半径
- 単位格子の1辺の長さを格子定数という。
- 面心立方格子の側面だけをみると次のようになっている(原子半径をr、格子定数をaとする)。
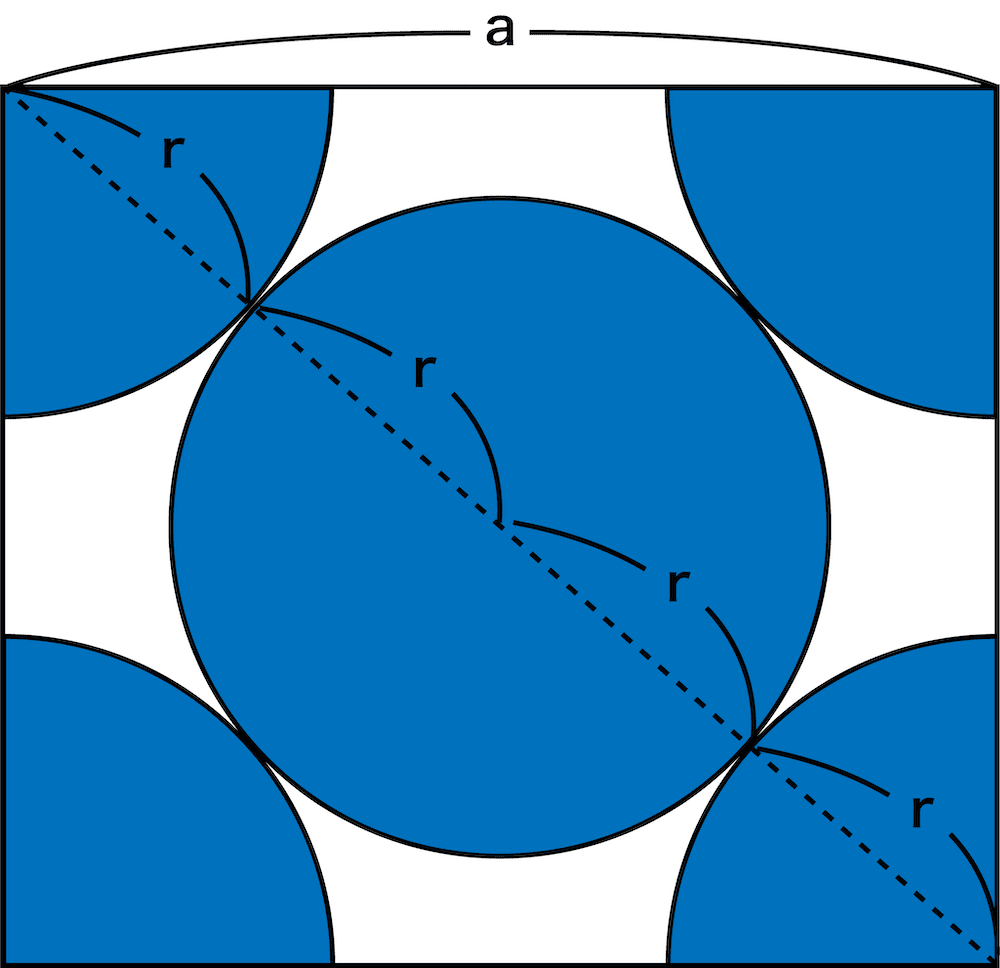
- ここで、三平方の定理を用いると次のような式を立てることができる。
\[
(4r)^{2}=a^{2}+a^{2}
\]
- これを整理すると、面心立方格子の格子定数と原子半径の関係を導くことができる。
\[
\begin{align}&(4r)^{2}=2a^{2}\\
&\Leftrightarrow 4r=\sqrt{ 2 }a\\
&\Leftrightarrow r=\frac{ \sqrt{ 2 } }{ 4 }a\end{align}
\]
面心立方格子の充填率
- 単位格子の体積に占める原子の体積の割合を充填率という。
\[
充填率=\frac{ 原子の体積 }{ 単位格子の体積 }×100
\]
- 「面心立方格子に含まれる原子の数」にあるように、面心立方格子は単位格子中に4個の原子を含んでいるため、次のような式をたてることができる。
\[
\begin{align}
充填率&=\frac{ 原子の体積 }{ 単位格子の体積 }×100\\
&=\frac{ \frac{ 4 }{ 3 }πr^{3}×4 }{ a^{3} }×100\\
\end{align}
\]
- 単位格子の1辺の長さ(格子定数)はaなので、単位格子の体積は(縦×横×高さで)a3となる。
- また、球の体積は4/3πr3と表すことができる(これは数学の知識)ため、面心立方格子に4個の原子が含まれることを考えると、原子の体積の合計は4/3πr3×4となる。これを解くと、充填率は74%となる。
\[
\begin{align}
充填率&=\frac{ 原子の体積 }{ 単位格子の体積 }×100\\
&=\frac{ \frac{ 4 }{ 3 }πr^{3}×4 }{ a^{3} }×100\\
&=\frac{ \frac{ 4 }{ 3 }π(\frac{ \sqrt{ 2 } }{ 4 }a)^{3}×4 }{ a^{3} }×100\\
&=\frac{ \sqrt{ 2 }π }{ 6 }×100\\
&=74(\%)
\end{align}
\]
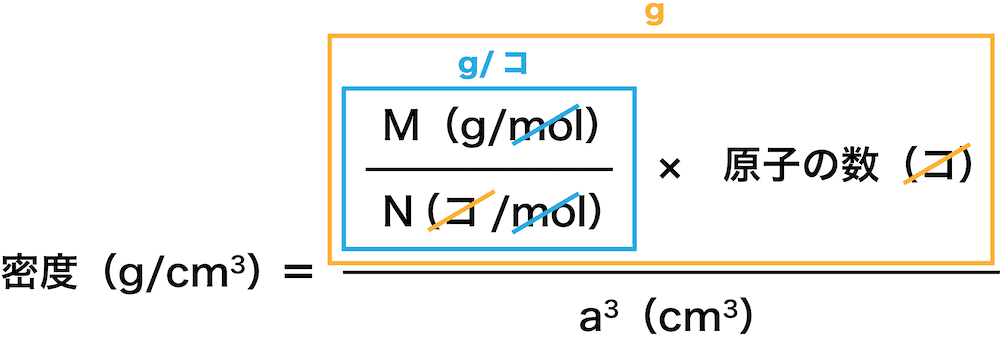
面心立方格子の密度
- 立方格子の密度は『g/cm3』という単位で表されることが多い。
- この単位のうち、分子のgは立方格子に含まれる原子の重さを、分母のcm3は立方格子全体の体積を示している。
- したがって、アボガドロ定数をN(個/mol)、立方格子に含まれる原子の原子量をM(g/mol)とすると、立方格子の密度は次のように表すことができる(この式は面心立方格子だけでなく体心立方格子でも共通)。
\[
密度(\mathrm{g/cm^{3}})=\frac{ \frac{ M(\mathrm{g/mol}) }{ N(\mathrm{個/mol}) }×原子の数(個) }{ a^{3}(\mathrm{cm^{3}}) }
\]
- ちなみに分子の部分は、原子量M(g/mol)をアボガドロ定数N(個/mol)で割ることで(molとmolが約分されて)「g/個」を出し、それに「原子の数(個)」をかけることで「g」を導き出している。
- あとはこの式に、アボガドロ定数である6.0×1023(個/mol)、面心立方格子に含まれる原子の数である4(個)、問題文で与えられている分子量(g/mol)、問題文に与えられている格子の1辺の長さaを3乗して求めた立方格子の体積a3を代入すれば、面心立方格子の密度を求めることができる。
面心立方格子まとめ
この『面心立方格子(配位数・充填率・密度・格子定数・半径など)』のページで解説した内容をまとめる。
- 面心立方格子に含まれる原子の数は4個である。
- 面心立方格子の配位数は12である。
- 面心立方格子の格子定数と原子半径の関係は次の通りである。
\[ \mathrm{r=\frac{ \sqrt{ 2 } }{ 4 }a} \] - 面心立方格子の充填率は74%である。














