MENU
【錯イオン】色・配位数・形・価数・命名法を総まとめ
はじめに
【プロ講師解説】このページでは『【錯イオン】色・配位数・形・価数・命名法を総まとめ』について解説しています。
金属イオンと配位数
- 錯イオンの配位数は金属イオンの種類によって決まっている。
| 金属イオン | 配位数 |
|---|---|
| Ag+ | 2 |
| Zn2+ | 4 |
| Cu2+ | 4 |
| Al3+ | 6 |
| Fe2+ | 6 |
| Fe3+ | 6 |
錯イオンの配位数と立体構造
- 上述の通り、配位数は金属イオンによって決まっており、それによって錯イオンの立体構造も決定する。
- 配位数が2なら直線形、6なら正八面体となる。配位数が4の場合は正四面体形と正方形の2通りが考えられ、金属イオンがZn2+の場合は正四面体形、Cu2+なら正方形と覚えよう。
| 金属イオン | 配位数 | 形 |
|---|---|---|
| Ag+ | 2 | 直線 |
| Zn2+ | 4 | 正四面体 |
| Cu2+ | 4 | 正方形 |
| Al3+ | 6 | 正八面体 |
| Fe2+ | 6 | 正八面体 |
| Fe3+ | 6 | 正八面体 |
錯イオンの命名法
- 錯イオンの命名は次の手順で行う。
●STEP1
配位数をチェックする
●STEP2
配位子をチェックする
●STEP3
金属イオンをチェックする
●STEP4
STEP1〜STEP3でチェックしたものをまとめて、錯イオンの名称を決定する
- ここでは[Ag(NH3)2]+を例にする。
まず、配位数をチェックする。
| 配位数 | 名称(読み方) |
|---|---|
| 1 | モノ |
| 2 | ジ |
| 3 | トリ |
| 4 | テトラ |
| 5 | ペンタ |
| 6 | ヘキサ |
錯イオンの名称の先頭には、配位数に応じてギリシア語の読みをつける。
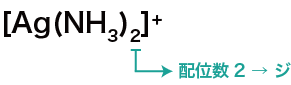
今回の場合は、配位数が「2」なのでギリシャ語で2を表す「ジ」を使う。
次に、配位子をチェックする。
| 配位子 | 名称(読み方) |
|---|---|
| NH3 | アンミン |
| OHー | ヒドロキシド |
| CNー | シアニド |
| S2O32ー | チオスルファト |

今回の例では、NH3が配位子のため、錯イオンの名称の中にNH3を表す「アンミン」という言葉を入れる。
次に、金属イオンをチェックする。
| 配位子 | 名称(読み方) |
|---|---|
| Ag+ | 銀(Ⅰ)イオン |
| Cu2+ | 銅(Ⅱ)イオン |
| Zn2+ | 亜鉛(Ⅱ)イオン |
| Fe2+ | 鉄(Ⅱ)イオン |
| Fe3+ | 鉄(Ⅲ)イオン |

今回の例では、「銀(Ⅰ)イオン」が使われているため、錯イオンの名称にこれを入れる。
最後に、STEP1からSTEP3で得た情報を1つにまとめて錯イオンの名称を決定する。
錯イオンの名称は「配位数+配位子名+金属+(酸)イオン」の順になる。
配位数+配位子名+金属+(酸)イオン
まずは、今回例として使っている錯イオン[Ag(NH3)2]+についてSTEP1からSTEP3で得た情報をまとめる。
- 配位数:2→ジ
- 配位子名:NH3→アンミン
- 金属イオン:Ag+
これらを「配位数+配位子名+金属+(酸)イオン」の順に並べる。
ジアンミン銀(Ⅰ)イオン
これが錯イオン[Ag(NH3)2]+の名称である。
錯イオンが負電荷をもつ場合
- 錯イオンが負電荷をもつ場合、イオンの前に”酸”を付ける必要がある。
| 錯イオン | 名称 |
|---|---|
| [Al(OH)4]ー | テトラヒドロキシドアルミン酸イオン |
| [Fe(CN)6]4ー | ヘキサシアニド鉄(Ⅱ)酸イオン |
錯イオン形成反応
- 水溶液中での金属イオンは水分子H2Oが結合して水和されており、この状態はアクア錯イオンと呼ばれる。
- 例えば硫酸銅(Ⅱ)水溶液中の銅(Ⅱ)イオンはテトラアクア銅(Ⅱ)イオン[Cu(H2O)4]2+となっている。
- ここで金属イオン(アクア錯イオン)が存在する水溶液に金属イオンと相性の良い物質を加えると、配位子が水からその物質に交換されて錯イオン形成反応が起こる。
- 例えば銅(Ⅱ)イオンを含む水溶液にアンモニアNH3水を加えると、テトラアクア銅(Ⅱ)イオン[Cu(H2O)4]2+の配位子H2OがNH3に置き換わり、錯イオンであるテトラアンミン銅(Ⅱ)イオン[Cu(NH3)4]2+が生じる。
\[ \mathrm{Cu^{2+}+4NH_{3}→[Cu(NH_{3})_{4}]^{2+}} \]
錯イオン形成反応式の作り方
●STEP1
金属イオンを含む化合物に配位子を組み合わせることで、イオン反応式をつくる
●STEP2
イオン反応式に対となるイオンを足すことで、化学反応式をつくる
- 今回は「水酸化銅(Ⅱ)Cu(OH)2+アンモニアNH3」の反応および「水酸化アルミニウムAl(OH)3+水酸化ナトリウムNaOH」の反応を例に確認する。
水酸化銅(Ⅱ)Cu(OH)2+アンモニアNH3
まず、金属イオンを含む化合物Cu(OH)2と配位子NH3を組み合わせる。
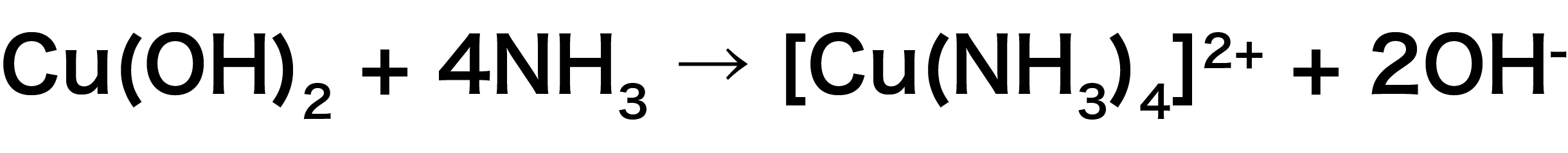
Cu(OH)2に含まれるCu2+だけを配位子NH3と組み合わせて、OHーは外によけておく。
次に、イオン反応式に対となるイオンを足すことで、化学反応式をつくる。
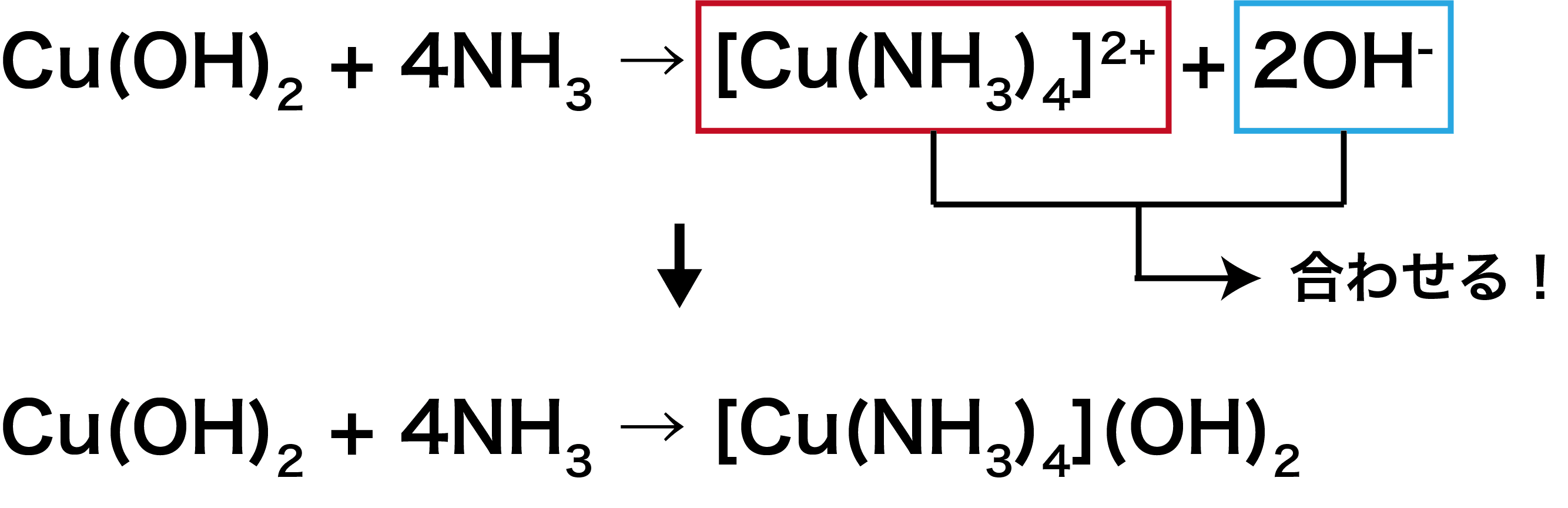
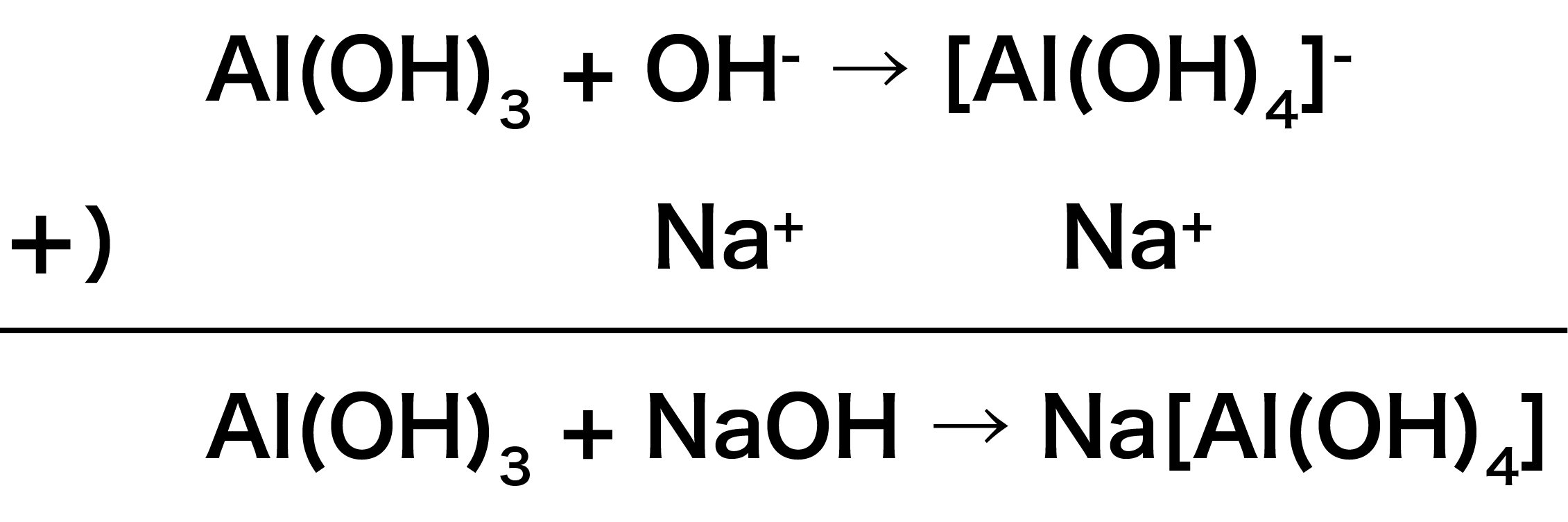
水酸化アルミニウムAl(OH)3+水酸化ナトリウムNaOH
まず、金属イオンを含む化合物Al(OH)3と配位子NaOH(の中のOHー)を組み合わせる。
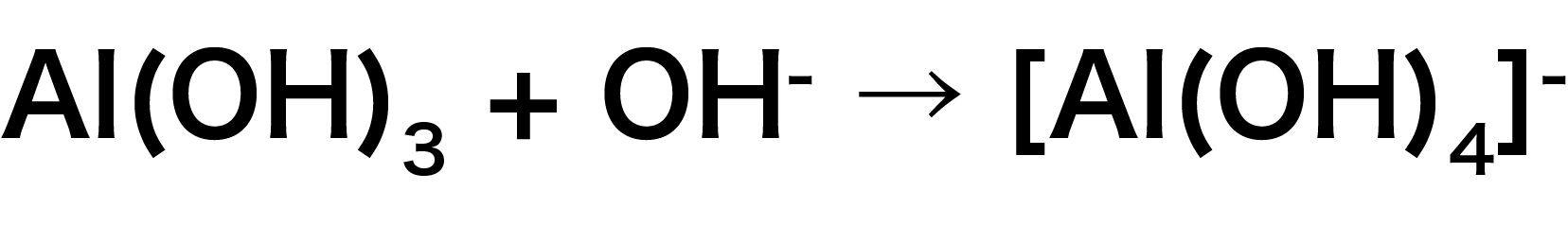
次に、NaOHのうち、STEP1で使用しなかったNa+をイオン反応式に組み合わせる。
金属イオンと配位子の組み合わせ
- 各金属イオンと相性のいい配位子は頭に入れておく必要がある。
| 配位子 | 錯イオン(イオン式) | 錯イオン(名称) |
|---|---|---|
| NH3 | [Ag(NH3)2]+ | ジアンミン銀(Ⅰ)イオン |
| [Zn(NH3)4]2+ | テトラアンミン亜鉛(Ⅱ)イオン | |
| [Cu(NH3)4]2+ | テトラアンミン銅(Ⅱ)イオン | |
| [Ni(NH3)6]2+ | ヘキサアンミンニッケル(Ⅱ)イオン | |
| OHー | [Zn(OH)4]2ー | テトラヒドロキシド亜鉛(Ⅱ)酸イオン |
| [Al(OH)4]ー | テトラヒドロキシドアルミン酸イオン | |
| [Sn(OH)4]2ー | テトラヒドロキシドスズ(Ⅱ)酸イオン | |
| [Pb(OH)4]2ー | テトラヒドロキシド鉛(Ⅱ)酸イオン | |
| CNー | [Ag(CN)2]ー | ジシアニド銀(Ⅰ)酸イオン |
| [Fe(CN)6]4ー | ヘキサシアニド鉄(Ⅱ)酸イオン | |
| [Fe(CN)6]3ー | ヘキサシアニド鉄(Ⅲ)酸イオン | |
| S2O32ー | [Ag(S2O3)2]3ー | ビス(チオスルファト)銀(Ⅰ)酸イオン |
アンモニアNH3は弱塩基なので、大量に加えてもOHーはそれほど多くなりません。したがって、OHーを配位子とした錯イオンは形成されず、NH3を配位子とした錯イオンのみができることに注意しましょう。
錯イオン形成が絡んだ沈殿の溶解
- 塩化銀AgClは水に難溶な塩であり、その飽和水溶液中では次のような溶解平衡が成り立っている。
\[ \mathrm{AgCl↓⇄Ag^{+}+Cl^{-}} \]
- この水溶液にNH3を過剰に加えた場合、上述の通りAg+とNH3は相性がいいため錯イオンを形成する。
- その結果、[Ag(NH3)2]+が増えるにしたがい銀イオン濃度[Ag+]が小さくなるため、ルシャトリエの原理により平衡が右に移動してAgClの沈殿が溶けていく。このように錯イオン形成反応によって沈殿を溶解させることができる。
水酸化亜鉛(Ⅱ)Zn(OH)2+アンモニアNH3水
- Zn2+とNH3は相性がいいため、錯イオンであるテトラアンミン亜鉛(Ⅱ)イオン[Zn(NH3)4]2+が形成され、水に難溶なイオン結晶であるZn(OH)2の沈殿が溶ける。
\[ \mathrm{Zn(OH)_{2}+4NH_{3}→[Zn(NH_{3})_{4}]^{2+}+2OH^{-}} \]















