MENU
ベンゼン(構造・特徴・製法・各種反応など)
目次
はじめに
【プロ講師解説】このページでは『ベンゼン(構造・特徴・製法・各種反応など)』について解説しています。
ベンゼンとは
- 分子式C6H6で表される正六角形の環状化合物をベンゼンという。
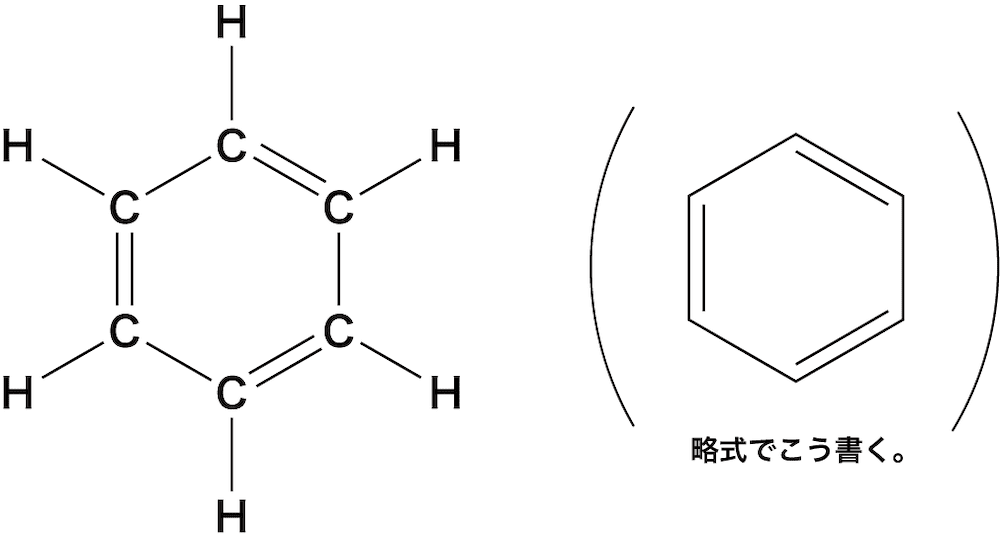
ベンゼンの特徴
- ベンゼンの性質として知っておくべきは次の3つである。
●ベンゼンの性質
- 共鳴する
- 全ての原子が同一平面上に存在する
- 非常に安定である
- 安定な環のため、付加反応よりも置換反応の方が起こりやすく開環しにくい
- ベンゼン環が複数繋がる場合がある
❶ 共鳴する
- ベンゼンは二重結合を3つもつように表記されるが、実際にはC-C間で単結合と二重結合が交互に入れ替わる共鳴とよばれる現象が起こっている。
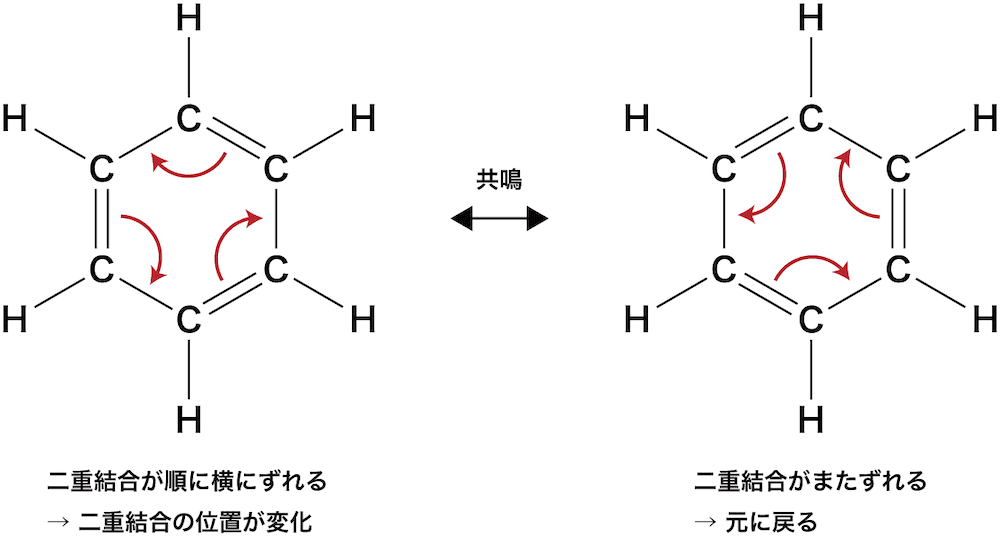
全ての結合が1.5重結合だと考えると分かりやすいです。
❷ 全ての原子が同一平面上に存在する
- ベンゼンを形成するすべての原子は同一平面上に存在している。
❸ 非常に安定である
- ベンゼン環のπ結合を形成している電子は炭素原子からなる六員環の表面に雲のように広がり非局在化(局所的に存在するのではなく満遍なく存在していること)している。
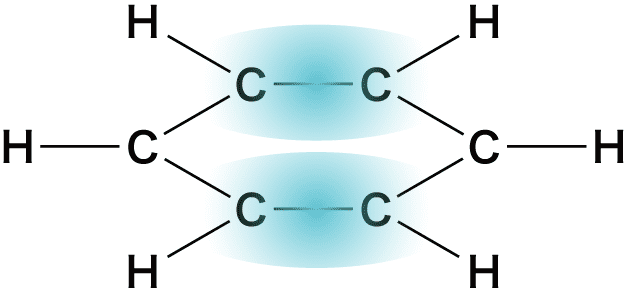
- これにより、ベンゼンは(同じく炭素炭素二重結合C=Cをもつアルケンなどと比べて)非常に安定している。
- ちなみにこのベンゼン環をもった安定な化合物をまとめて芳香族化合物とよばれる。
❹ 安定な環のため、付加反応よりも置換反応の方が起こりやすく開環しにくい
- ベンゼンは安定な環のため、付加反応よりも置換反応の方が起こりやすく開環しにくい(付加反応が起こると安定した状態が崩れてしまう場合が多い)。
❺ ベンゼン環が複数繋がる場合がある
- ベンゼン環を2つ繋げてできた化合物をナフタレンC10H8、3つ繋げてできた化合物をアントラセンC14H10という。
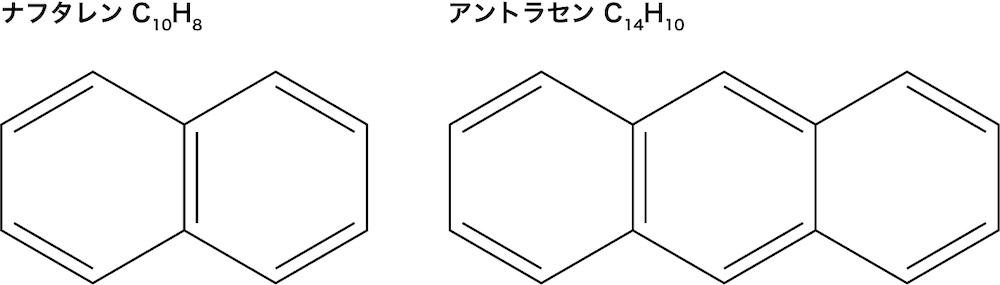
- ナフタレンの分子結晶は昇華性をもつ。
ベンゼンの製法
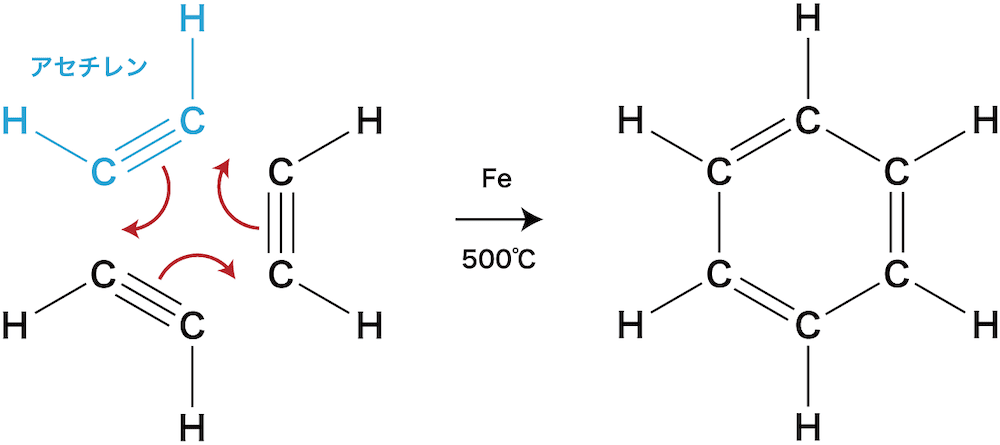
- ベンゼンはアルキンであるアセチレン三分子の重合反応により合成される。
参考:アルキン(一般式の作り方・一覧・製法・付加重合・置換反応など)
- アセチレンの三重結合のうち、一本が切れて隣のCと結合をつくっている。
ベンゼンの反応①(付加反応)
- ベンゼンの反応は環を破壊して行われる「付加反応(と酸化反応)」と、環を保存したまま行われる「置換反応」に分けることができる。
- まずは、付加反応の方から解説する。
- ベンゼンの環構造を特殊な条件により破壊することで、新たな原子(官能基)を付加する反応を付加反応という。
水素付加
- ニッケルNiやパラジウムPd、白金Ptなどを触媒として高温高圧下でベンゼンに水素を付加させるとシクロヘキサンが生成する。
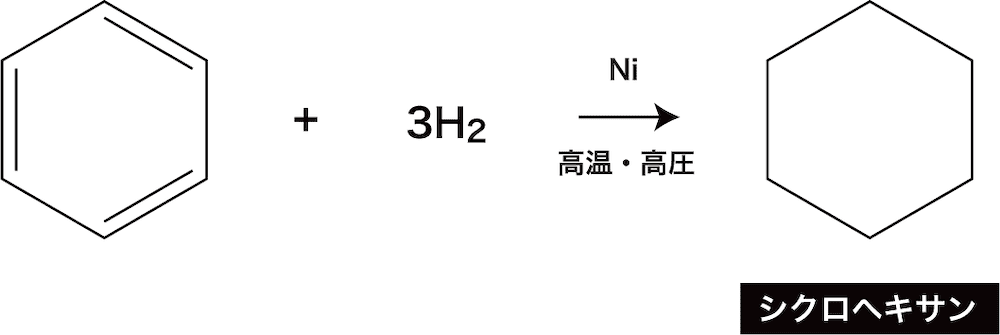
- この反応はアルケン(一般式の作り方・一覧・命名法・製法・付加反応など)で紹介している”接触還元”の一種と考えることができる。
塩素付加
- ベンゼンに光や紫外線を照射して塩素を付加させるとベンゼンへキサクロリド(ヘキサクロロシクロヘキサン)が生成する。
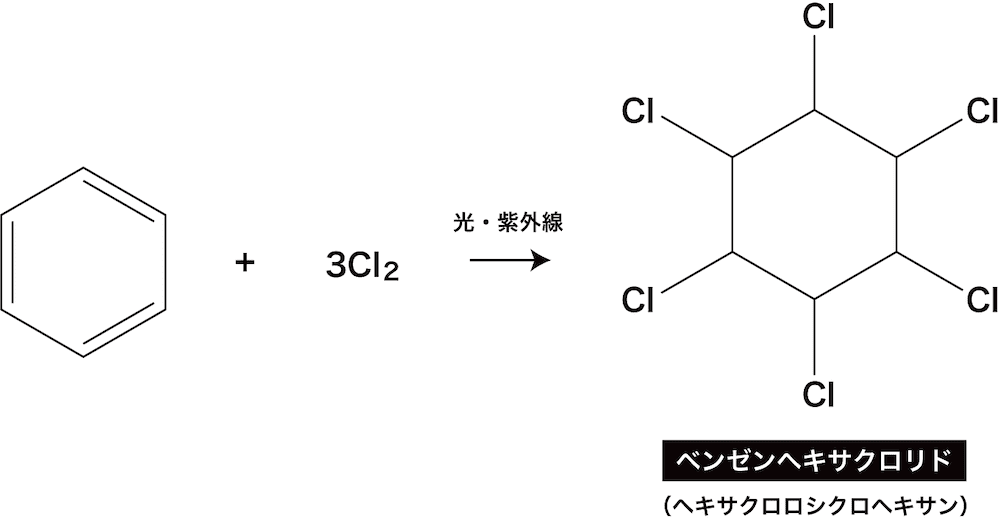
ベンゼンヘキサクロリドは以前農薬として用いられていました。後に生体内への蓄積性が高いことがわかり、現在日本では使用されていません。
ベンゼンの反応②(酸化反応)
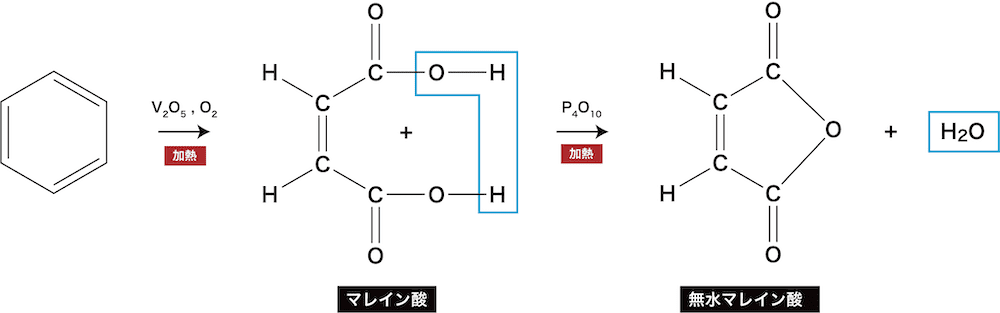
- ベンゼンは一般的な酸化剤(KMnO4・K2Cr2O7など)に対しては安定だが、酸化バナジウム(Ⅴ)V2O5を触媒として空気(O2)酸化すると開環してジカルボン酸の無水物となる。
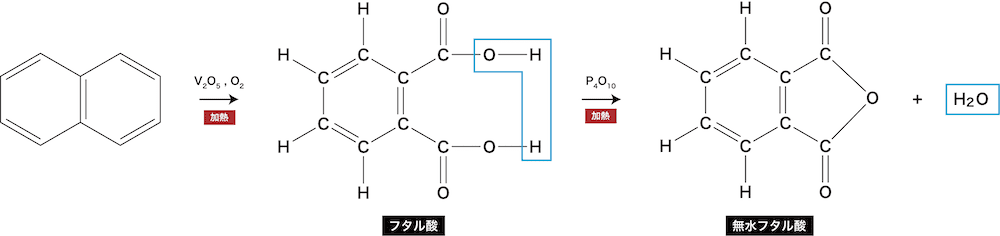
ベンゼンの反応③(置換反応)
- ベンゼンがもつ1つの水素H原子が他の原子(官能基)と置き換わる反応を置換反応という。
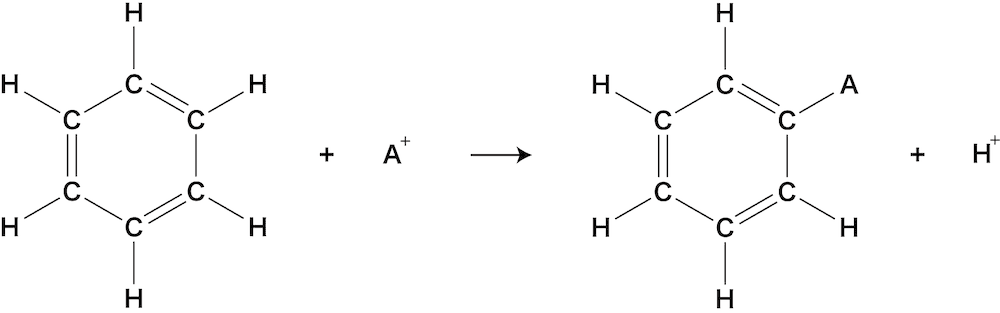
ニトロ化
- ベンゼンに存在するH原子とニトロ基が置き換わる反応をベンゼンのニトロ化という。
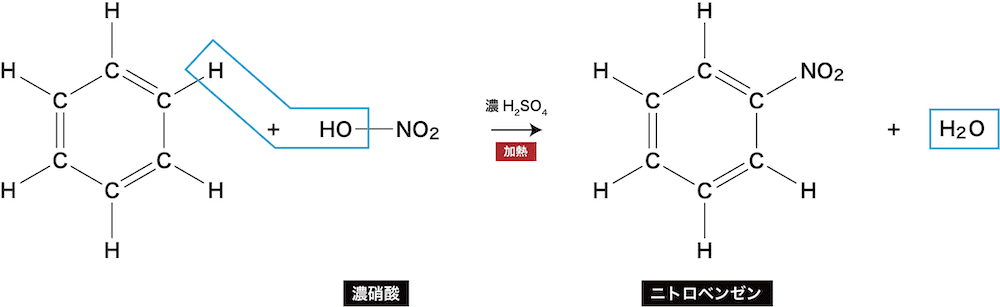
- ベンゼンを濃硝酸と濃硫酸の混合物(=混酸)と反応させると、淡黄色油状物質のニトロベンゼンが生じる。
ベンゼンと濃硝酸が脱水縮合しているイメージです。
※純粋なニトロベンゼンは無色だがほとんどの場合不純物が混じり淡い黄色になっている
※ニトロベンゼンは甘い香りを持つ液体で、水に溶けにくい中性物質である
※ニトロベンゼンの密度は1.2g/mLであり、水よりも重い
ベンゼンのニトロ化の原理
- ベンゼンのニトロ化の細かな流れを示す。
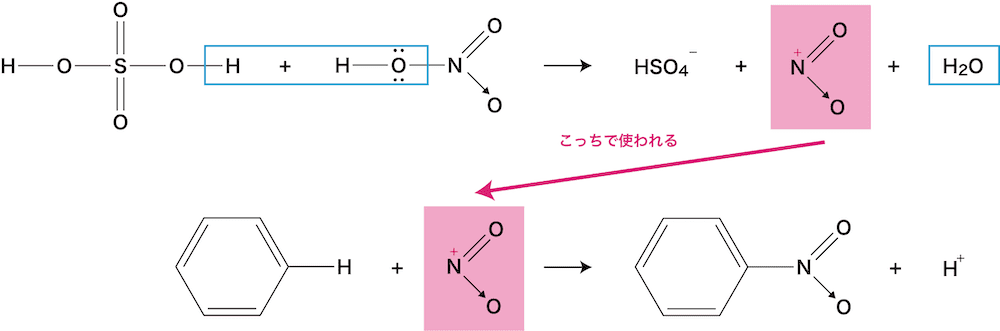
- H2SO4のH+はHNO3に渡っているが、最終的に再度H+が生じているため、濃硫酸はベンゼンのニトロ化において触媒として機能しているといえる。
スルホン化
- ベンゼンに存在するH原子とスルホ基が置き換わる反応をベンゼンのスルホン化という。
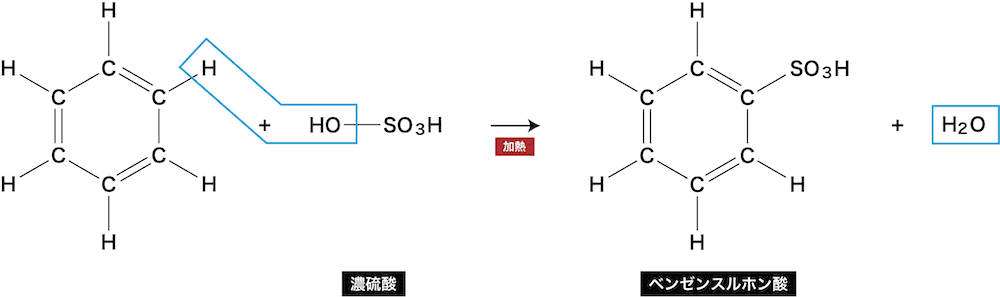
- ベンゼンを濃硫酸や発煙硫酸と反応させると、ベンゼンスルホン酸が生じる。
※ベンゼンスルホン酸は無色の結晶である
※(芳香族化合物としては珍しく)電離するため水によく溶ける(強酸性)
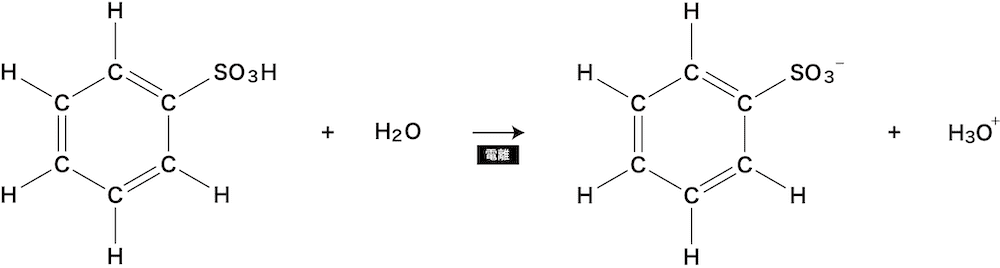
ベンゼンのスルホン化の原理
- ベンゼンのスルホン化の細かな流れを示す。
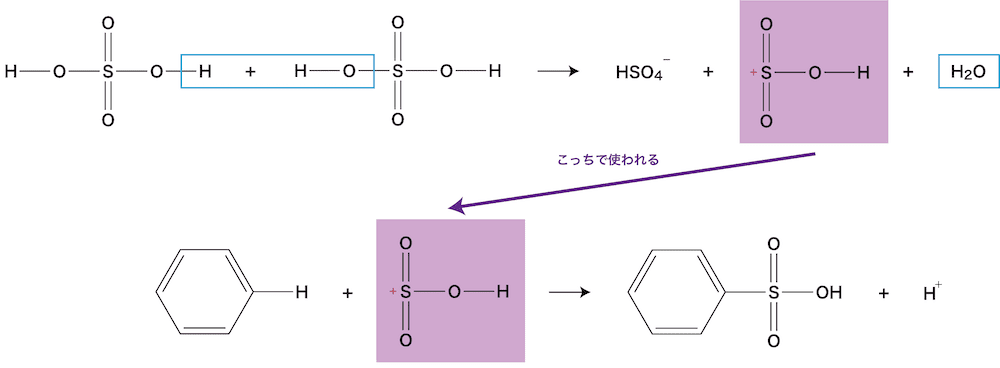
- H2SO4はH+を別のH2SO4に渡し、最終的に再度H+が生じている。
- 反応物であるH2SO4自身が触媒としてもはたらくイメージである。
アルキル化
- ベンゼンに存在するH原子とアルキル基(メチル基・エチル基など)が置き換わる反応をベンゼンのアルキル化という。
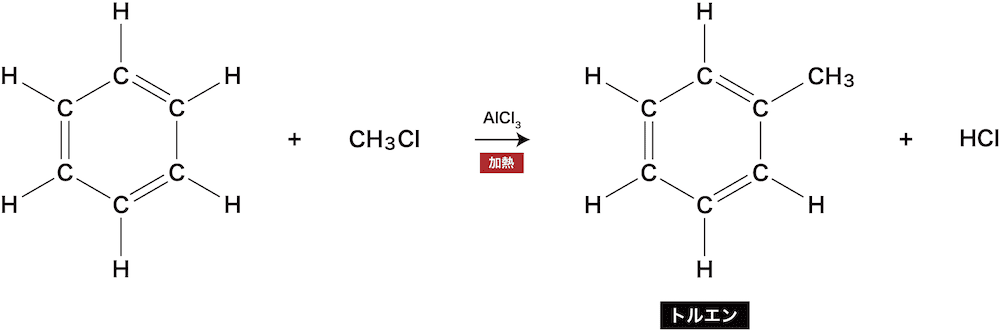
- ベンゼンと塩化メチルを反応させると、トルエンが生じる。
ベンゼンのアルキル化の原理
- ベンゼンのアルキル化の細かな流れを示す。
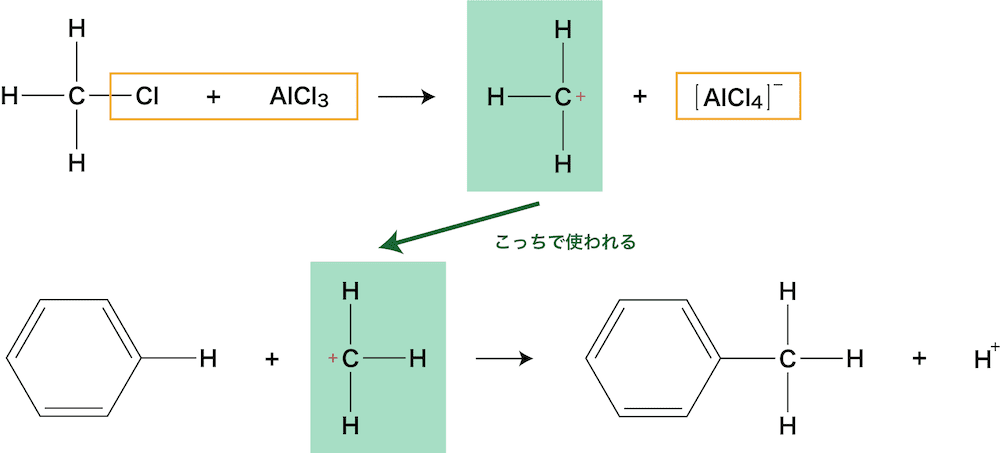
- 塩化メチルがAlCl3と反応して生じた陽イオンがベンゼンを攻撃し、置換反応が起こる。
- ちなみに、最後に生じたH+は[AlCl4]ーと反応し、HClとAlCl3が生じる。AlCl3は元に戻るので触媒といえる。
\[ \mathrm{H^{+}+[AlCl_{4}]^{–}→HCl+AlCl_{3}} \]
ハロゲン化
- ベンゼンに存在するH原子とハロゲン原子が置き換わる反応をベンゼンのハロゲン化という。
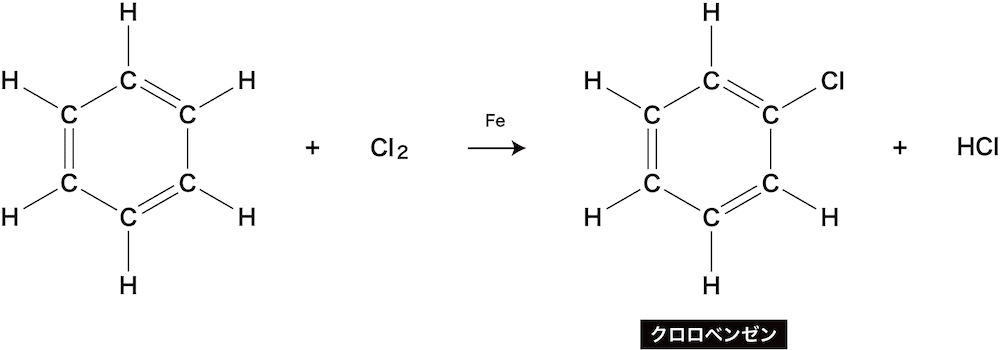
- ベンゼンが塩素と反応するとクロロベンゼンが生じる。
ベンゼンのハロゲン化の原理
- ベンゼンのハロゲン化の細かな流れを示す。
- まず、鉄が塩素と反応して塩化鉄(Ⅲ)が生じる。
\[ \mathrm{2Fe+3Cl_{2}→2FeCl_{3}} \]
- FeCl3は、アルキル化でのAlCl3と同様に触媒として作用する。















