MENU
ケイ素の単体と化合物の性質・製法
目次
はじめに
【プロ講師解説】このページでは『ケイ素の単体と化合物の性質・製法』について解説しています。
ケイ素の単体
- ケイ素Siの単体の特徴は次の通りである。
●ケイ素Siの単体の特徴
- 天然に存在しない
- 工業的製法:ケイ砂をコークスとともに加熱する
- 共有結合結晶
- 硬く、融点が高い
- 非金属だが金属光沢がある
- 電気伝導性があり、半導体として用いられる
❶ 天然に存在しない
- ケイ素Siの単体は、天然に存在しない。
- したがって、酸化物である二酸化ケイ素SiO2を還元してつくる必要がある。
❷ 工業的製法:ケイ砂をコークスとともに加熱する
- ケイ素の工業的製法では、ケイ砂(主成分:二酸化ケイ素SiO2)をコークスCとともに加熱する。
\[ \mathrm{SiO_{2} + 2C → Si + 2CO} \]
- このとき得られる粗製のケイ素(不純物を含むケイ素)を精製することで、純度の高いケイ素の単体を得る。
ケイ素の実験室的製法
- ケイ素Siの実験室的製法では、二酸化ケイ素SiO2にマグネシウムMgを加えて加熱する。
\[ \mathrm{SiO_{2}+2Mg→Si+2MgO} \]
カーボランダム
- ケイ砂に過剰のコークスを加え、加熱すると次のような反応が起こる。
\[ \mathrm{SiO_{2}+3C→SiC+2CO} \]
- このとき得られる炭化ケイ素SiCをカーボランダムという。
- カーボランダムはSiとCが交互に共有結合結合したダイヤモンド型の結晶である。極めて硬いため、研磨剤などとして用いられる。
❸ 共有結合結晶
- ケイ素の単体は、繰り返し構造をした共有結合結晶(高分子)であり、組成式Siで表される。
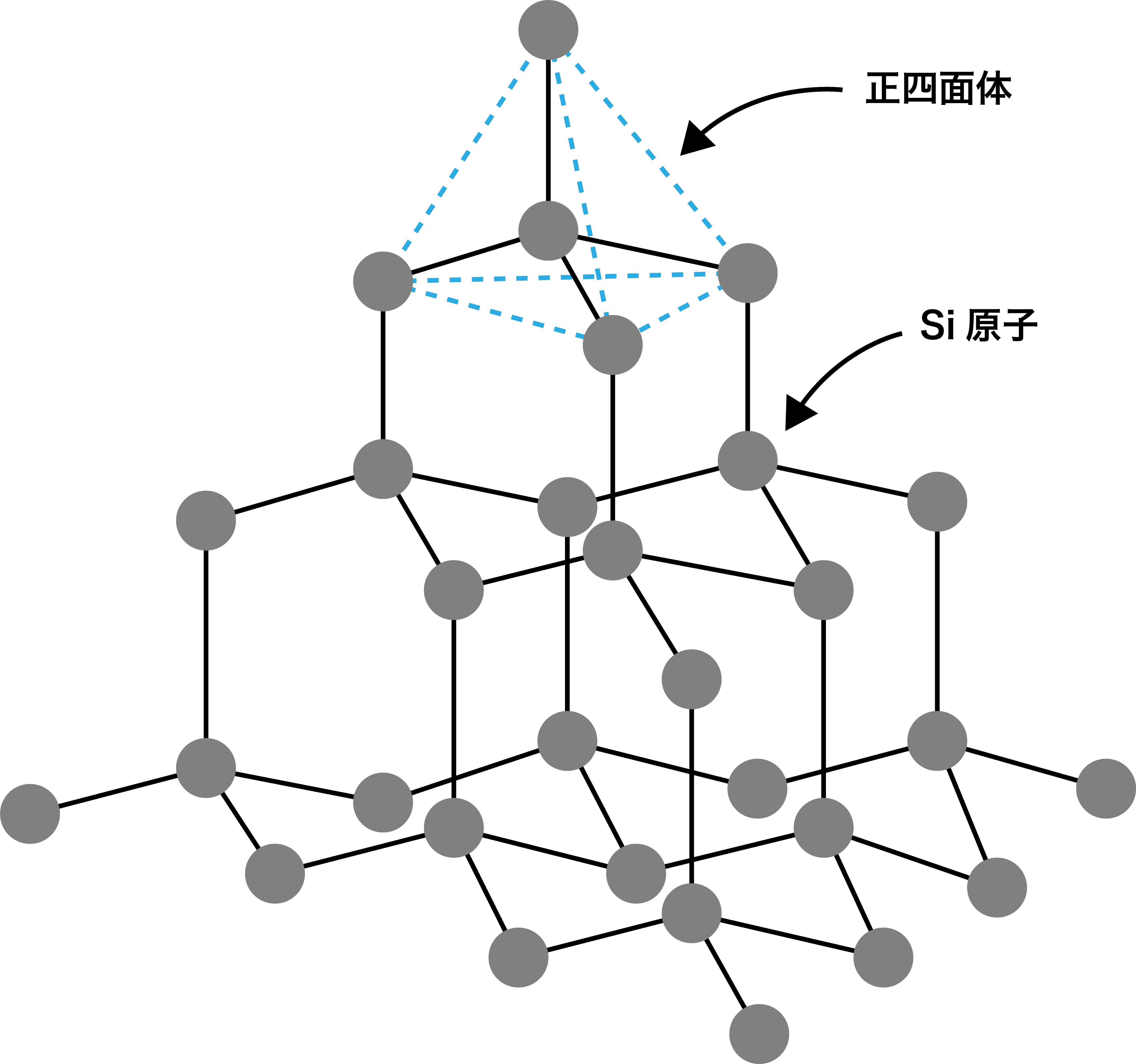
- 高校化学において共有結合結晶の形をとる重要な物質は『Si/SiO2/SiC/C』の4つである。ケイ素を含め、全て覚えておくようにしよう。
参考:共有結合結晶(例・特徴・性質・組成式・融点・電気伝導性など)
❹ 硬く、融点が高い
- ケイ素の単体は共有結合結晶であり、結合が強く切れにくいので、硬く、融点が高い。
参考:【化学結晶まとめ】構成粒子や結合の強さ、電気陰性度、融点、硬さなど
❺ 非金属だが金属光沢がある
- ケイ素の単体は、非金属だが金属光沢をもつ。
❻ 電気伝導性があり、半導体として用いられる
- ケイ素の単体はわずかだが電気伝導性がある。
- したがって、高純度なものは半導体として、電化製品などに用いられる。
二酸化ケイ素SiO2
- 二酸化ケイ素SiO2の特徴は次の通りである。
●二酸化ケイ素SiO2の特徴
- 単体同様、繰り返し構造をした共有結合結晶で、組成式で表される
- 石英/水晶/ケイ砂として天然に存在
- 酸性酸化物であり、塩基と中和反応する
- ガラスとして用いられる
- フッ化水素酸に溶解する
❶ 単体同様、繰り返し構造をした共有結合結晶で、組成式で表される
- 二酸化ケイ素SiO2は単体と同様、繰り返し構造をした共有結合結晶として存在し、高分子であるため組成式で表される。
参考:共有結合結晶(例・特徴・性質・組成式・融点・電気伝導性など)
二酸化ケイ素の組成式
- 二酸化ケイ素の組成式はSiO2だが、ここに疑問を感じる学生がいる。
- 二酸化ケイ素の結晶は、SiO4の正四面体が基本構造となっている。
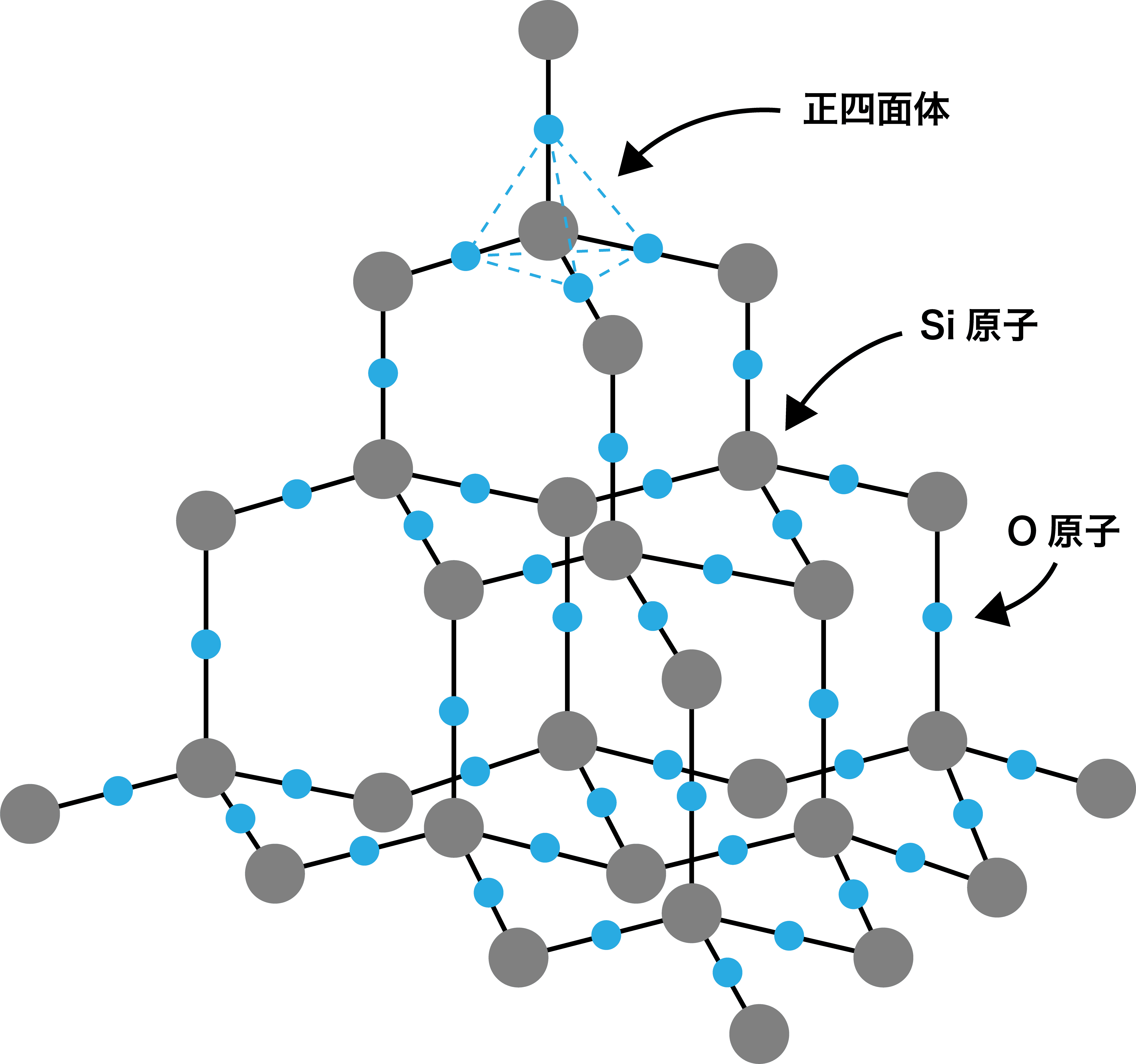
- しかし、4個の酸素O原子は2個のケイ素Si原子で共有されており、Si原子1個あたりのO原子は2個と考えることができるため、組成式はSiO2となる。
❷ 石英/水晶/ケイ砂として天然に存在
- 二酸化ケイ素は主に石英として岩石中に存在している。
- また、石英より大きく透明な結晶を水晶、石英が砂状になったものをケイ砂という。
❸ 酸性酸化物であり、塩基と中和反応する
- 二酸化ケイ素SiO2は酸性酸化物である。したがって、水酸化ナトリウムNaOHや炭酸ナトリウム Na2CO3などの塩基と中和反応をする。
\[ \mathrm{SiO_{2} + 2NaOH → Na_{2}SiO_{3} + H_{2}O}\\
\mathrm{SiO_{2}+ Na_{2}CO_{3}→ Na_{2}SiO_{3}+CO_{2}} \]
- このとき、ケイ素を含む塩であるケイ酸ナトリウムNa2SiO3が生じる。
参考:酸性酸化物・塩基性酸化物・両性酸化物(違い・見分け方・一覧・反応など)
❹ ガラスとして用いられる
- 二酸化ケイ素SiO2は多くのガラスに主成分として含まれる。
- また、二酸化ケイ素を高温で加熱し融解させた後、冷やしてつくられるガラスを石英ガラスという。石英ガラスはSiO2の純度が極めて高い。
❺ フッ化水素酸に溶解する
- 二酸化ケイ素SiO2は、共有結合結晶であり、非常に安定しているため、反応性に乏しい。
- しかし、フッ化水素酸HFとは次のような錯イオン形成反応を起こし、溶解する。
\[ \mathrm{SiO_{2} + 6HF → H_{2}SiF_{6} + 2H_{2}O} \]
- この性質から、フッ化水素酸はガラス(主成分:SiO2)の容器に保存できないため、ポリエチレンなどガラス以外の容器に保存する。
ケイ酸ナトリウムNa2SiO3
- ケイ酸ナトリウムNa2SiO3の特徴は次の通りである。
●ケイ酸ナトリウムNa2SiO3の特徴
- 繰り返し構造をした高分子化合物で、組成式で表される
- 水を加えて加熱すると加水分解し、粘性をもつ水ガラスになる
- 工業的製法:二酸化ケイ素に炭酸ナトリウムを加えて加熱する
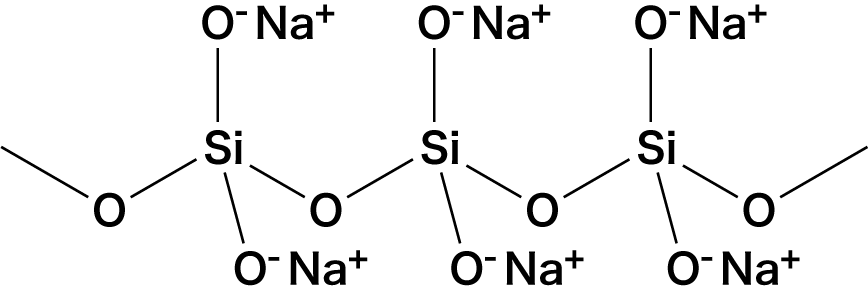
❶ 繰り返し構造をした高分子化合物で、組成式で表される
- ケイ酸ナトリウムNa2SiO3は、繰り返し構造をした高分子化合物で、組成式を用いて表される。
❷ 水を加えて加熱すると加水分解し、粘性をもつ水ガラスになる
- ケイ酸ナトリウムNa2SiO3に水を加えて加熱することで加水分解し、粘性をもつ液体になる。この液体を水ガラスという。
水ガラス
- ケイ酸ナトリウムNa2SiO3は塩であるにもかかわらず、水への溶解度が低い。これは、SiO32-が長鎖状の分子であり、水中に拡散しにくいためである。

- また、この分子は水中において曲がりくねった状態で存在しており、これが原因で粘性をもった液体となる(水ガラス)。
- 水ガラスを空気中に放置すると、ケイ酸H2SiO3が生じる。
\[ \mathrm{Na_{2}SiO_{3}+H_{2}O+CO_{2}→Na_{2}CO_{3}+H_{2}SiO_{3} }\]
- H2SiO3は、脱水すると二酸化ケイ素SiO2となり、固まる。
\[ \mathrm{H_{2}SiO_{3}→H_{2}O+SiO_{2} }\]
- Na2SiO3はこの性質を生かし、接着剤や土壌硬化剤として用いられる。
❸ 工業的製法:二酸化ケイ素に炭酸ナトリウムを加えて加熱する
- ケイ酸ナトリウムNa2SiO3は、二酸化ケイ素SiO2に炭酸ナトリウムNa2CO3を加えて加熱することで得られる。(中和反応)
\[ \mathrm{SiO_{2} + Na_{2}CO_{3} → Na_{2}SiO_{3} + CO_{2}} \]
ケイ酸H2SiO3
- ケイ酸H2SiO3の特徴は次の通りである。
●ケイ酸H2SiO3の特徴
- 製法:水ガラスの水溶液に塩酸を反応させる
- 脱水するとシリカゲルになる
❶ 製法:水ガラスの水溶液に塩酸を反応させる
- ケイ酸H2SiO3は、水ガラス(ケイ酸ナトリウムNa2SiO3)の水溶液に塩酸HClを反応させることで得る。
\[ \mathrm{Na_{2}SiO_{3} + 2HCl → 2NaCl + H_{2}SiO_{3} }\]
- このとき得られるH2SiO3は白色のゲル状沈殿である。
❷ 脱水するとシリカゲルになる
- ケイ酸H2SiO3を加熱・脱水して得られる固体をシリカゲルSiO2・nH2Oという。
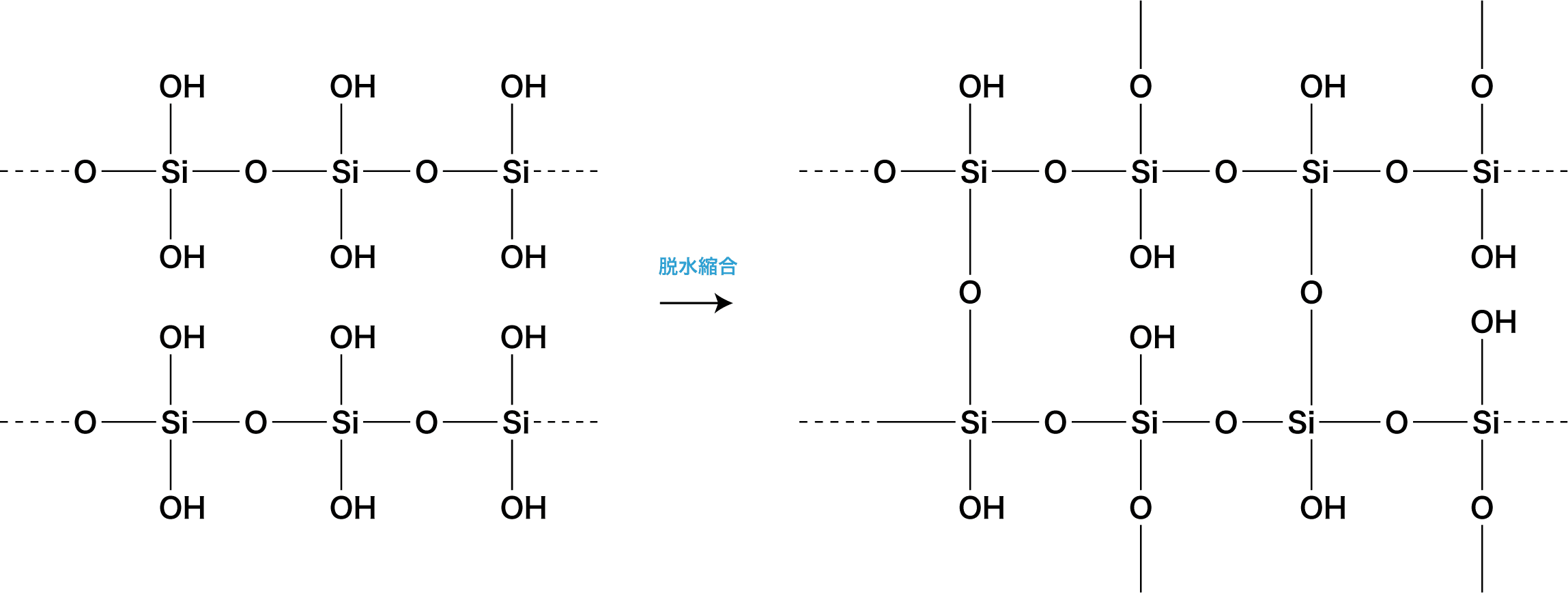
- シリカゲルはケイ酸に比べて空洞が多く(多孔質)、また親水基であるヒドロキシ基-OHが豊富なため、水素結合により気体中の水分を吸着しやすい。したがって、乾燥剤や吸着剤として用いられる。
- また、シリカゲルを適度に加熱すると、吸着した水分が取れ、再利用することができる。
ケイ素化合物の関係性
- 最後に、二酸化ケイ素SiO2・ケイ酸ナトリウムNa2SiO3・水ガラス・ケイ酸H2SiO3・シリカゲルの関係をまとめると上のようになる。

セラミックス
- 地殻を構成する岩石の多くは、ケイ酸塩を含む。
- ケイ酸塩を利用した工業をケイ酸塩工業(窯業)という。
- ケイ酸塩工業でつくられる工業製品には、ガラス・セメント・陶器・磁器などがあり、これらを総称してセラミックス(窯業製品)という。
ガラス
- 現在最も広く利用されているガラスの1つであるソーダ石灰ガラスは、ケイ砂SiO2・石灰石CaCO3・炭酸ナトリウムN a2CO3などの粉末を高温で熱してつくられる。
土器・陶器・磁器
- 粘土と水を混ぜて練り、低温で焼いたものを土器、高温で焼いたものを陶器、さらに高温で焼いたものを磁器という。
ファインセラミックス
- セラミックスのうち、高度に精製されたり、人工合成された原料を用いたりしてつくられたものをファインセラミックス(ニューセラミックス)という。
- ファインセラミックスは医療(歯・骨)や最新の燃料電池などに用いられる。














