MENU
中和と中性の違いって何?pH7が中和点とは限らない理由を解説!
目次
はじめに
【プロ講師解説】このページでは『中和と中性の違いって何?pH7が中和点とは限らない理由を解説!』について解説しています。
中性とは
- 溶液のpHが”ちょうど7”の状態を中性という。
- ちなみに、pHが7より小さい場合は酸性、7より大きい場合は塩基性という。
中和とは
- 中和とは酸と塩基がお互いの性質を打ち消しあうことである。
- 中和が起こった結果、塩と水が生じる。
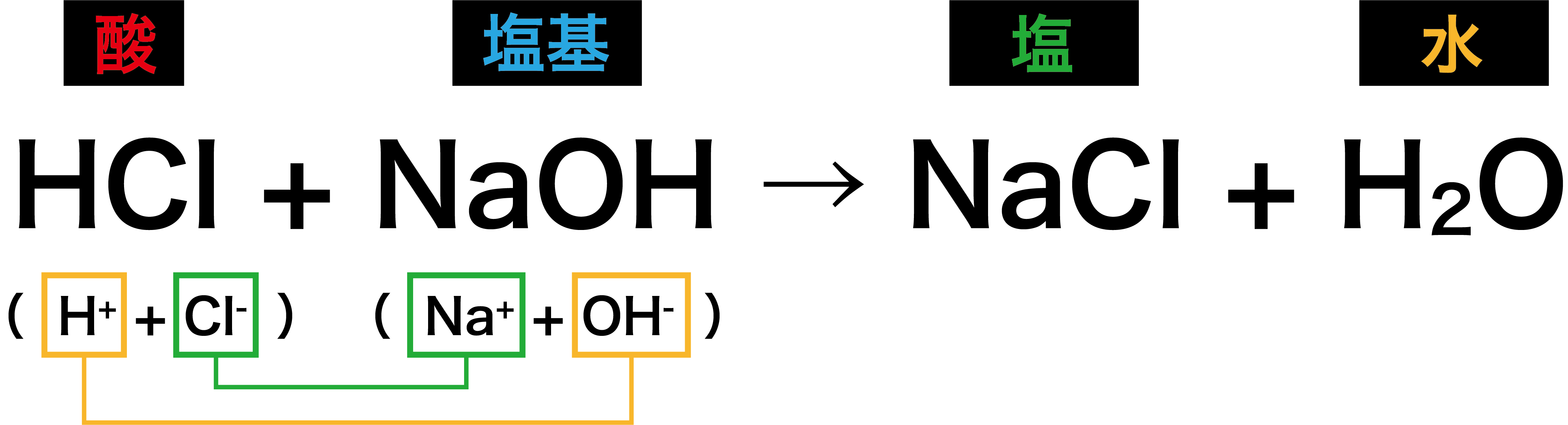
中和と中性の違い
- 中和と中性の違いは「中性はpHが7、中和はpHが7とは限らない」という点である。
- 中和反応の結果生じる「塩」には水に溶けて酸性や塩基性を示すものが存在する。
例)酢酸ナトリウムCH3COONa+水H2O
\[ \mathrm{CH_{3}COONa + H_{2}O ⇄ CH_{3}COOH + NaOH} \]
- CH3COONa(塩)とNaOH(強塩基)は電離度が大きいため完全に電離するが、H2OとCH3COOH(弱酸)は電離度が小さくほぼ電離しない。したがって、次のように考えることができる。
\[ \begin{align}&\mathrm{CH_{3}COO^{-} + \cancel{Na^{+}} + H_{2}O ⇄ CH_{3}COOH + \cancel{Na^{+}} + OH^{-}} \\
&\mathrm{↔︎ CH_{3}COO^{-} + H_{2}O ⇄ CH_{3}COOH + \underbrace{ OH^{-} }
_{ \text{ 塩基性 } }} \end{align}\]
- Na+は両辺に存在するので消すことができる。また、OHーが存在するため結果的に水溶液の液性は塩基性となる。
- このように、中和で生じた塩が最終的に水に溶けて(中性ではなく)酸性や塩基性を示す場合があるため、中和したからといって、必ずしもpH=7(中性)にはならない。
中和と中性の違いまとめ
この『中和と中性の違いって何?pH7が中和点とは限らない理由を解説!』のページで解説した内容をまとめる。
- 溶液のpHが”ちょうど7”の状態を中性という。
- 中和とは酸と塩基がお互いの性質を打ち消しあうことである。中和が起こった結果、塩と水が生じる。
- 中和と中性の違いは「中性はpHが7、中和はpHが7とは限らない」という点である。
- 中和反応の結果生じる「塩」には水に溶けて酸性や塩基性を示すものが存在する。














