MENU
電子配置(書き方・例題・電子を並べる順番やルール・覚え方など)
目次
はじめに
【プロ講師解説】このページでは『電子配置(書き方・例題・電子を並べる順番やルール・覚え方など)』について解説しています。
電子殻とは
- 原子の中心には原子核が、そのまわりには電子が存在する。
- このとき、電子の存在する場所(次図の黒い円)を電子殻という。
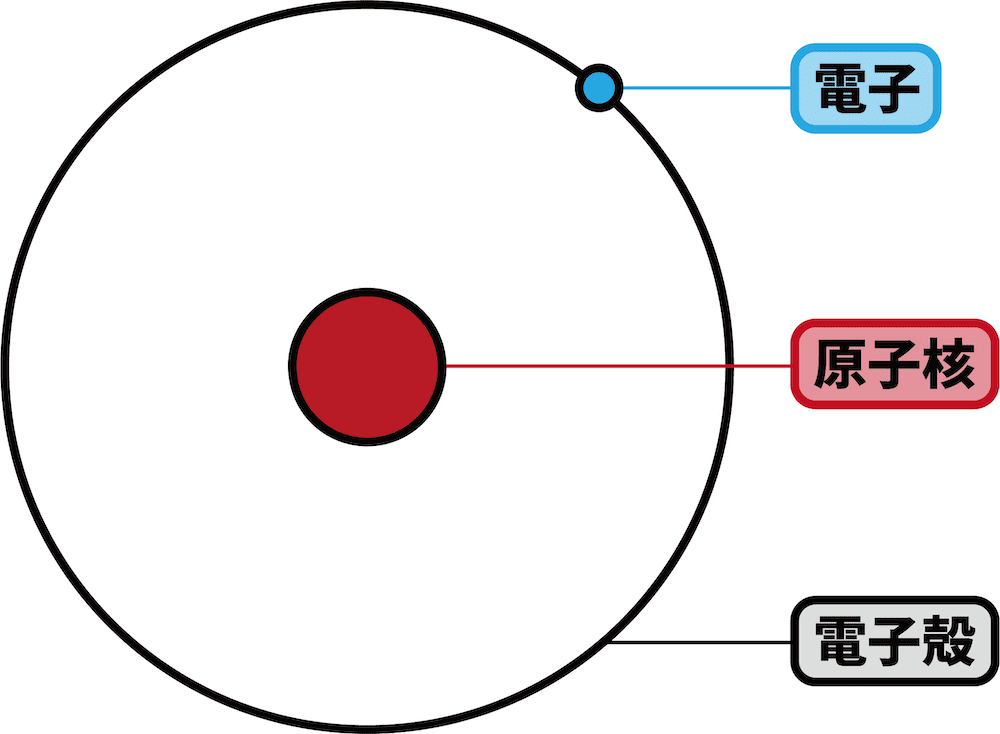
参考:【原子の構造】陽子・中性子・電子・原子核・質量数・原子番号の数と関係
- 電子殻は層になっており、内側から順にK殻、L殻、M殻、N殻という。
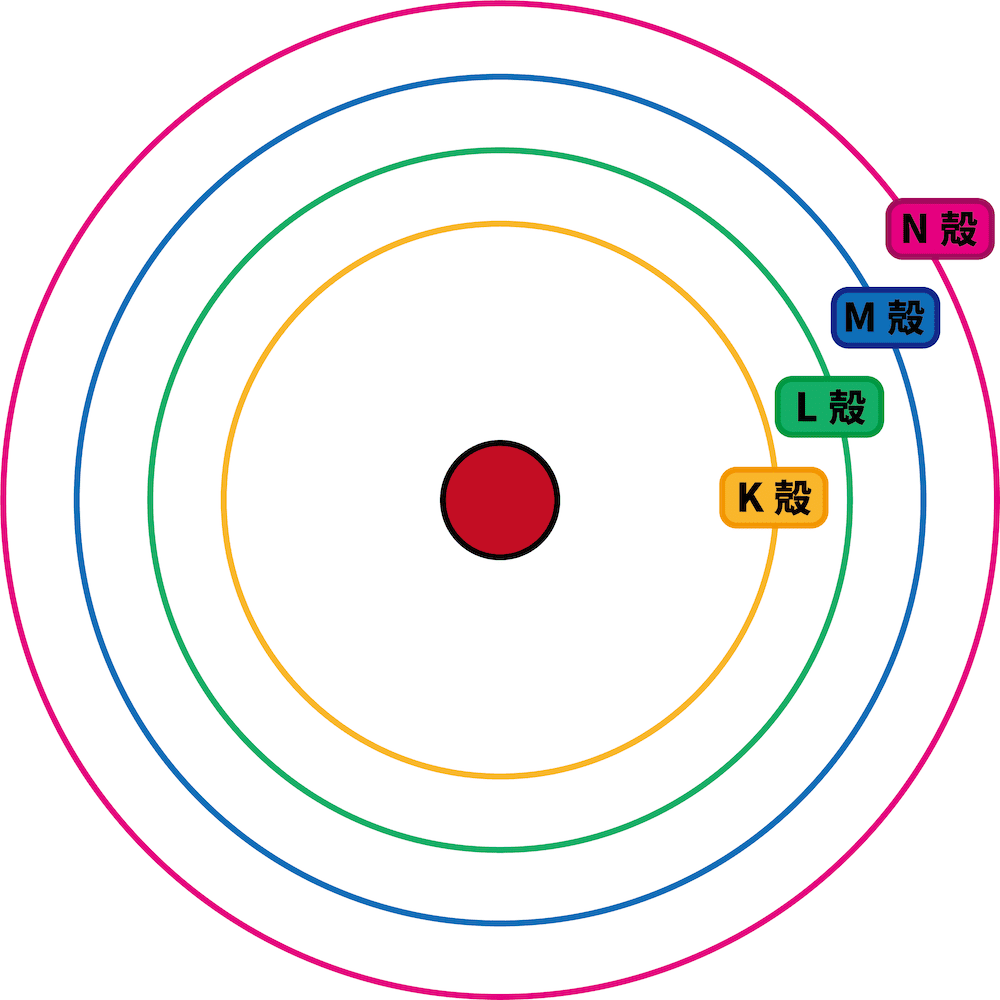
この表し方はデンマーク人のボーアが考えたもので、ボーアモデルとよばれます。
- それぞれの電子殻に入れることのできる電子の数は決まっている。内側からn番目の殻の最大収容電子数は2n2個である。
スクロールできます
| n | 1 | 2 | 3 | 4 | n |
| 電子殻 | K殻 | L殻 | M殻 | N殻 | ー |
| 最大収容電子数 | 2 | 8 | 18 | 32 | 2n2 |
テストのとき毎回一般式から考えると時間がないので、N殻までの最大収容電子数は暗記しておきましょう。
電子配置のルール
- 電子は次のルールにしたがって、電子殻に配置される。
●ルール1
内側の殻から順に入る
●ルール2
最外殻(最も外側の殻)の電子は8個まで
- 以降、具体例をあげながら、電子配置のルールを確認する。
1H・2Heの電子配置
- 1H・2He(第1周期の元素)の電子配置は次の通りである。
| 元素 | K殻 | 電子配置 |
|---|---|---|
| 1H | 1 |  |
| 2He | 2 |  |
- ルール1より、電子は内側のK殻から順に入る。1H・2Heでは、K殻に全ての電子が収まっている。
- 2Heでは、K殻が最大収容電子数(2個)に達している。このように、最外殻が満たされた状態を閉殻という。
3Li~10Neの電子配置
- 3Li~10Ne(第2周期の元素)の電子配置は次の通りである。
| 元素 | K殻 | L殻 | 電子配置 |
|---|---|---|---|
| 3Li | 2 | 1 | 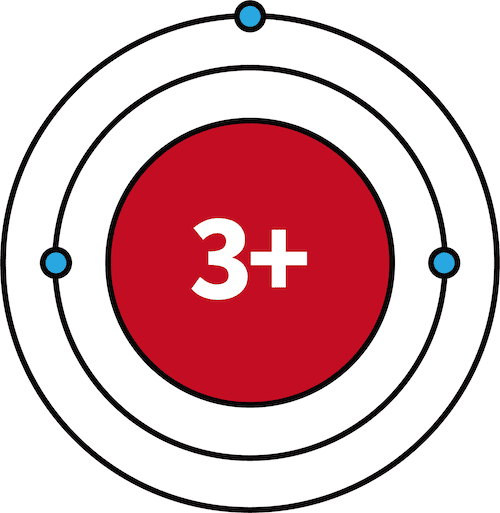 |
| 4Be | 2 | 2 | 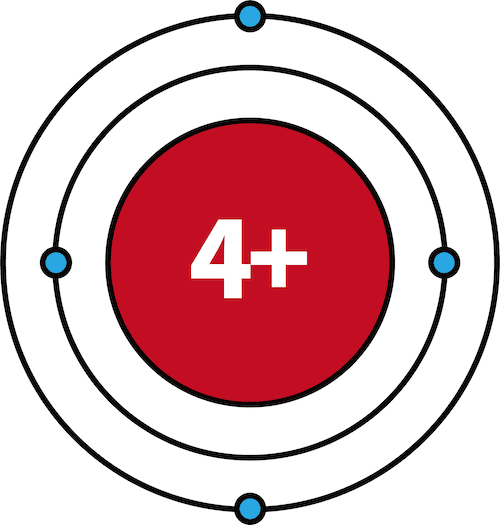 |
| 5B | 2 | 3 | 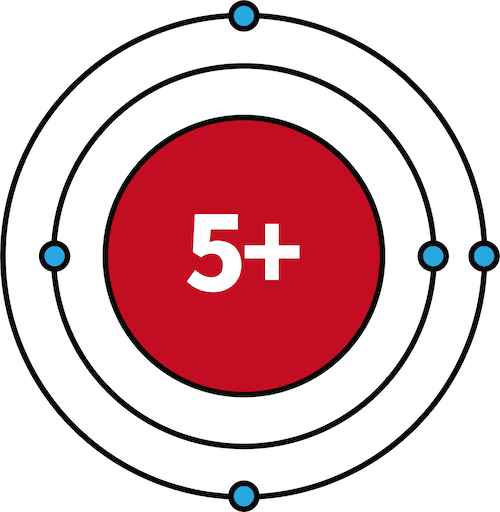 |
| 6C | 2 | 4 | 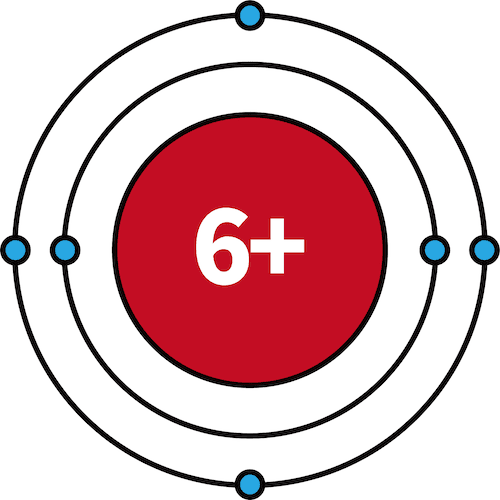 |
| 7N | 2 | 5 | 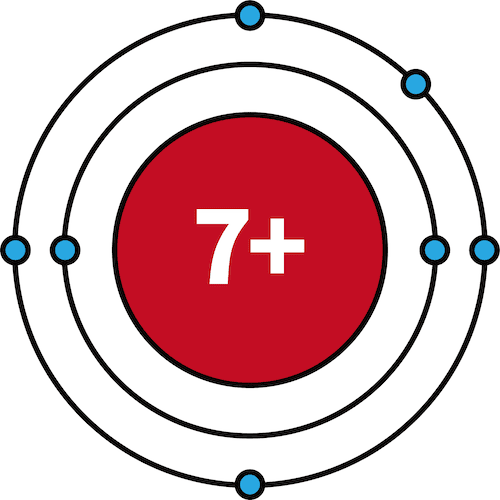 |
| 8O | 2 | 6 | 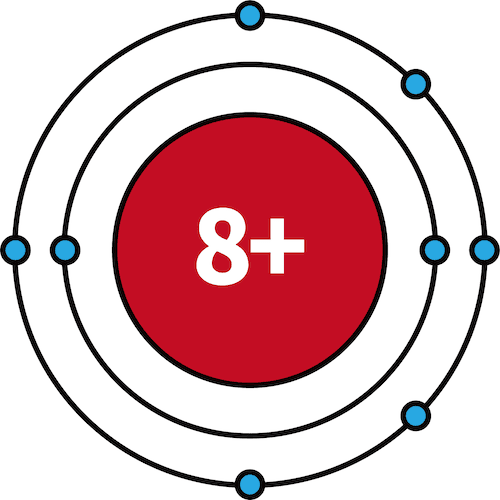 |
| 9F | 2 | 7 | 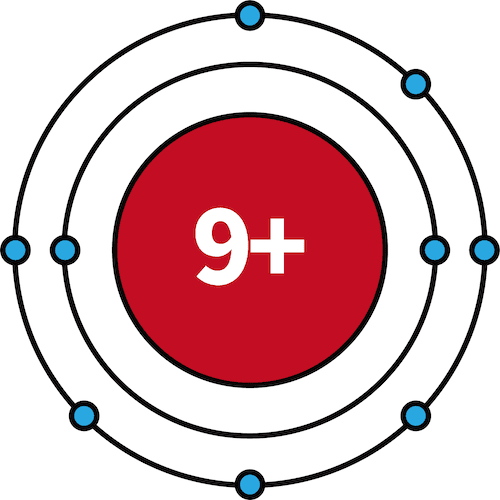 |
| 10Ne | 2 | 8 | 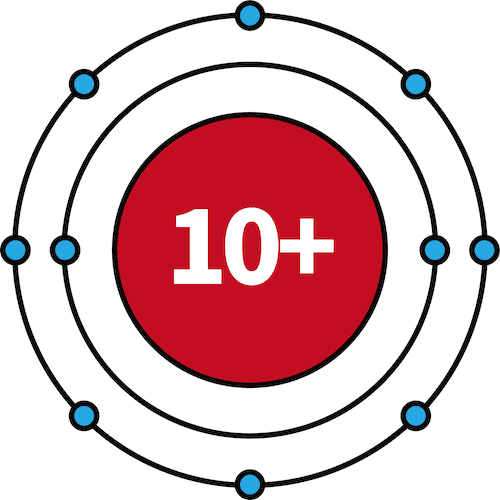 |
- 3Li~10Neでは、L殻に電子が収まっていく。
- 10Neは最外殻であるL殻が満たされており、閉殻である。
11Na~18Arの電子配置
- 11Na~18Ar(第3周期の元素)の電子配置は次の通りである。
スクロールできます
| 元素 | K殻 | L殻 | M殻 | 電子配置 |
|---|---|---|---|---|
| 11Na | 2 | 8 | 1 | 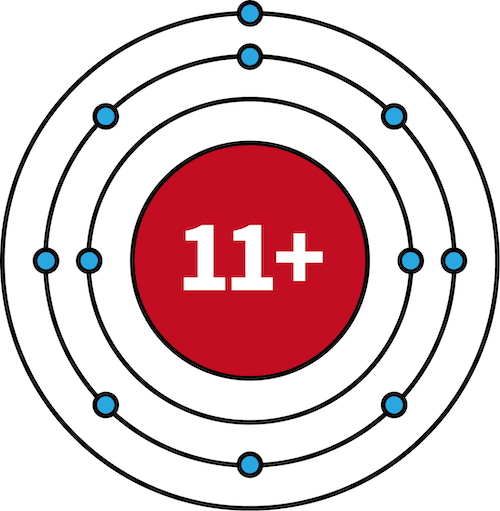 |
| 12Mg | 2 | 8 | 2 | 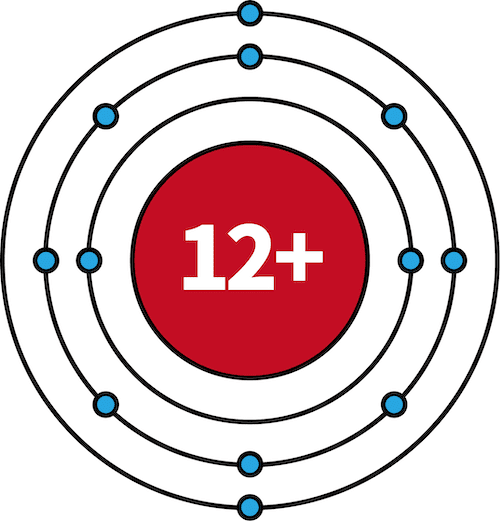 |
| 13Al | 2 | 8 | 3 | 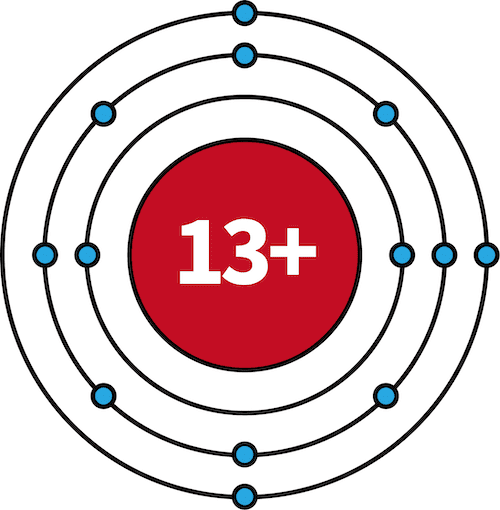 |
| 14Si | 2 | 8 | 4 | 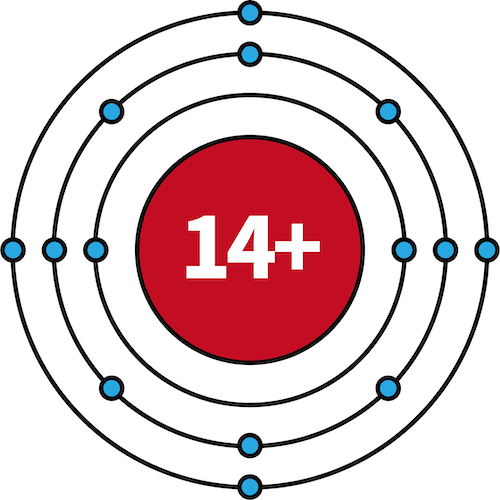 |
| 15P | 2 | 8 | 5 | 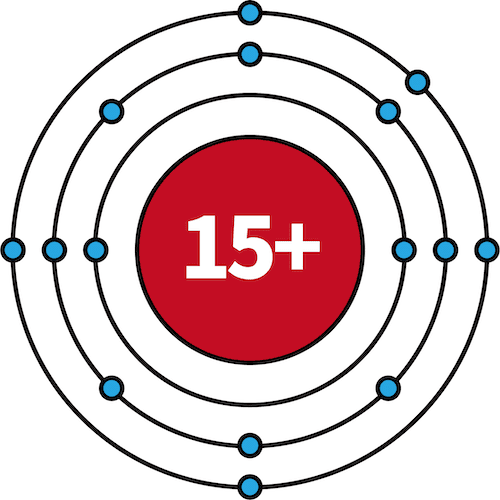 |
| 16S | 2 | 8 | 6 | 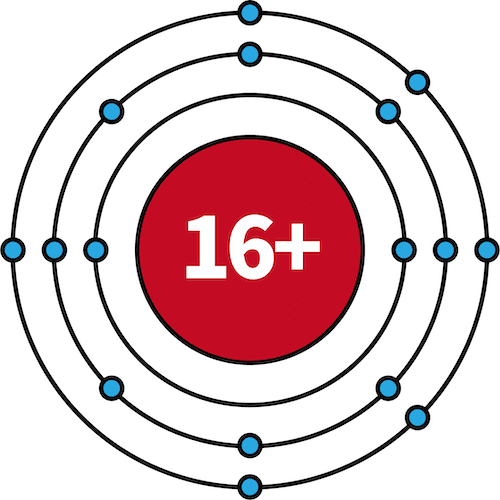 |
| 17Cl | 2 | 8 | 7 | 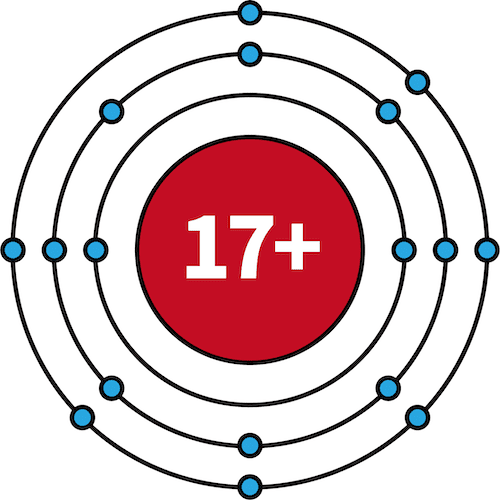 |
| 18Ar | 2 | 8 | 8 | 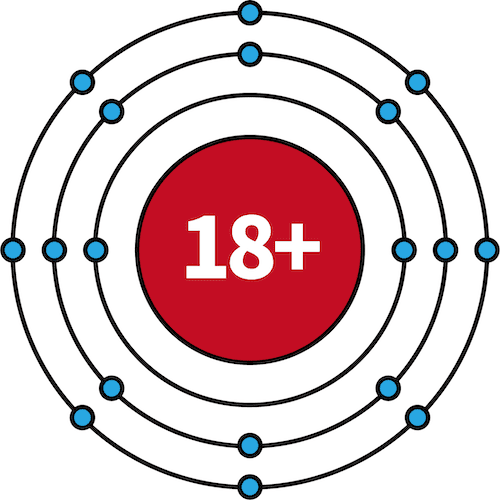 |
- 11Na~18Arでは、M殻に電子が収まっていく。
第3周期までの電子配置は全員必ず書けるようにしておきましょう。
19K・20Caの電子配置
- 19K・20Caの電子配置は次の通りである。
| 元素 | K殻 | L殻 | M殻 | N殻 |
|---|---|---|---|---|
| 19K | 2 | 8 | 8 | 1 |
| 20Ca | 2 | 8 | 8 | 2 |
- ルール2より、最外殻の電子は8個までであり、現段階でM殻にこれ以上の電子を入れることはできない。したがって、19K・20Caでは、N殻に電子が収まっていく。
21Sc~30Znの電子配置
- 21Sc~30Znの電子配置は次の通りである。
| 元素 | K殻 | L殻 | M殻 | N殻 |
|---|---|---|---|---|
| 21Sc | 2 | 8 | 9 | 2 |
| 22Ti | 2 | 8 | 10 | 2 |
| 23V | 2 | 8 | 11 | 2 |
| 24Cr | 2 | 8 | 13 | 1 |
| 25Mn | 2 | 8 | 13 | 2 |
| 26Fe | 2 | 8 | 14 | 2 |
| 27Co | 2 | 8 | 15 | 2 |
| 28Ni | 2 | 8 | 16 | 2 |
| 29Cu | 2 | 8 | 18 | 1 |
| 30Zn | 2 | 8 | 18 | 2 |
- 21Sc~30Znでは、M殻に電子が収まっていく(N殻が最外殻になったので、M殻に9個以上の電子を入れることができるイメージ)。
- 30Znは最外殻であるM殻が満たされており、閉殻である。
- 24Crと29Cuでは、M殻に1個の電子が収まるのに加えて、N殻から1個の電子がM殻に移動する。
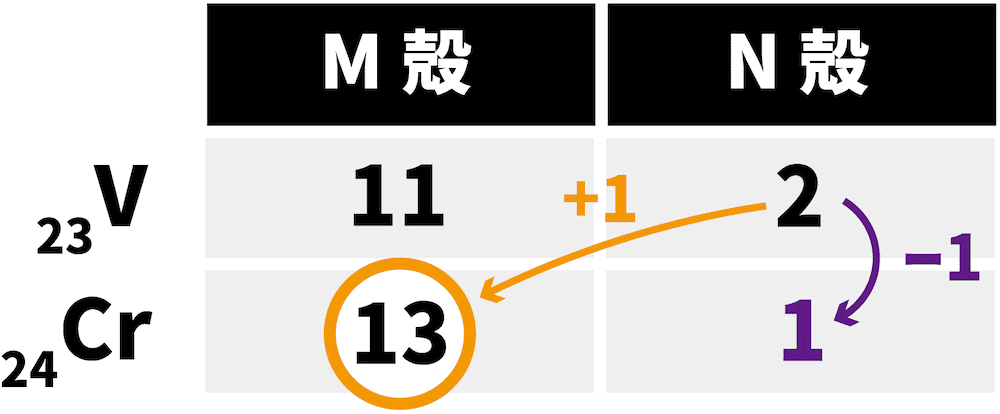
このあたりの電子配置を正確に理解するには、電子軌道の学習が必要です。本ページ下部で解説しますが、大学受験の範囲外です。
31Ga~36Krの電子配置
- 31Ga~36Krの電子配置は次の通りである。
| 元素 | K殻 | L殻 | M殻 | N殻 |
|---|---|---|---|---|
| 31Ga | 2 | 8 | 18 | 3 |
| 32Ge | 2 | 8 | 18 | 4 |
| 33As | 2 | 8 | 18 | 5 |
| 34Se | 2 | 8 | 18 | 6 |
| 35Br | 2 | 8 | 18 | 7 |
| 36Kr | 2 | 8 | 18 | 8 |
- 31Ga~36Krでは、N殻に電子が収まっていく。
電子軌道とは
- 電子殻は、電子を2個まで収容できる副殻から構成される。
- K殻は1個、L殻は4個、内側からn番目の殻はn2個の副殻からできている。
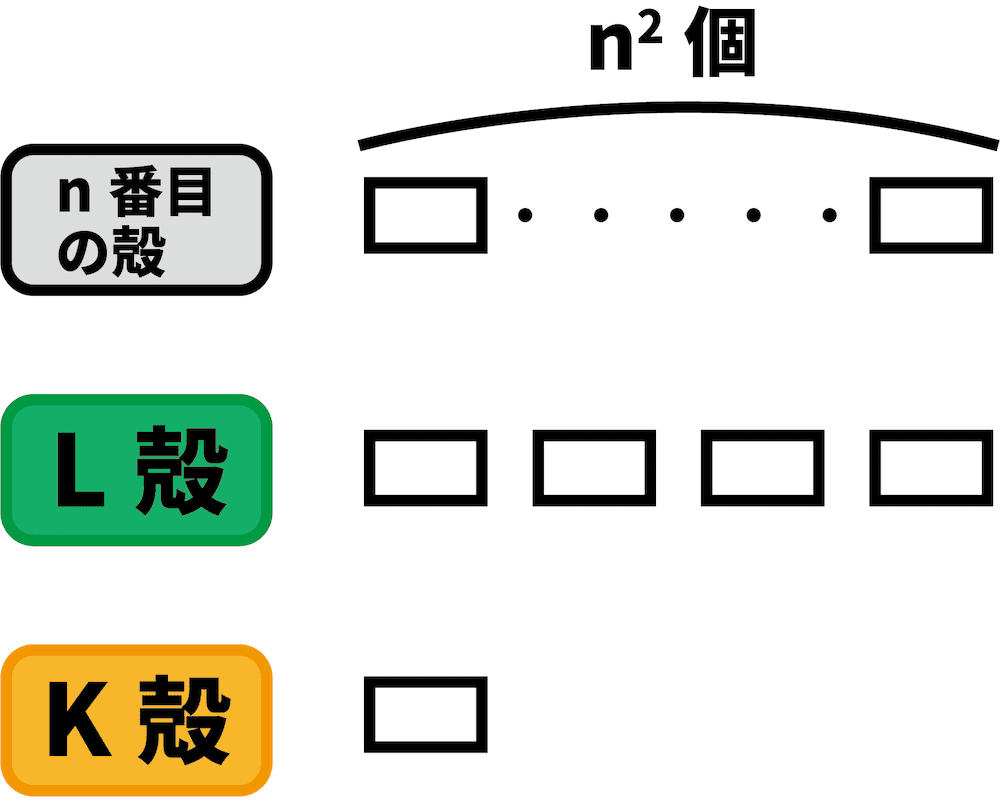
- 副殻は電子軌道ともいう。
- 1個の電子軌道には自転方向の異なる電子を2個まで収容できる。
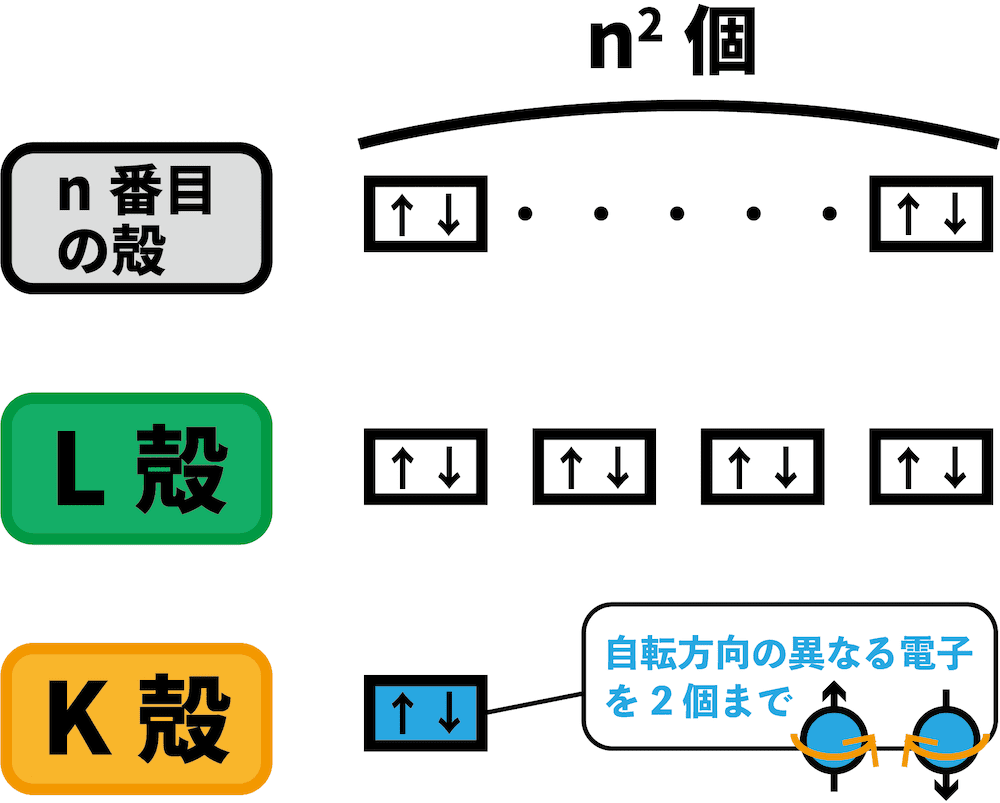
例えばL殻は4個の副殻からできており、(1個の副殻に収容できる電子の数は2個までなので、)全体で8個の電子を収容できます。
- K殻は、球形の1s軌道からなる。
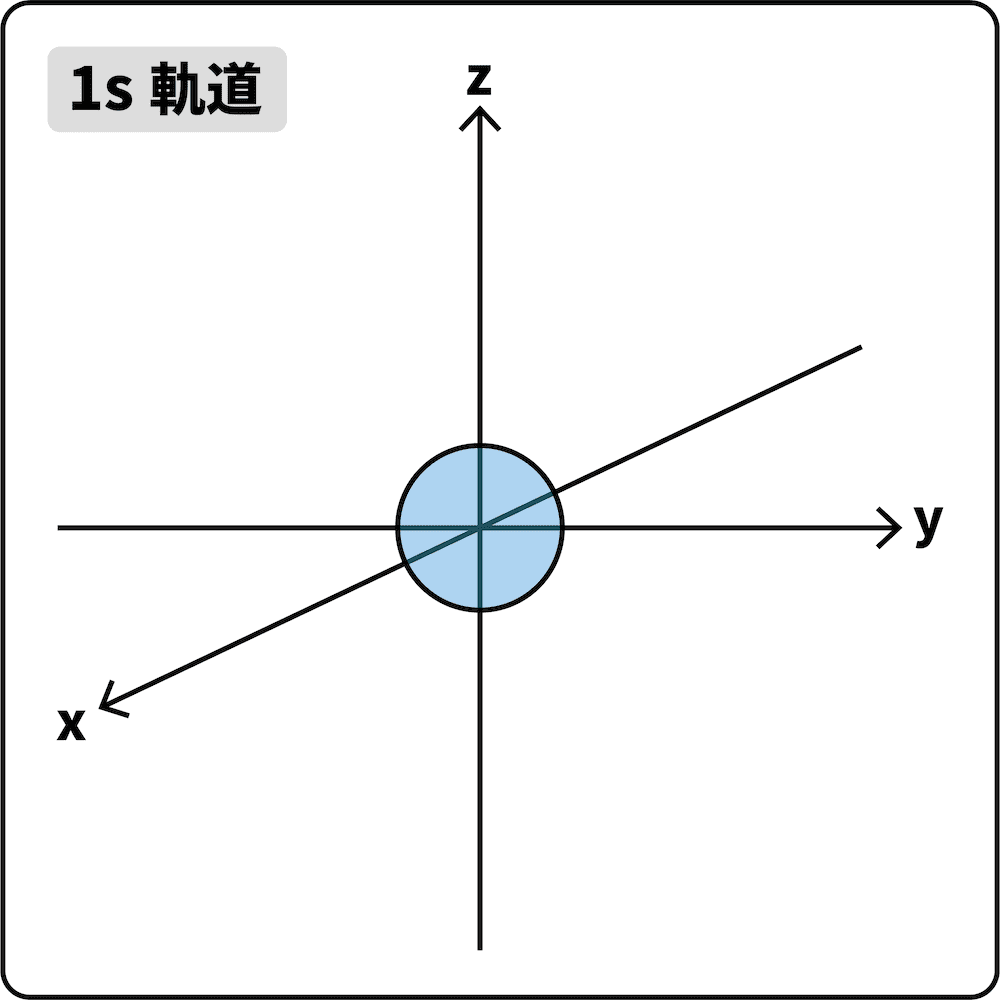
- 電子が1s軌道に収まる場合、この球のどこかに存在する可能性が高いと考える。
- L殻は、やや大きい球形の2s軌道と、数字の8のような形の2p軌道(3つ)からなる。

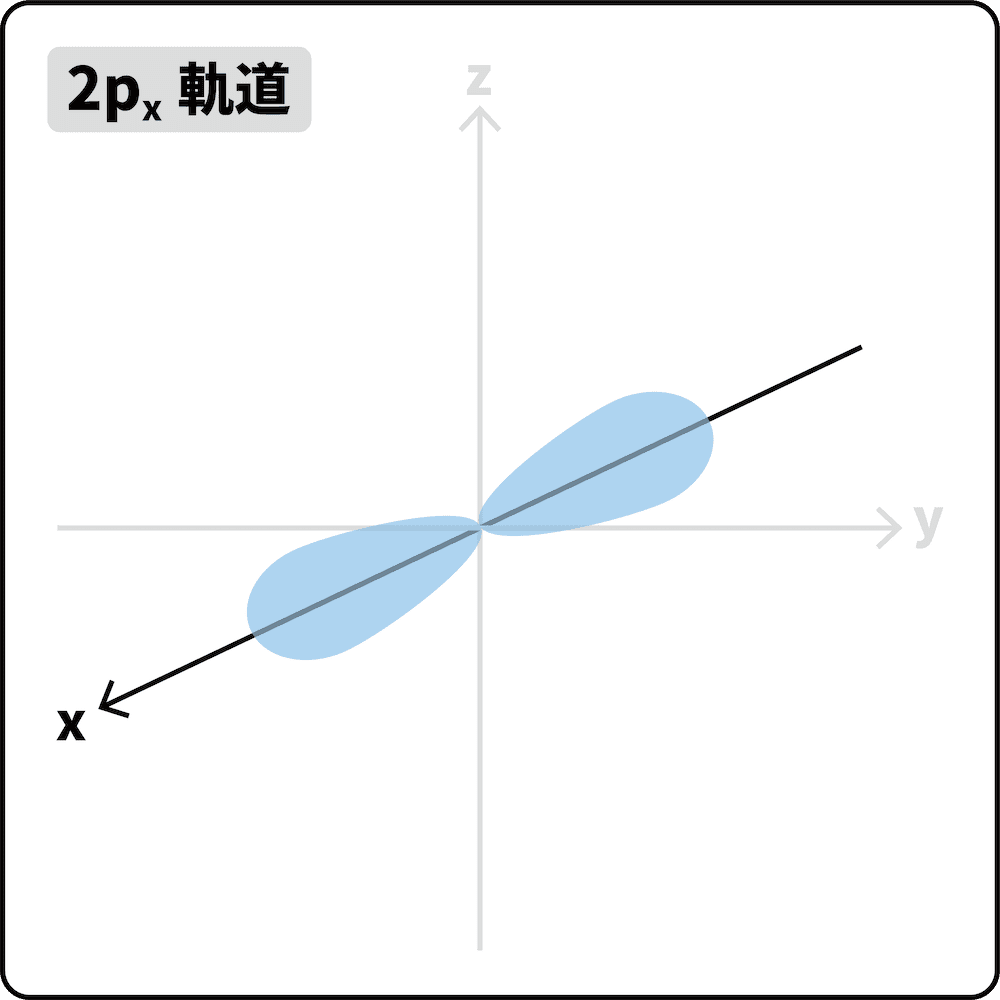
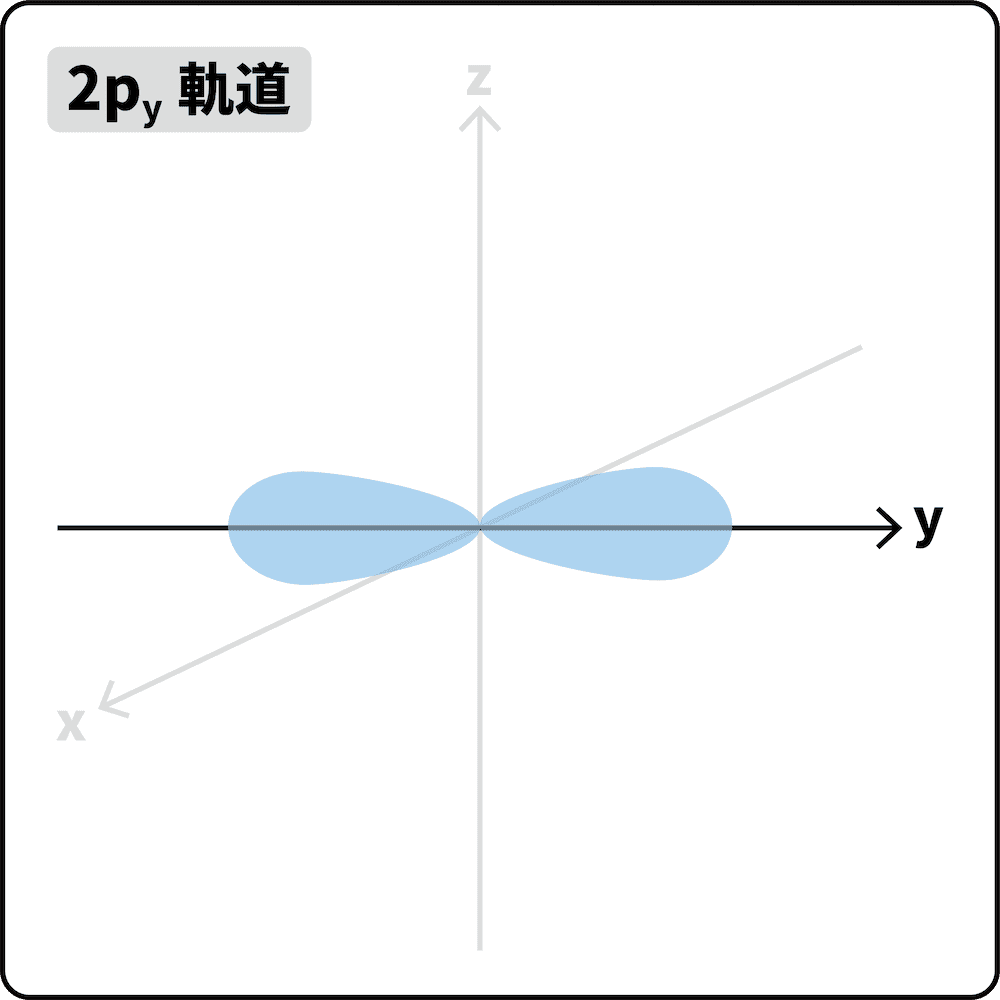
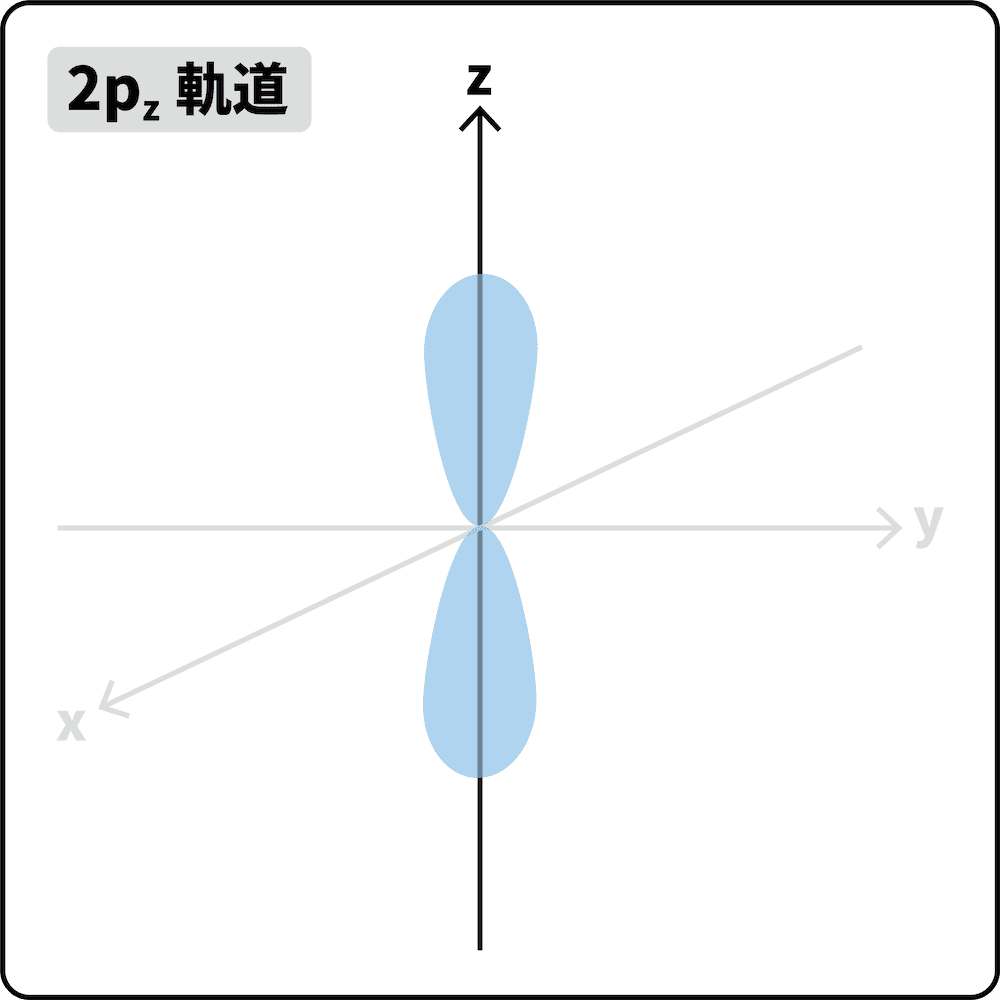
- 2p軌道は、x軸、y軸、z軸方向に3種類存在する。(それぞれ2px軌道、2py軌道、2pz軌道という)
- M殻は、3s軌道、3p軌道(3つ)、複雑な形の3d軌道(5つ)からなる。
- N殻は、4s軌道、4p軌道(3つ)、4d軌道(4つ)、さらに複雑な形の4f軌道(7つ)からなる。
電子軌道に基づいた電子配置
- 電子軌道のエネルギーは、次の矢印の順に高くなる。
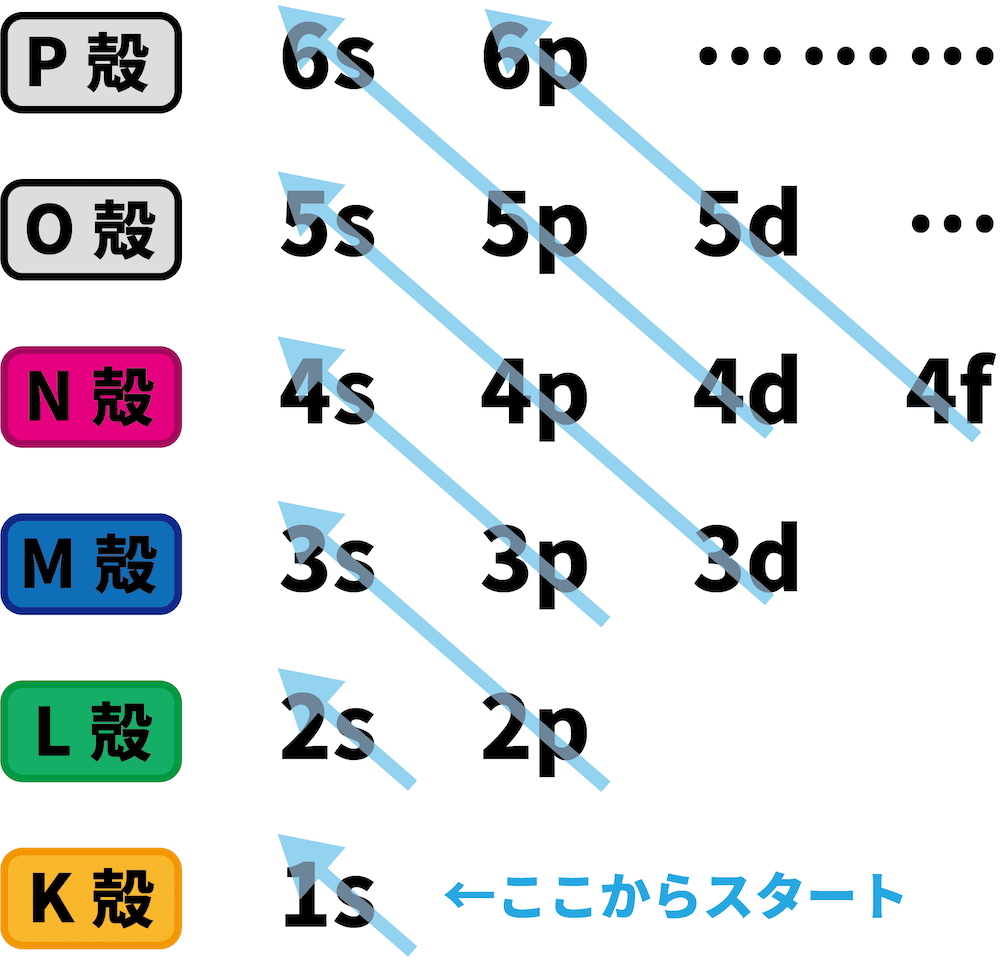
- 電子軌道のエネルギーに基づいた電子配置を紹介する。
1H~2Heの電子配置
| 元素 | 1s |
|---|---|
| 1H | ↑ |
| 2He | ↑↓ |
3Li~10Neの電子配置
スクロールできます
| 元素 | 1s | 2s | 2p | 2p | 2p |
|---|---|---|---|---|---|
| 3Li | ↑↓ | ↑ | |||
| 4Be | ↑↓ | ↑↓ | |||
| 5B | ↑↓ | ↑↓ | ↑ | ||
| 6C | ↑↓ | ↑↓ | ↑ | ↑ | |
| 7N | ↑↓ | ↑↓ | ↑ | ↑ | ↑ |
| 8O | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ |
| 9F | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ |
| 10Ne | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
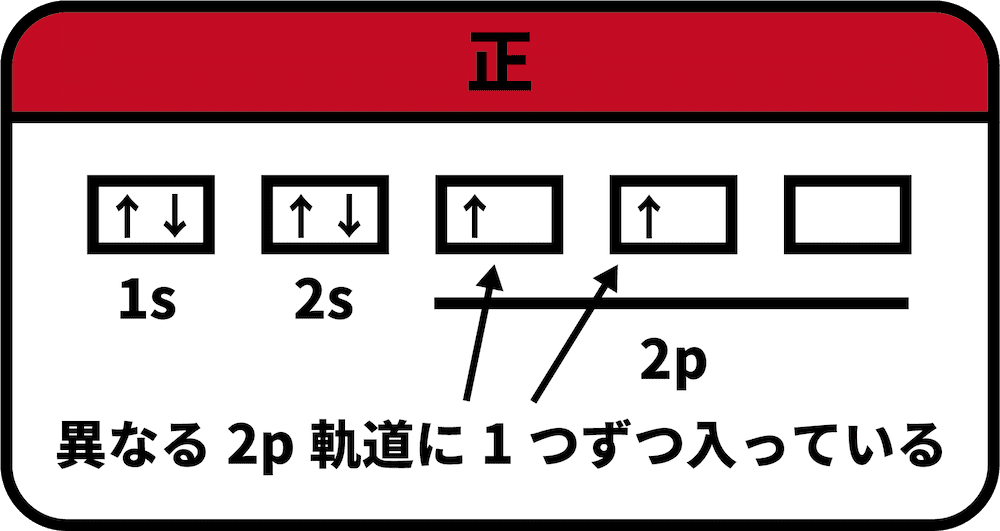
- 同じ軌道に電子が入る場合、できる限り分散して入ることに注意が必要である。
- 例えば6Cにおいて、2p軌道に2つの電子が入るとき、異なる2p軌道に1つずつ入る。

11Na~18Arの電子配置
スクロールできます
| 元素 | 1s | 2s | 2p | 2p | 2p | 3s | 3p | 3p | 3p |
|---|---|---|---|---|---|---|---|---|---|
| 11Na | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | |||
| 12Mg | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||
| 13Al | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ||
| 14Si | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | |
| 15P | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑ |
| 16S | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ |
| 17Cl | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ |
| 18Ar | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
19K・20Caの電子配置
スクロールできます
| 元素 | 1s〜3p | 3d | 3d | 3d | 3d | 3d | 4s |
|---|---|---|---|---|---|---|---|
| 19K | ↑↓ | ↑ | |||||
| 20Ca | ↑↓ | ↑↓ |
21Sc~30Znの電子配置
スクロールできます
| 元素 | 1s〜3p | 3d | 3d | 3d | 3d | 3d | 4s |
|---|---|---|---|---|---|---|---|
| 21Sc | ↑↓ | ↑ | ↑↓ | ||||
| 22Ti | ↑↓ | ↑ | ↑ | ↑↓ | |||
| 23V | ↑↓ | ↑ | ↑ | ↑ | ↑↓ | ||
| 24Cr | ↑↓ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ |
| 25Mn | ↑↓ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑↓ |
| 26Fe | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ↑ | ↑↓ |
| 27Co | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ↑↓ |
| 28Ni | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑↓ |
| 29Cu | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ |
| 30Zn | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
- 24Cr、29Cuについて、d軌道は半分(5個)または全部(10個)満たされたときに安定化するため、N殻からM殻に電子が1つ移動している。
31Ga~36Krの電子配置
スクロールできます
| 元素 | 1s〜4s | 4p | 4p | 4p |
|---|---|---|---|---|
| 31Ga | ↑↓ | ↑ | ||
| 32Ge | ↑↓ | ↑ | ↑ | |
| 33As | ↑↓ | ↑ | ↑ | ↑ |
| 34Se | ↑↓ | ↑↓ | ↑ | ↑ |
| 35Br | ↑↓ | ↑↓ | ↑↓ | ↑ |
| 36Kr | ↑↓ | ↑↓ | ↑↓ | ↑↓ |













