MENU
理想気体と実在気体(違い・グラフがズレる原因・近づけるための条件など)
はじめに
【プロ講師解説】このページでは『理想気体と実在気体(違い・グラフがズレる原因・近づけるための条件など)』について解説しています。
理想気体・実在気体とは
- 体積が0で分子間力がはたらかないと仮定した“仮想的な気体”を理想気体という。
- 理想気体においては、気体の状態方程式が常に成り立つ。
\[ \begin{align}&PV=nRT\\
& \mathrm{(}圧力P(\mathrm{Pa})、体積V(\mathrm{L})、物質量n(\mathrm{mol})、気体定数R、絶対温度T(\mathrm{K})\mathrm{)}\end{align} \]
- 一方、実際に存在する酸素O2や二酸化炭素CO2などの気体は実在気体とよばれ、分子に体積があり、分子間力がはたらいている。
- 実在気体において、気体の状態方程式は成り立たない。
- 理想気体と実在気体の比較を表にまとめると次のようになる。
| 理想気体 | 実在気体 | |
|---|---|---|
| 分子の体積 | なし | あり |
| 分子間力 | はたらかない | はたらく |
| PV=nRT | 成立する | 成立しない |
理想気体と実在気体のグラフ
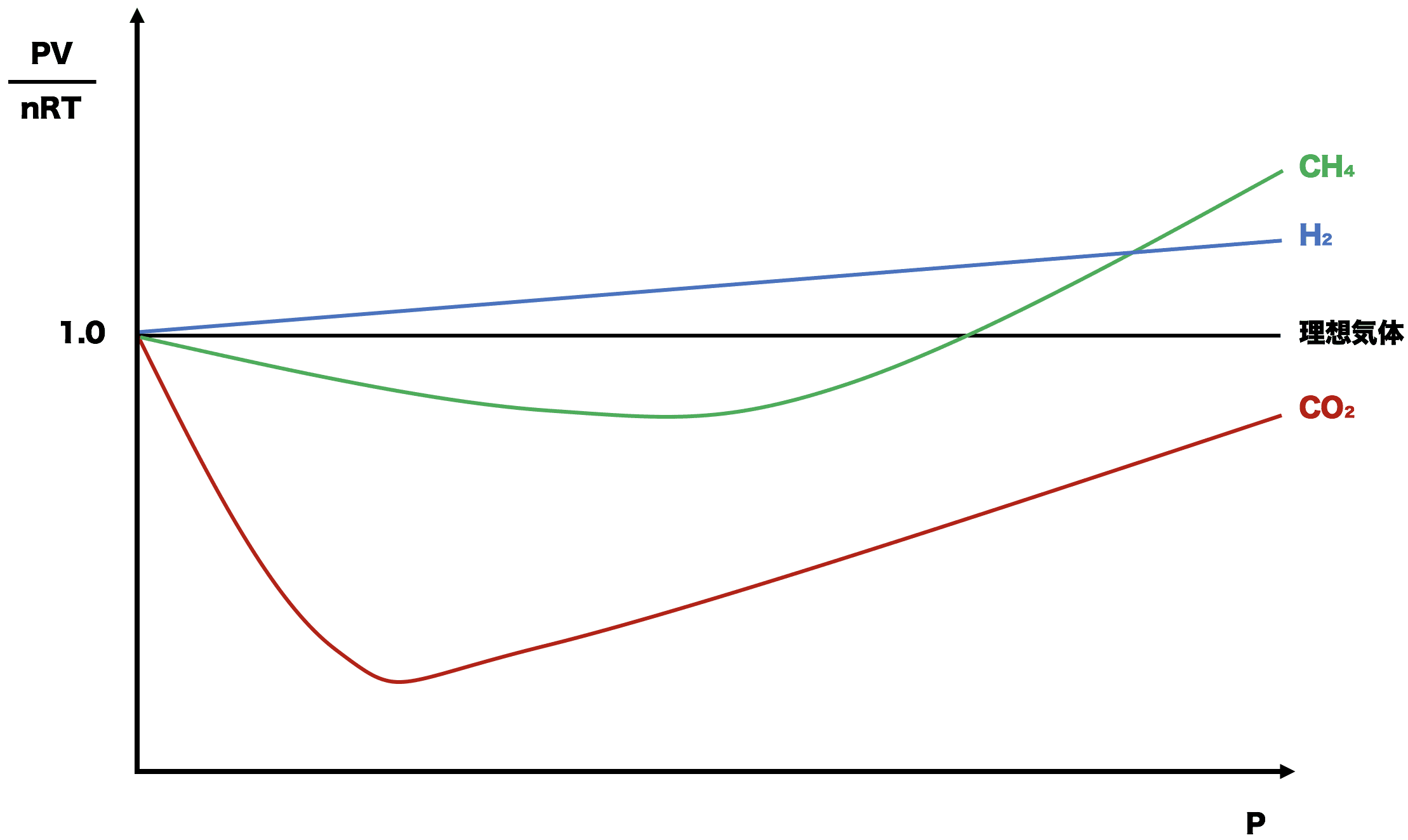
- 理想気体は常にPV=nRTが成り立つので、PV/nRT=1となり、圧力が変化してもPV/nRTの値はずっと1のままである。
- しかし、実在気体ではPV=nRTが成り立たないので、理想気体のグラフからややズレが生じてくる。
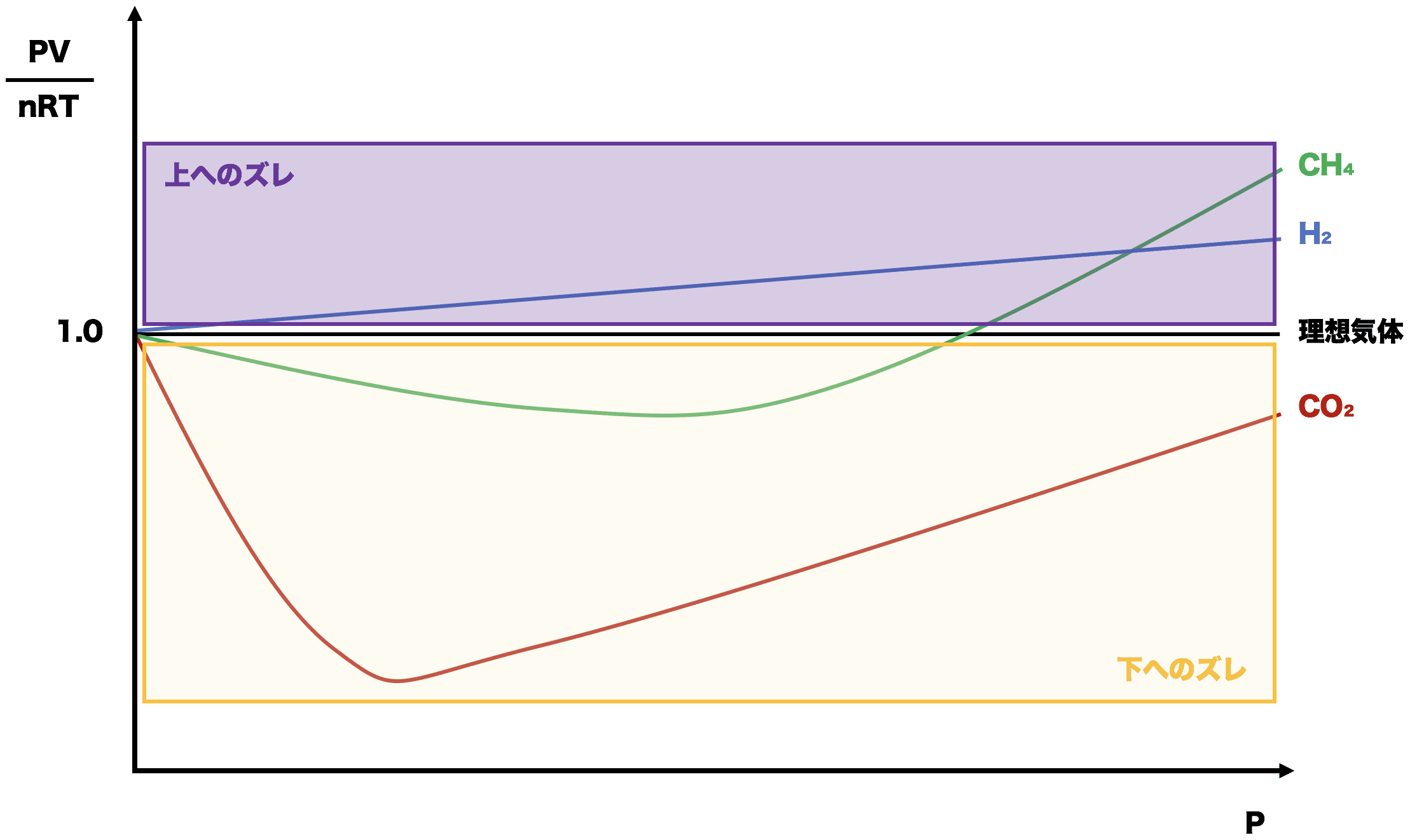
- 理想気体より下へのズレは「分子間力」が原因である。
実在気体は理想気体と異なり分子間力が存在するため、その分縮まり体積Vが小さくなる。(その結果PV/nRTが小さくなる) - 理想気体より上へのズレは「分子の体積」が原因である。
実在気体は理想気体と異なり分子の体積が存在するため、圧力が上がるとその体積が無視できなくなり(分子間力によって体積が縮まっているとはいえ)理想気体よりも体積が大きくなる。
実在気体が理想気体に近づくための条件
- 実在気体を理想気体に近づけるためには「高温・低圧」にすることが大切である。
高温にする理由
- 高温にすると、その分気体の運動エネルギーが大きくなり、相対的に分子間力が無視できるようになる。したがって、理想気体に近づく。
低圧にする理由
- 低圧にすると、容器の体積が大きくなり、気体分子自体の大きさ(体積)が相対的に小さくなる。また、容器の体積が大きくなるのに伴い、気体分子間の距離が離れ分子間力が無視できるようになる。したがって、理想気体に近づく。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
体積が0で分子間力がはたらかないと仮定した“仮想的な気体”を【1】という。
解答/解説:タップで表示
解答:【1】理想気体
体積が0で分子間力がはたらかないと仮定した“仮想的な気体”を理想気体という。
理想気体においては、気体の状態方程式が常に成り立つ。
\[ \begin{align}&PV=nRT\\
& \mathrm{(}圧力P(\mathrm{Pa})、体積V(\mathrm{L})、物質量n(\mathrm{mol})、気体定数R、絶対温度T(\mathrm{K})\mathrm{)}\end{align} \]
実際に存在する酸素O2や二酸化炭素CO2などの気体は【1】とよばれる。
解答/解説:タップで表示
解答:【1】実在気体
実際に存在する酸素O2や二酸化炭素CO2などの気体は実在気体とよばれる。
実在気体は分子に体積があり、【1】がはたらいている。
解答/解説:タップで表示
解答:【1】分子間力
実在気体は分子に体積があり、分子間力がはたらいている。
実在気体において、気体の状態方程式は成り立【1(つ or たない)】。
解答/解説:タップで表示
解答:【1】たない
実在気体において、気体の状態方程式は成り立たない。
実在気体を理想気体に近づけるためには【1(高 or 低)】温・【2(高 or 低)】圧にすることが大切である。
解答/解説:タップで表示
解答:【1】高【2】低
実在気体を理想気体に近づけるためには「高温・低圧」にすることが大切である。
●高温にする理由
高温にすると、その分気体の運動エネルギーが大きくなり、相対的に分子間力が無視できるようになる。したがって、理想気体に近づく。
●低圧にする理由
低圧にすると、容器の体積が大きくなり、気体分子自体の大きさ(体積)が相対的に小さくなる。また、容器の体積が大きくなるのに伴い、気体分子間の距離が離れ分子間力が無視できるようになる。したがって、理想気体に近づく。