MENU
質量保存の法則(例・発見者・演習問題など)
目次
はじめに
【プロ講師解説】このページでは『質量保存の法則(例・発見者・演習問題など)』について解説しています。
質量保存の法則とは
- 化学反応の前後で物質の総質量は変化しない。この法則を質量保存の法則という。
- ここでは、水素と酸素による水の生成反応を例に説明していこう。
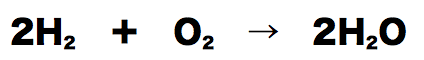
- 水素と酸素の反応を化学反応式で表すと上のようになる。この反応において、水素4gと酸素32gを反応させると水が36gできる。
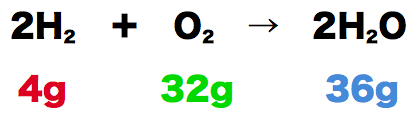
- このとき、反応の前後で全体の質量が変わっていない。反応前は水素4gと酸素32gで全体の質量は36g、反応後は水が36gあるので全体の質量は36gになっている。
- このように「化学反応の前後で物質の総質量は変化しない」ことを質量保存の法則という。
質量保存の法則と物質量mol
- 質量保存の法則を物質量を使って説明することができる。
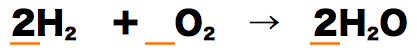
- 反応式中の係数に注目すると、水素と酸素と水の係数は順に「2、1、2」になっている。
- したがって、(係数比はmol比を表すので)水素2molと酸素1molが反応したとき、水は2molできるということになる。
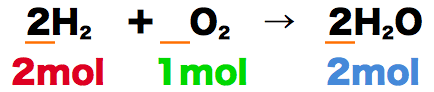
- このとき、分子量(g/mol)を用いてそれぞれのmolをgに変換すると、水素が4g、酸素が32g、水が36gになる。

- やはり反応前の質量の合計と反応後の質量の合計は変わっていないことがわかる。
質量保存の法則の発見者・発見年
- 質量保存の法則の発見者はフランス人のラボアジエ、発見した年は1774年である。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
質量保存の法則について、簡単に説明せよ。
解答/解説:タップで表示
解答:下記参照
化学反応の前後で物質の総質量は変化しない。この法則を質量保存の法則という。
問2
質量保存の法則の発見者、発見した年を述べよ。
解答/解説:タップで表示
解答:ラボアジエ/1774年
質量保存の法則の発見者はフランス人のラボアジエ、発見した年は1774年である。
問3
水素8gと酸素64gを反応させたとき出来る水は何gか。
解答/解説:タップで表示
解答:72g
質量保存の法則により反応前の質量の合計と反応後の質量の合計は変化しない。よって、反応前の水素の質量と酸素の質量を足しあわせたものが生成する水の質量となる。
\[ 8 + 64 = 72(\mathrm{g}) \]
問4
水素0.4gと酸素3.2gを反応させたとき出来る水は何gか。
解答/解説:タップで表示
解答:3.6g
質量保存の法則により反応前の質量の合計と反応後の質量の合計は変化しない。よって、反応前の水素の質量と酸素の質量を足しあわせたものが生成する水の質量となる。
\[ 0.4 + 3.2 = 3.6(\mathrm{g}) \]













