MENU
銅の工業的製法「粗銅の精製・電解精錬」(仕組み・陽極泥・反応式など)
はじめに
【プロ講師解説】このページでは『銅の工業的製法「粗銅の精製・電解精錬」(仕組み・陽極泥・反応式など)』について解説しています。
銅の製法
- 銅Cuの製法は大きく2段階に分けることができる。
●第1段階
原料の黄銅鉱CuFeS2から粗銅(不純物を含む銅)を得る。
●第2段階
粗銅の電解精錬により純銅を得る。

- 第1段階では、原料の黄銅鉱CuFeS2から粗銅(純度約99%:不純物を含む銅)を得る。第2段階では、粗銅の電解精錬により純銅(純度約99.9%)を得る。
- このページでは、銅の製法について、順を追って解説する。
第1段階(黄銅鉱→粗銅)
- 銅の製法の第1段階(黄銅鉱→粗銅)は次の手順で行われる。
●STEP1
原料となる黄銅鉱CuFeS2にコークスCと石灰石CaCO3を混ぜて溶鉱炉で加熱し、硫化銅(Ⅰ)Cu2Sを得る。
●STEP2
STEP1で得たCu2Sに転炉でO2を吹き込み加熱し、粗銅を得る。
まず、原料となる黄銅鉱CuFeS2にコークスC・石灰石CaCO3・ケイ砂SiO2などを混ぜて溶鉱炉で加熱する。
\[ \mathrm{4CuFeS_{2}+9O_{2}→2Cu_{2}S+2Fe_{2}O_{3}+6SO_{2}} \]
これにより硫化銅(Ⅰ)Cu2Sを得る。
次に、STEP1で得たCu2Sに転炉でO2を吹き込み加熱する。
\[ \begin{align}&\mathrm{2Cu_{2}S + 3O_{2} → 2Cu_{2}O + 2SO_{2}・・・①}\\
&\mathrm{2Cu_{2}O + Cu_{2}S → 6Cu+SO_{2}・・・②} \end{align}\]
①と②の反応式を足し合わせると、次のようになる。
\[ \mathrm{3Cu_{2}S + 3O_{2} → 6Cu + 3SO_{2}} \]
全体を3で割ると…
\[ \mathrm{Cu_{2}S + O_{2} → 2Cu + SO_{2}} \]
ここで生じる銅は粗銅とよばれる不純物を多く含んだ銅である(純度約99%)。
この後電解精錬を行うことで、不純物を取り除き、より純度の高い純銅(純度99.99%以上)にする。
第2段階(粗銅→純銅)
- 銅の製法の第2段階(粗銅→純銅)は次の手順で行われる。
●STEP1
硫酸銅(Ⅱ)CuSO4水溶液に粗銅(陽極)および純銅(陰極)を入れ、電流を流す。
●STEP2
陽極(粗銅)に含まれる金属のうち、銅と銅よりイオン化傾向が高い金属が電子e-を放出して溶け出し、残りは陽極板の下に沈殿する。
●STEP3
陰極で(水溶液中で最もイオン化傾向が低い)Cu2+がe-を受け取り、単体のCu(純銅)になり、陰極板の純銅にはりつく。
まず、硫酸銅(Ⅱ)CuSO4水溶液に粗銅(陽極)および純銅(陰極)を入れ、電流を流す。
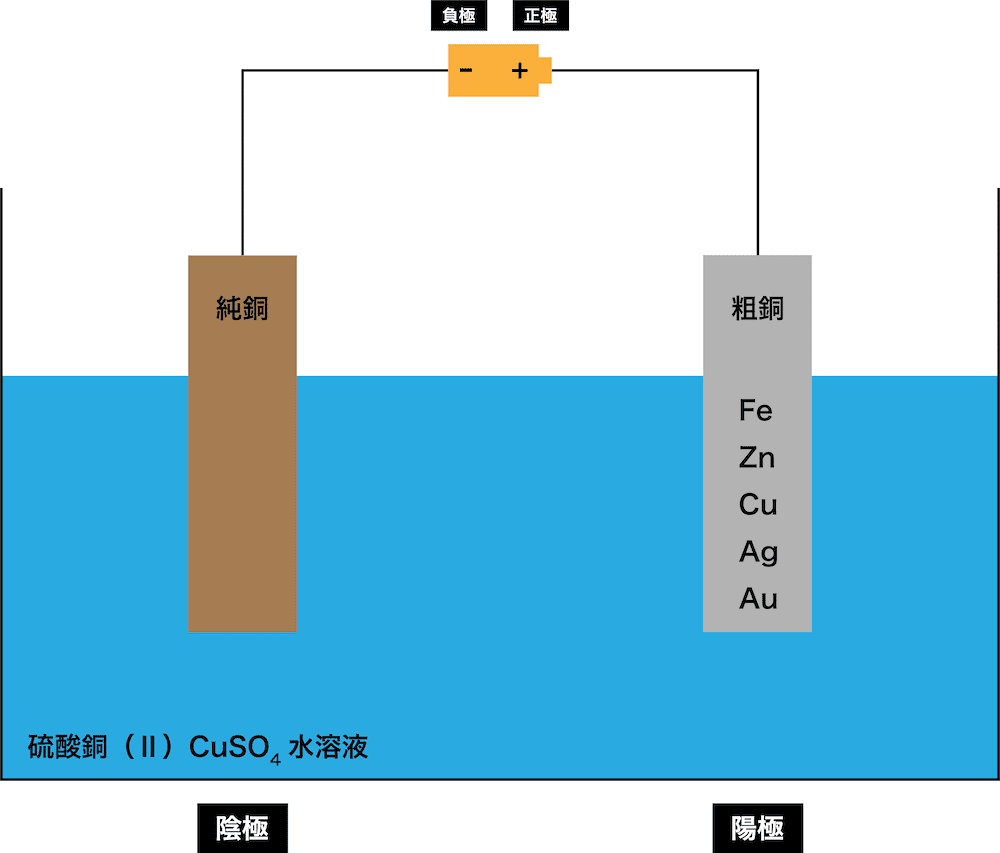
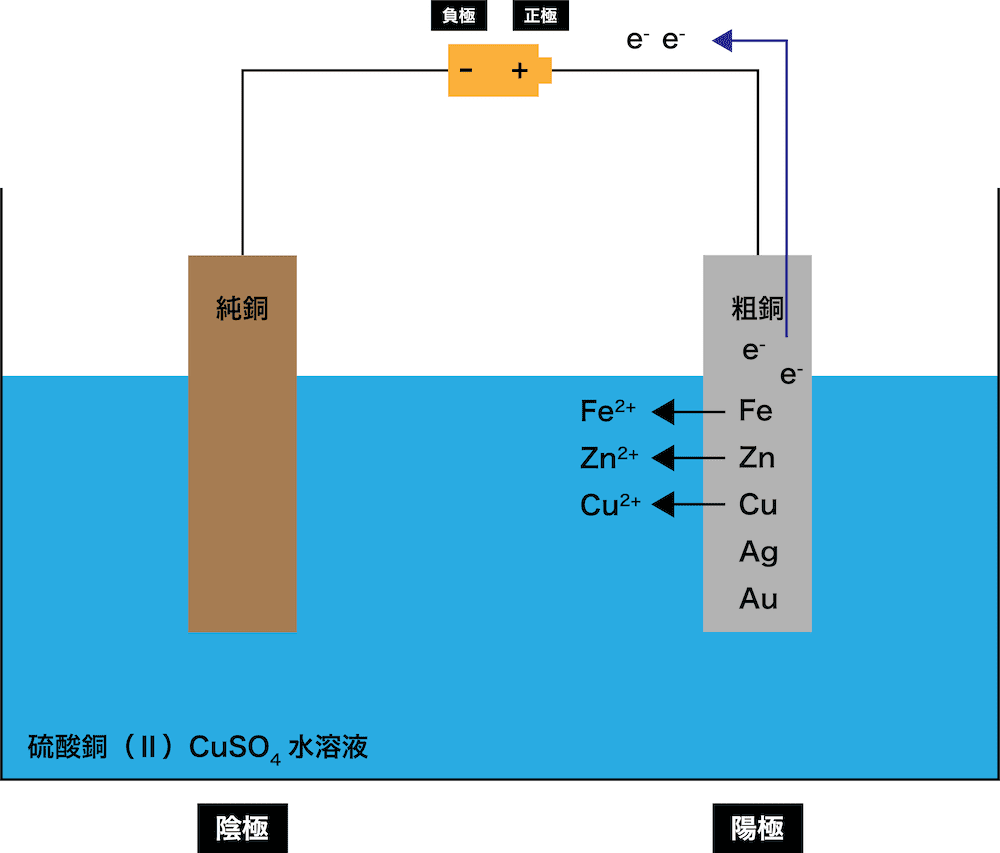
陽極(粗銅)に含まれる金属のうち、銅と銅よりイオン化傾向が高い金属が電子e-を放出して溶け出し、残りは陽極板の下に沈殿する。
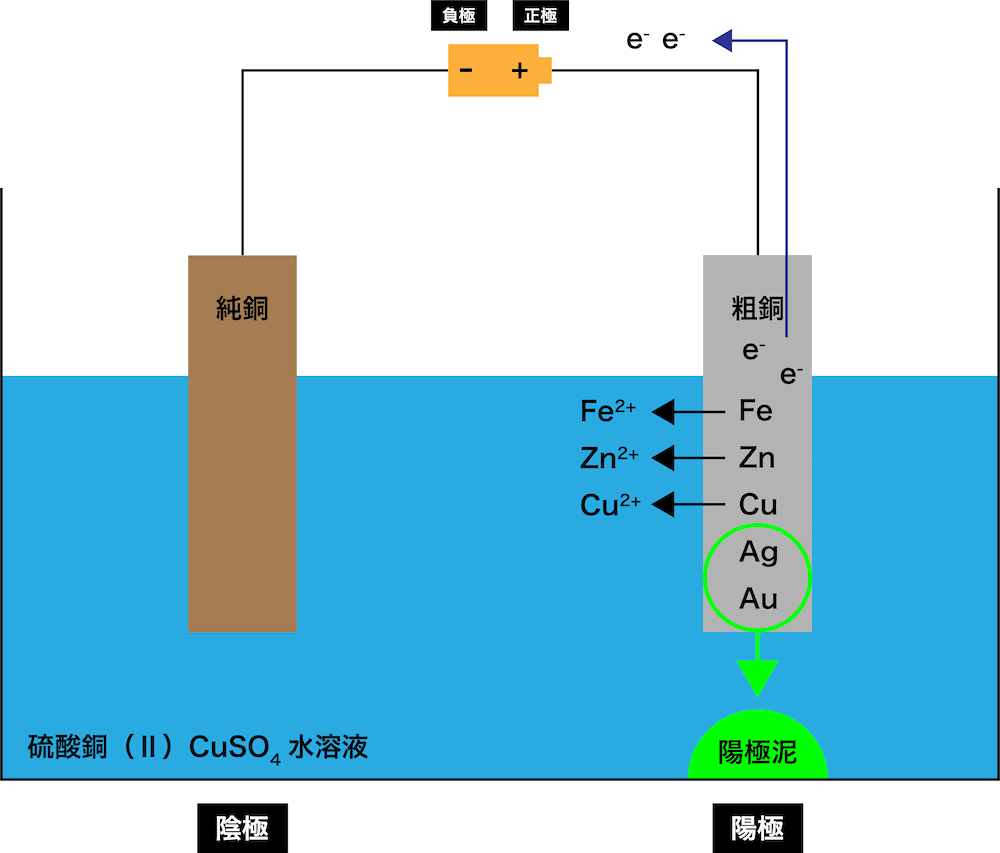
一方、粗銅に含まれる”銅よりもイオン化傾向が小さい金属(銀や金など)”は(陽イオンにはならず)金属板からはがれて沈殿を形成する(=陽極泥)。
\[ \begin{align}&\mathrm{Zn → Zn^{2+} + 2e^{-}}\\
&\mathrm{Fe → Fe^{2+} + 2e^{-}}\\
&\mathrm{Cu → Cu^{2+} + 2e^{-}}\\
&\mathrm{(AgやAuは陽極泥として沈殿)}\end{align} \]
陰極で(水溶液中で最もイオン化傾向が低い)Cu2+がe-を受け取り、単体のCu(純銅)になり、陰極板の純銅にはりつく。
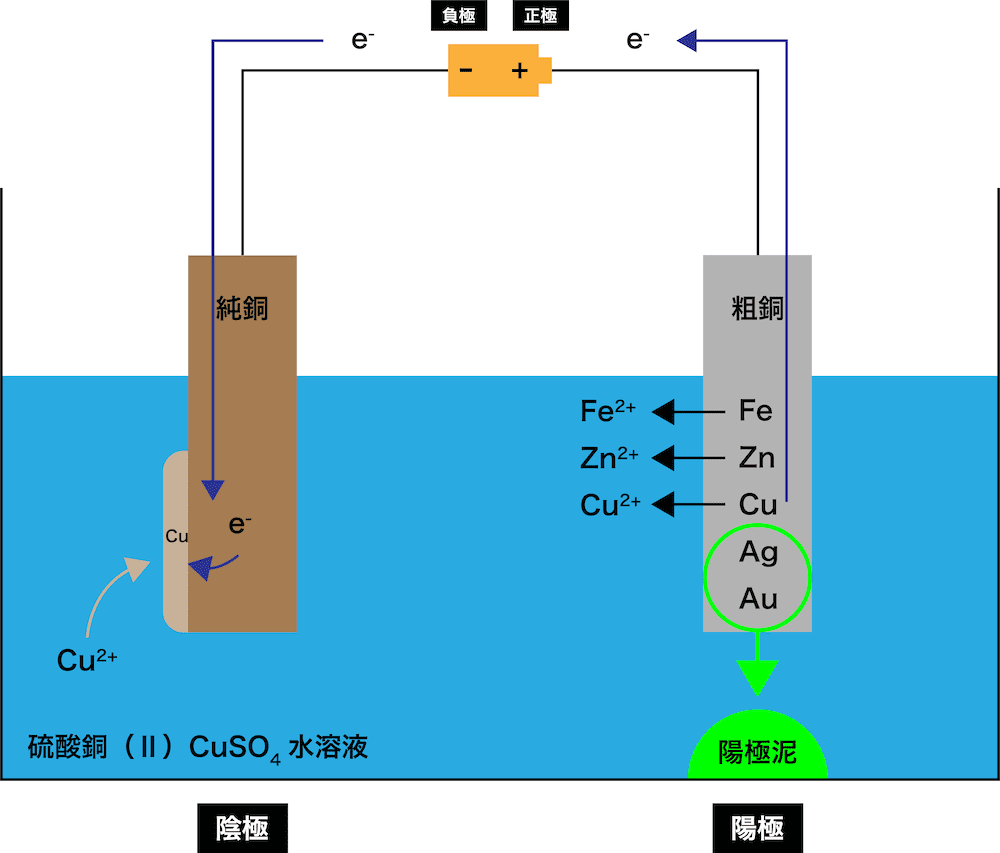
\[ \mathrm{Cu^{2+} + 2e^{-}→Cu} \]
ちなみに、Zn2+やFe2+はCu2+に比べてイオン化傾向が大きいため、e-を受け取り単体になることはない。














