MENU
ステアリン酸を使ったアボガドロ定数の求め方〜仕組みや計算など〜
はじめに
【プロ講師解説】このページでは『ステアリン酸を使ったアボガドロ定数の求め方〜仕組みや計算など〜』について解説しています。
ステアリン酸を使ったアボガドロ定数の求め方
ステアリン酸C18H36O2(分子量284.0)をベンゼンなどの揮発性の溶媒に溶かして、水面に静かにそそぐと、溶液は水面に広がる。溶媒を抽出させると、親水基部分は水中を向き、一方、疎水基の部分は水からできるだけ離れるように空中に張り出した形で配列し、単分子膜を形成する。
次の操作1〜3に従って、ステアリン酸の単分子膜の面積からアボガドロ定数を見積もる実験を行った。
【操作1】濃度1.500×10ー3mol/Lのステアリン酸のベンゼン溶液50.00mLを調製した。
【操作2】上記の溶液v[mL]を水面に静かに滴下し、ベンゼンを揮発させて単分子膜を作った。
【操作3】単分子膜の面積を測定すると、90.00cm2であった。
(1)操作1に必要なステアリン酸は何mgか。
(2)ステアリン酸1分子が水面上で占有する面積をs[cm2]とするとき、この実験から求められるアボガドロ定数[/mol]をv,sを用いて表せ。
『明治薬科大学 2013年 参考』
解答・解説(1)
解答:21.3mg
操作1に必要なステアリン酸の質量をx(mg)とすると次のような式を書くことができる。

左側の式は操作1の所に書かれているステアリン酸のモル濃度1.500×10-3(mol/L)と最終的に調製された溶液の体積(L)を使って、右側の式はステアリン酸の質量xmg(未知)と問題文の始めに書いてあるステアリン酸の分子量284.0(g/mol)を使って、ステアリン酸のmolを表している。当然どちらの計算をしても出てくるステアリン酸のmolは同じはずなのでイコールで結んでいる。
この式を解くとx=21.3(mg)となる。
解答・解説(2)
解答:6.000×107/sv(/mol)
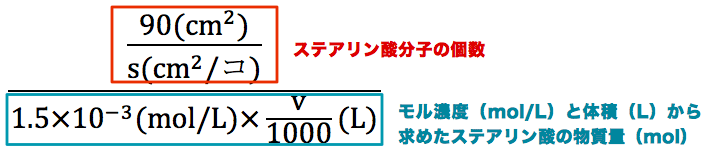
アボガドロ定数の単位は(コ/mol)になるはずなので、既知の値とs,vを使って単位を合わせていく。
分子の“個数”は、問題文の操作3のところに記載されている単分子膜の面積90.00(cm2)をステアリン酸分子のステアリン酸1分子が水面上で占有する面積s(cm2/コ)で割ることで、分母の“mol”はステアリン酸分子のモル濃度1.500×10-3(mol/L)(mol/L)に滴下したステアリン酸の体積v/1000(L)をかけることで導き出す。
この式を整理すると…6.000×107/sv(コ/mol)となる。













