MENU
窒素の単体と化合物の性質・製法
はじめに
【プロ講師解説】このページでは『窒素の単体と化合物の性質・製法』について解説しています。
窒素N2
- 窒素N2は次のような特徴をもつ。
●窒素N2の特徴
- 空気中に多く含まれる(80%)
- 無色無臭の中性気体
- 工業的製法:液体空気の分留
- 実験室的製法:亜硝酸アンモニウムNH4NO2の熱分解
❶ 空気中に多く含まれる(80%)
- 空気を構成する気体の約80%は窒素である。
| 気体 | 空気中で占める割合 |
|---|---|
| 窒素 | 78% |
| 酸素 | 20% |
| アルゴン | 1% |
| その他 | 1% |
- 次に多いのが酸素O2、その次がアルゴンArである。
参考:空気(乾燥空気)の組成
❷ 無色無臭の中性気体
- 窒素は無色無臭の中性気体である。
❸ 工業的製法:液体空気の分留
- 窒素の単体を工業的につくる際は、液体空気を分留する。
❹ 実験室的製法:亜硝酸アンモニウムの熱分解
- 窒素の単体を実験室内でつくる際は、亜硝酸アンモニウムNH4NO2を熱分解する。
\[ \mathrm{NH_{4}NO_{2} → N_{2} + 2H_{2}O} \]
亜硝酸アンモニウムの熱分解
- アンモニウムイオンNH4+中の窒素N原子の酸化数は「-3」であり、これはN原子がとり得る最低の酸化数である。したがって、NH4+は還元剤として働く。
参考:酸化数(求め方・ルール・例外・例題・一覧・演習問題)
参考:酸化剤・還元剤(違い・見分け方・例・一覧など)
- 一方、亜硝酸イオンNO2-中の N原子の酸化数は「+3」であり、NO2-は酸化剤としても還元剤としてもはたらき得る。
- したがって、亜硝酸アンモニウムNH4NO2の熱分解においては、電子e-がNH4+からNO2-へ移動し、 窒素N2と水H2Oを生じる。この反応は自己酸化還元反応の一種である。
アンモニアNH3
- 窒素の水素化物であるアンモニアNH3は次のような特徴をもつ。
●アンモニアNH3の特徴
- 無色無臭で刺激臭をもつ塩基性気体
- 工業的製法:ハーバー・ボッシュ法
- 実験室的製法:塩化アンモニウムに水酸化カルシウムを加えて加熱する
- 水に非常によく溶け、1価の弱塩基としてはたらく
- HClと接触すると白煙を生じる
- Ag+・Cu2+・Zn2+と錯イオンを形成する
❶ 無色無臭で刺激臭をもつ塩基性気体
- アンモニアは、色がついておらず刺激臭をもつ塩基性気体である。
❷ 工業的製法:ハーバー・ボッシュ法
- アンモニアを工業的につくる際はハーバー法(ハーバーボッシュ法)を用いる。
参考:ハーバー法(ハーバー・ボッシュ法)の原理・反応式・高温高圧下の理由など
❸ 実験室的製法:塩化アンモニウムに水酸化カルシウムを加えて加熱する
- アンモニアを実験室内でつくる際には、塩化アンモニウムNH4Clに水酸化カルシウムCa(OH)2を加えて加熱する。
\[ \mathrm{2NH_{4}Cl + Ca(OH)_{2} → CaCl_{2} + 2NH_{3} + 2H_{2}O} \]
- NH4Clは弱塩基を含む塩、Ca(OH)2は強塩基なので、この反応は弱塩基遊離反応の一種である。
参考:【弱酸・弱塩基遊離反応】原理や公式、反応式の作り方など
「固体同士の反応」の注意点
- 固体は、液体や気体と比較して接触面積が小さい。したがって、分子同士の衝突回数を増やすため、固体同士の反応では多くの場合、加熱が必要となる。
- また、加熱をする際は試験管の口をやや下げておく必要がある。
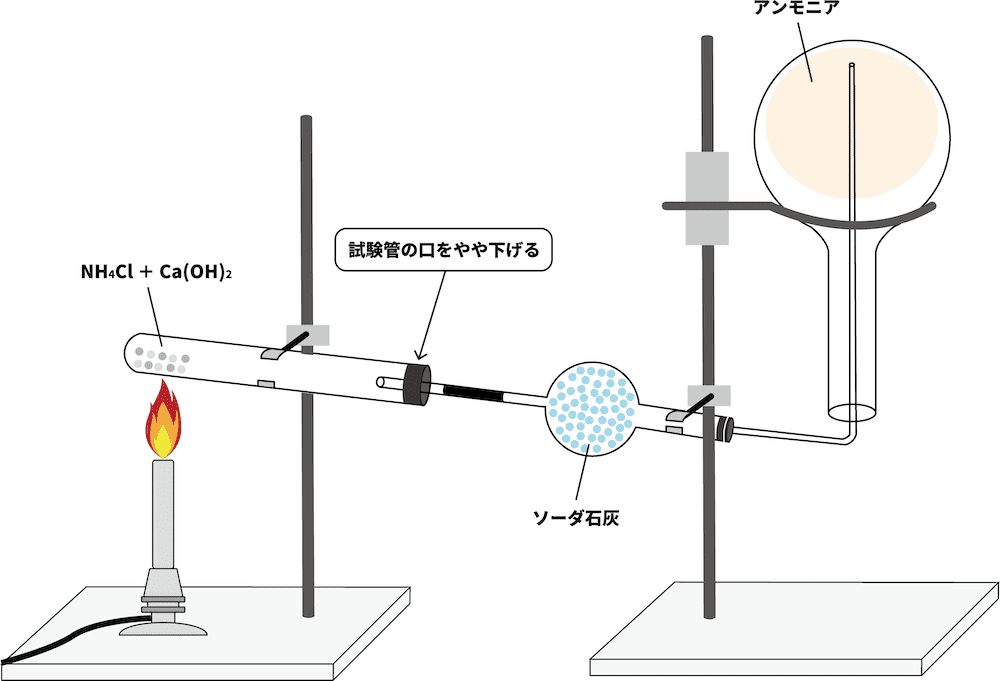
- これは、反応により生成した水が試験管の口の方で冷却されることでできた水滴が、加熱部に流れ、試験管が割れるのを防ぐためである。
❹ 水に非常によく溶け、1価の弱塩基としてはたらく
- アンモニアは、水に非常に良く溶けて弱塩基性を示す。
\[ \mathrm{NH_{3}+H_{2}O⇄NH_{4}^{+}+\underbrace{ OH^{-} }_{ OH^{-}が発生→塩基! } }\]
アンモニアNH3は高校化学で登場する唯一の塩基性気体です。
❺ HClと接触すると白煙を生じる
- アンモニアは、塩化水素HClと接触すると白煙(NH4Clの微粒子)を発生する。
\[ \mathrm{NH_{3} + HCl → NH_{4}Cl} \]
- この反応は、NH3やHClの検出反応として用いられる。
参考:気体の検出反応まとめ
❻ Ag+・Cu2+・Zn2+と錯イオンを形成する
- アンモニアは、金属元素の陽イオン(Ag+・Cu2+・Zn2+など)と反応し、錯イオンを形成する。
\[ \mathrm{NH_{3} + HCl → NH_{4}Cl} \]
| 配位子 | 金属イオン | 錯イオン |
|---|---|---|
| NH3 | Ag+ | ジアンミン銀(Ⅰ)イオン [Ag(NH3)2]+ |
| Cu2+ | テトラアンミン銅(Ⅱ)イオン [Cu(NH3)4]2+ | |
| Zn2+ | テトラアンミン亜鉛(Ⅱ)イオン [Zn(NH3)4]2+ |
冷凍庫の冷媒に用いられる
- NH3は同族元素の水素化物(ホスフィンPH3など)と比較して沸点が高い。これは、分子間で水素結合を形成するためである。水素結合を形成するということは、蒸発しにくい。したがって、蒸発する場合には周囲から大量の蒸発熱を奪うことになる。
- この性質を利用して、アンモニアNH3は大型冷凍庫の冷媒などに用いられる。
一酸化窒素NO・二酸化窒素NO2
- 窒素の酸化物である一酸化窒素NO・二酸化窒素NO2は次のような特徴をもつ。
工業的製法
一酸化窒素NO
\[ \mathrm{4NH_{3} + 5O_{2} → 4NO + 6H_{2}O} \]
- この反応はオストワルト法の第1段階である白金Ptを触媒とし、900℃くらいの高温で行う。
参考:硝酸の工業的製法「オストワルト法」(触媒・覚え方・仕組み・反応式など)
二酸化窒素NO2
\[ \mathrm{2NO + O_{2} → 2NO_{2}} \]
- この反応はオストワルト法の第2段階である。
参考:硝酸の工業的製法「オストワルト法」(触媒・覚え方・仕組み・反応式など)
実験室的製法
一酸化窒素NO
\[ \mathrm{3Cu + 8HNO_{3} → 3Cu(NO_{3})_{2} + 2NO +4H_{2}O} \]
- この反応式の作り方は次の通りである。
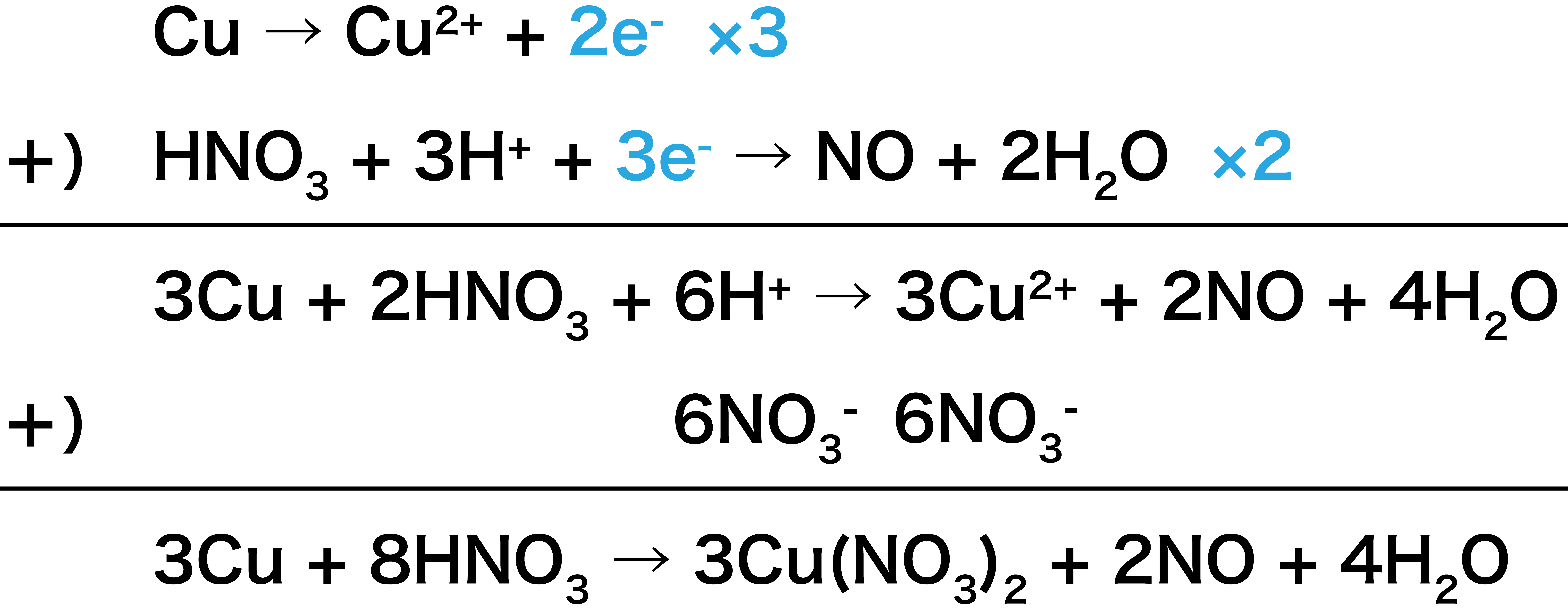
参考:半反応式・酸化還元反応式(作り方・覚え方・問題演習など)
二酸化窒素NO2
\[ \mathrm{2NO + O_{2} → 2NO_{2}} \]
参考:半反応式・酸化還元反応式(作り方・覚え方・問題演習など)
性質
| NO | NO2 | |
|---|---|---|
| 色 | 無色 | 赤褐色 |
| におい | なし | 刺激臭 |
| 溶解性 | 不溶 (中性) | 可溶 (酸性) |
| 二量体形成 | なし | あり |
- 無色のNOは空気に触れるとすぐに赤褐色のNO2に変化する。(気体の検出反応まとめを参照)
\[ \mathrm{\underbrace{ 2NO }_{ 無色 }+O_{2}→\underbrace{ 2NO_{2} }_{ 赤褐色 } }\]
- 生じたNO2は150℃以下では無色のN2O4と平衡状態にある(二量体形成)。
\[ \mathrm{\underbrace{ 2NO_{2} }_{ 赤褐色 } ⇄ \underbrace{ N_{2}O_{4} }_{ 無色 }} \]
硝酸HNO3
- 窒素を含むオキソ酸である硝酸HNO3は次のような特徴をもつ。
●硝酸HNO3の特徴
- 濃硝酸と希硝酸
- 工業的製法:オストワルト法
- 実験室的製法:硝酸ナトリウムに濃硫酸を加えて加熱する
- 1価の強酸として働く
- 強い酸化力をもつ
- 不動態形成に関わる
- 褐色ビンで保存する
❶ 濃硝酸と希硝酸
- 硝酸水溶液のうち、濃度が高い(約60%以上)のものを濃硝酸、濃度が低いものを希硝酸という。
❷ 工業的製法:オストワルト法
- 硝酸を工業的につくるときは、オストワルト法という方法を用いる。
- オストワルト法について詳しくは次のページを参照のこと。
参考:硝酸の工業的製法「オストワルト法」(触媒・覚え方・仕組み・反応式など)
❸ 実験室的製法:硝酸ナトリウムに濃硫酸を加えて加熱する
- HNO3を実験室内でつくるときは、硝酸ナトリウムNaNO3に濃硫酸H2SO4を加えて加熱する。
\[ \mathrm{2NaNO_{3}+H_{2}SO_{4}→2HNO_{3}+Na_{2}SO_{4} }\]
- この反応は揮発性酸遊離反応の一種である。
❹ 1価の強酸として働く
- 硝酸は電離度が高い1価の強酸である。
\[ \mathrm{HNO_{3}→H^{+}+NO_{3}^{-}} \]
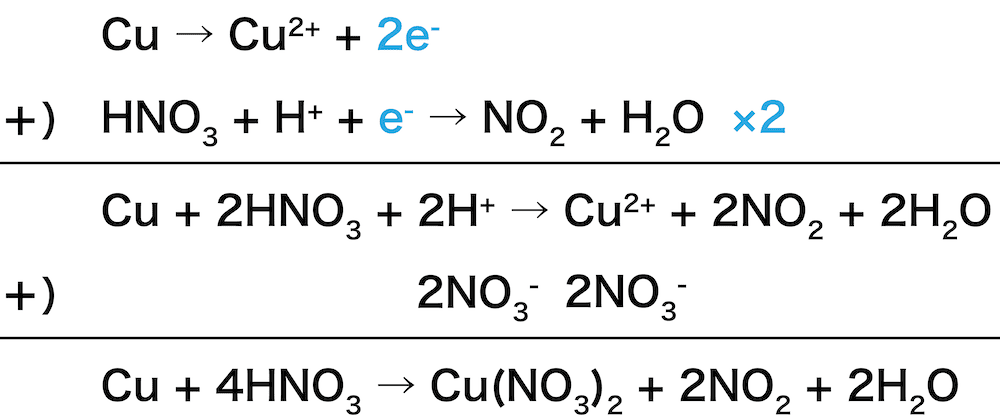
❺ 強い酸化力をもつ
- 硝酸は酸化力が非常に高く、Cu・Hg・Agなどのイオン化傾向の小さい金属も溶かす酸化剤としてはたらく。
- 例として硝酸による銅の酸化反応を確認する。
\[ \mathrm{Cu + 4HNO_{3} → Cu(NO_{3})_{2} + 2NO_{2} + 2H_{2}O} \]
- 濃硝酸による酸化では二酸化窒素NO2、希硝酸による酸化では一酸化窒素NOが生じる。
- ちなみに硝酸は、炭素C、硫黄S、リンPなどの非金属の単体も酸化して溶かす。
\[ \begin{align}&\mathrm{C+4HNO_{3}→CO_{2}+4NO_{2}+2H_{2}O}\\
&\mathrm{S+6HNO_{3}→H_{2}SO_{4}+6NO_{2}+2H_{2}O}\\
&\mathrm{P+5HNO_{3}→H_{3}PO_{4}+5NO_{2}+2H_{2}O }\end{align}\]
濃硝酸は本来無色
- 濃硝酸は本来無色の液体である。
- しかし、光や熱により一部が分解した結果二酸化窒素NO2が生じ、これが濃硝酸に溶け込むことで黄褐色にみえる。
\[ \mathrm{4HNO_{3}→4NO_{2}+2H_{2}O+O_{2}}\]
王水とは
- 濃硝酸と濃塩酸を1:3の割合で混合してつくられる橙黄色の液体を王水(おうすい)という。
- 王水は酸化力の強い硝酸でも溶かすことのできない白金Ptや金Auなどの金属を溶かすことができる。
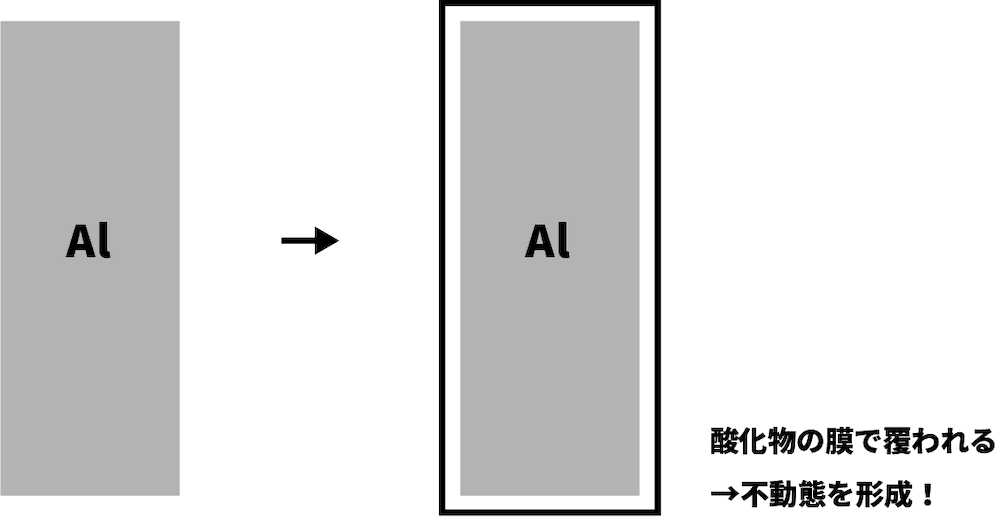
❻ 不動態形成に関わる
- 硝酸は強い酸化力をもつため、不動態形成に関わる。
❼ 褐色ビンで保存する
- 硝酸は光や熱を受けると簡単に分解するため、褐色ビンに入れて保存する。
- 硝酸以外にも、化合物の中には保存法に気をつける必要のあるものが存在する。化合物の保存法について詳しくは次のページを参照のこと。














