MENU
アルカリ金属(1族)の単体・化合物の性質や製法
はじめに
【プロ講師解説】このページでは『アルカリ金属(1族)の単体・化合物の性質や製法』について解説しています。
アルカリ金属とは
- 水素以外の1族元素をアルカリ金属という。
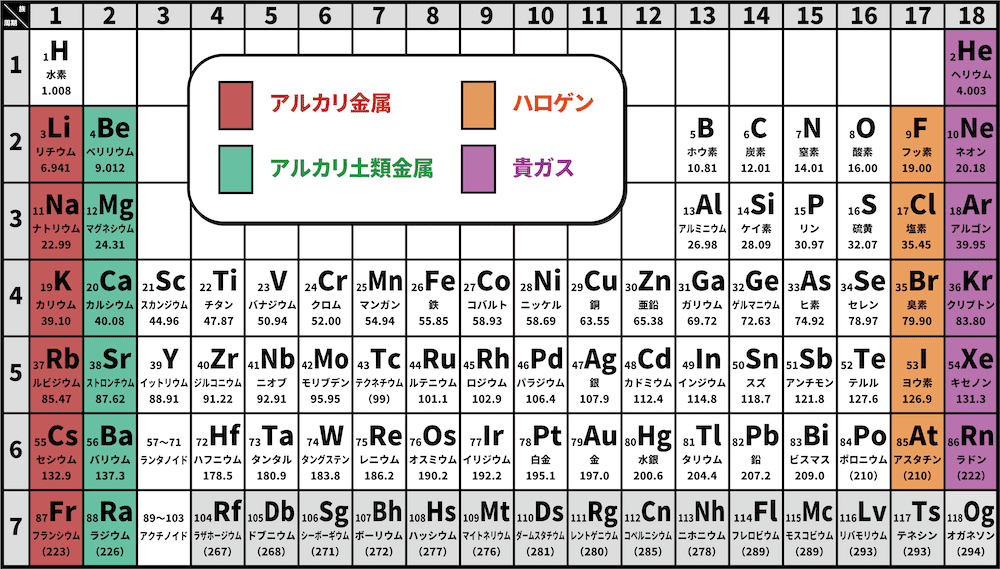
アルカリ金属の特徴
- アルカリ金属の特徴は次の通りである。
●アルカリ金属の特徴
- 1個の価電子をもち、1価の陽イオンになりやすい。
- 還元剤としてはたらく。
- 水と反応し、H2を発生して水酸化物になる。
- 酸素と反応し、酸化物になる。
- 炎色反応を示す。
- 柔らかい。
- 融点が低い。
- 密度が小さい。
❶ 1個の価電子をもち、1価の陽イオンになりやすい。
- アルカリ金属は価電子が1個のため、イオン化エネルギーが非常に小さく、電子を放出して1価の陽イオンになりやすい。
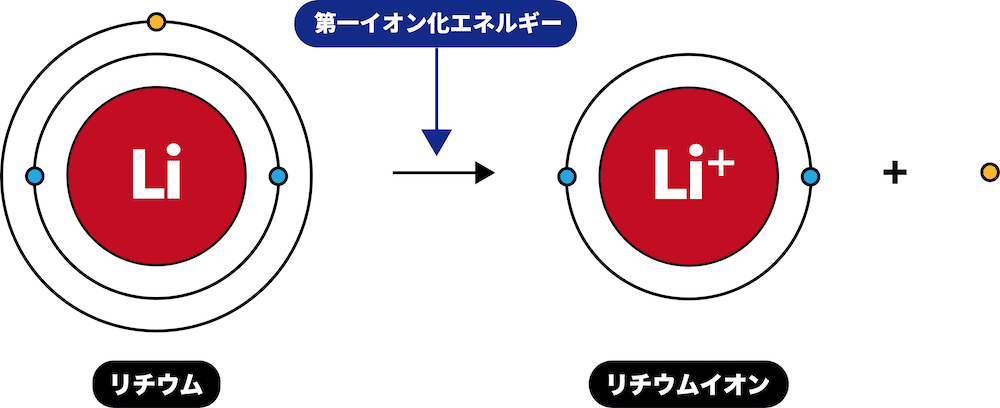
- (第一イオン化エネルギーは周期表の下にいくほど小さくなるので)この傾向は原子番号が大きくなるほど顕著になる。
参考:第一イオン化エネルギー(周期表での最大最小・グラフ・電子親和力との違いなど)
❷ 還元剤としてはたらく。
- アルカリ金属は電子を放出しやすいため、還元剤としてはたらく。
❸ 水と反応し、H2を発生して水酸化物になる。
- アルカリ金属は、水H2Oと反応してH2を発生し、水酸化物になる。
\[ \mathrm{2Na + 2H_{2}O → 2NaOH + H_{2}} \]
- この性質故に、アルカリ金属は水中ではなく石油中に保存する。
参考:化学反応式(係数・作り方・書き方・計算問題の解き方など)
❹ 酸素と反応し、酸化物になる。
- アルカリ金属は酸素と反応し酸化物になる。
\[ \mathrm{4Na + O_{2} → 2Na_{2}O} \]
参考:酸性酸化物・塩基性酸化物・両性酸化物(違い・見分け方・一覧・反応など)
❺ 炎色反応を示す。
- アルカリ金属は、炎色反応を示す。
| 元素名 | イオン式 | 色 |
|---|---|---|
| リチウム | Li | 赤色 |
| ナトリウム | Na | 黄色 |
| カリウム | K | 紫色 |
| ルビジウム | Rb | 赤色 |
| セシウム | Cs | (淡)紫色 |
- アルカリ金属は水に可溶で沈殿をつくりにくい。したがって、成分元素の検出反応では炎色反応が用いられる。
❻ 柔らかい。
- アルカリ金属は柔らかく、ナイフで切ることができる。その際の断面は銀白色であり、金属光沢をもつ。

❼ 融点が低い。
- アルカリ金属では、1原子あたり1個の自由電子を使って結晶を形成している。したがって、結合が弱いため、融点が低い。
- アルカリ金属の中では、周期表上で下に行くほど融点が低くなる。これは、原子半径が増大し、単位体積あたりの自由電子の数が減少するため、金属結合が弱くなるためである。
参考:原子の大きさ(比較・クーロン力や周期表、族、周期との関係など)
❽ 密度が小さい。
- アルカリ金属は各周期のはじめに存在する。したがって、原子半径が大きく、密度が小さい。
軽金属・重金属
- 密度が4ないし5g/cm3以下の金属を軽金属、軽金属以外の金属を重金属という。
- 軽金属には、アルカリ金属、アルカリ土類金属(ラジウムRaを除く)、アルミニウム Al、スカンジウムSc、チタンTiなどがある。
水酸化ナトリウムNaOH
- 水酸化ナトリウムNaOHの特徴は次の通りである。
●水酸化ナトリウムNaOHの特徴
- 1価の強塩基としてはたらく。
- 潮解性をもつ。
- 工業的製法:陽イオン交換膜法
❶ 1価の強塩基としてはたらく。
- 水酸化ナトリウム NaOHは1価の強塩基である。
- したがって、空気中の二酸化炭素CO2と反応し、炭酸ナトリウムNa2CO3を生じる。
\[ \mathrm{2NaOH + CO_{2} → Na_{2}CO_{3} + H_{2}O} \]
- また、過剰のCO2が反応すると、次のように炭酸水素ナトリウムNaHCO3が生じる。
\[ \mathrm{Na_{2}CO_{3}+ CO_{2}+H_{2}O→2NaHCO_{3}} \]
❷ 潮解性をもつ。
- 空気中の水分を吸収する性質を潮解性という。
- 水酸化ナトリウムNaOHは潮解性をもつ代表的な化合物であり、この性質を利用して、塩基性の乾燥剤であるソーダ石灰の成分として用いられる。
参考:【乾燥剤】酸性・中性・塩基性の乾燥剤一覧や分類・仕組みなど
- 他に潮解性をもつ化合物として、水酸化カリウムKOHや塩化マグネシウムMgCl2などがある。
❸ 工業的製法:陽イオン交換膜法
- 水酸化ナトリウムNaOHの工業的製法として陽イオン交換膜法がある。
- 陽イオン交換膜法について詳しくは次のページを参照のこと。
参考:【陽イオン交換膜法】水酸化ナトリウムの製法の仕組みや反応式など
苛性ソーダ
- 水酸化ナトリウムNaOHは苛性ソーダともよばれる。
- これは、 NaOHがアルカリであり、タンパク質のペプチド結合を切断することで、皮膚などの動物組織を激しくただれさせる性質(苛性)をもつことに由来する。
- NaOHが眼に入った際は、大量の水で洗い流し、すぐに医師の診察を受ける必要がある。
塩化ナトリウムNaCl
- 塩化ナトリウムNaClで押さえておくべきは、濃硫酸H2SO4との揮発性酸遊離反応である。
塩化ナトリウムと濃硫酸の揮発性酸遊離反応
- 揮発性の酸を含む塩である塩化ナトリウムNaClに不揮発性の酸である濃硫酸H2SO4を加えて加熱すると、揮発性の酸である塩化水素HClが発生する。
\[ \mathrm{NaCl + H_{2}SO_{4} → NaHSO_{4} +HCl} \]
- この反応は揮発性酸遊離反応の一種である。揮発性酸遊離反応について詳しくは次のページを参照のこと。
酸化ナトリウムNaO
- アルカリ金属の酸化物はいずれも”塩基性酸化物”のため、酸性酸化物・塩基性酸化物・両性酸化物(違い・見分け方・一覧・反応など)でやったように「水」又は「酸」と反応する場合がある。
水との反応
- 塩基性酸化物である酸化ナトリウムは水と次のような反応を起こす。
\[ \mathrm{Na_{2}O + H_{2}O → 2NaOH} \]
参考:酸性酸化物・塩基性酸化物・両性酸化物(違い・見分け方・一覧・反応など)
酸との反応
- 塩基性酸化物である酸化ナトリウムは酸と次のような反応を起こす。
\[ \mathrm{Na_{2}O + 2HCl → H_{2}O + 2NaCl} \]
炭酸ナトリウムNa2CO3
- 炭酸ナトリウムNa2CO3の特徴は次の通りである。
●炭酸ナトリウムNa2CO3の特徴
- 2価の弱塩基としてはたらく。
- 風解を起こす。
- 弱酸遊離反応に関わる。
- 用途:ガラスなど
- 製法:アンモニアソーダ法
❶ 2価の弱塩基としてはたらく。
- 炭酸ナトリウムNa2CO3は2価の弱塩基としてはたらく。
- 二段滴定で出題されることが多いため、次のページを必ず確認しておくこと。
❷ 風解を起こす。
- 炭酸ナトリウムNa2CO3の水和物である炭酸ナトリウム十水和物Na2CO3・10H2Oは、空気中に放置すると、結晶中の水和物がとれて粉末状になる。
\[ \mathrm{Na_{2}CO_{3}・10H_{2}O → Na_{2}CO_{3}・H_{2}O} \]
- この現象を風解という。
- 水酸化ナトリウムNaOHの性質として有名な潮解(空気中の水分を吸収すること)と区別しよう。
❸ 弱酸遊離反応に関わる。
- 炭酸ナトリウムNa2CO3は「弱酸を含む塩」なので弱酸遊離反応に関わる。
- 例として、Na2CO3と塩酸HClの弱酸遊離反応を確認する。
\[ \begin{align}&\mathrm{Na_{2}CO_{3}+2HCl → 2NaCl+\underbrace{H_{2}CO_{3}}_{ H_{2}O+CO_{2} }} \\
\ \\
&\mathrm{NaHCO_{3}+HCl → NaCl+\underbrace{H_{2}CO_{3}}_{ H_{2}O+CO_{2} }}\end{align}\]
- 弱酸を含む塩であるNa2CO3が強酸であるHClと反応することで、弱酸である炭酸H2CO3が遊離している。(H2CO3は分解しH2OとCO2になる)
- 弱酸遊離反応について詳しくは次のページを参照のこと。
参考:【弱酸・弱塩基遊離反応】原理や公式、反応式の作り方など
❹ 用途:ガラスなど
- 炭酸ナトリウムNa2CO3は洗剤として、また石英や石灰石とともにガラスの製造に用いられる。
❺ 製法:アンモニアソーダ法
- 炭酸ナトリウムNa2CO3の工業的製法をアンモニアソーダ法という。
- アンモニアソーダ法について詳しくは次のページを参照のこと。
炭酸水素ナトリウムNaHCO3
●炭酸水素ナトリウムNaHCO3の特徴
- 1価の還元剤としてはたらく。
- 熱分解して炭酸ナトリウムと二酸化炭素と水になる。
- 弱酸遊離反応に関わる。
- 用途:医薬品など
❶ 1価の還元剤としてはたらく。
- 炭酸水素ナトリウムNaHCO3は1価の還元剤としてはたらく。
❷ 熱分解して炭酸ナトリウムと二酸化炭素と水になる。
- 炭酸水素ナトリウムNaHCO3は、熱分解して炭酸ナトリウムNa2CO3と二酸化炭素CO2と水H2Oになる。
\[ \mathrm{2NaHCO_{3} → Na_{2}CO_{3} + CO_{2} + H_{2}O} \]
- なお、Na2CO3は熱分解しない。
❸ 弱酸遊離反応に関わる。
- 炭酸水素ナトリウムNaHCO3は「弱酸を含む塩」なので弱酸遊離反応に関わる。
- 例として、NaHCO3と塩酸HClの弱酸遊離反応を確認する。
\[ \mathrm{NaHCO_{3}+HCl → NaCl+\underbrace{H_{2}CO_{3}}_{ H_{2}O+CO_{2} }} \]
- 弱酸を含む塩であるNaHCO3が強酸であるHClと反応することで、弱酸である炭酸H2CO3が遊離している。(H2CO3は分解しH2OとCO2になる)
- 弱酸遊離反応について詳しくは次のページを参照のこと。
参考:【弱酸・弱塩基遊離反応】原理や公式、反応式の作り方など
❹ 用途:医薬品など
- 炭酸水素ナトリウムNaHCO3は医薬品やベーキングパウダーなどに含まれる。
- 胃酸(酸性)は消化などに役立つが、過剰に分泌されると胃潰瘍などの病気を引き起こす。NaHCO3は塩基性であり、胃酸を中和することでその効果を減弱させ、効果を示す。














