MENU
二段滴定(原理・例題・計算問題の解き方など)
はじめに
【プロ講師解説】このページでは『二段滴定(原理・例題・計算問題の解き方など)』について解説しています。
二段滴定とは
- 2価の酸や塩基には中和点が2個あることを利用した中和滴定を二段滴定という。
- 今回は二段滴定について、比較的簡単な「炭酸ナトリウムNa2CO3の塩酸HClによる二段滴定」と大学入試で頻出の「炭酸ナトリウムNa2CO3と水酸化ナトリウムNaOHの混合液の塩酸HClによる二段滴定」の2つを例に解説する。
炭酸ナトリウムの塩酸による二段滴定
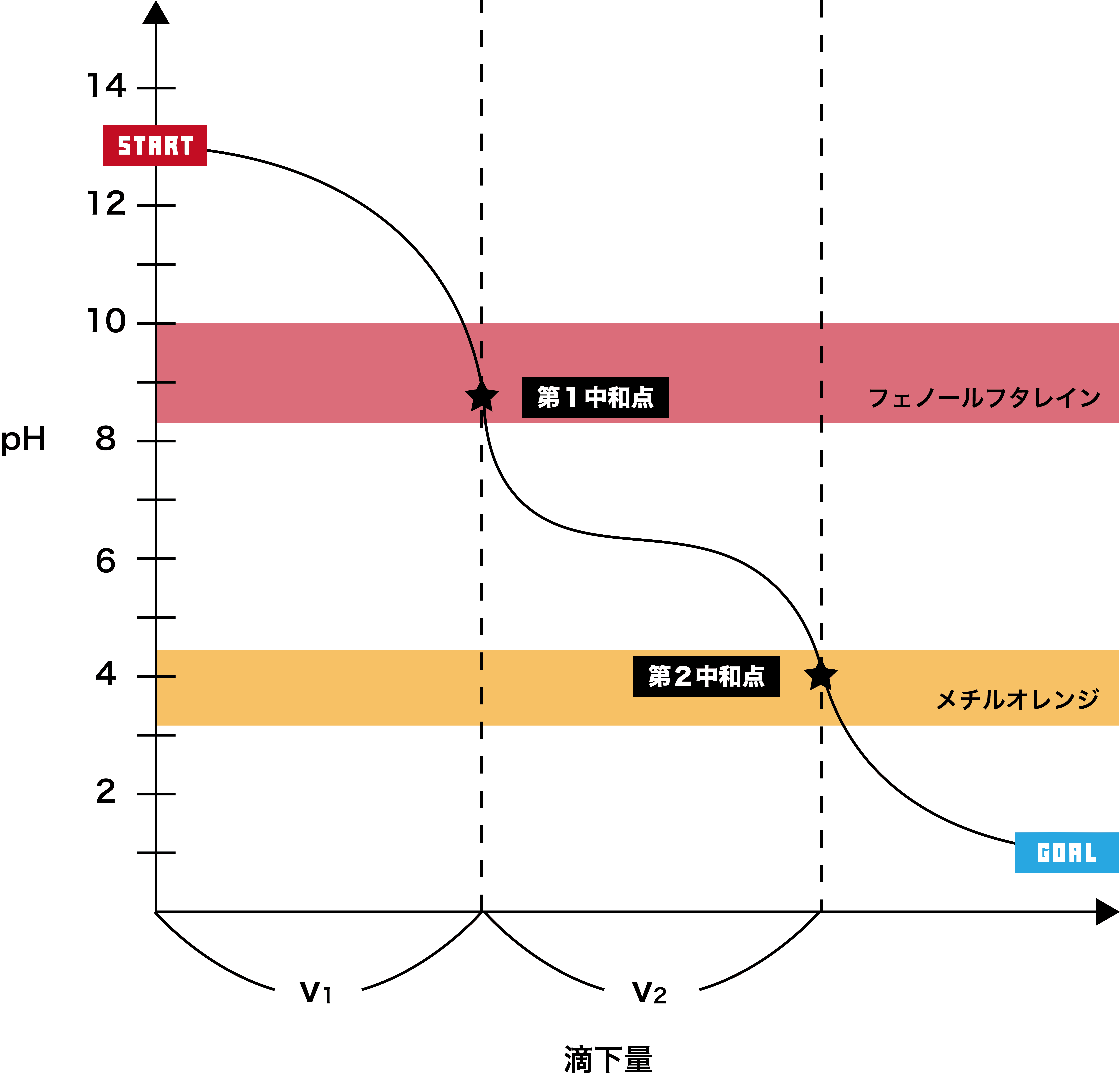
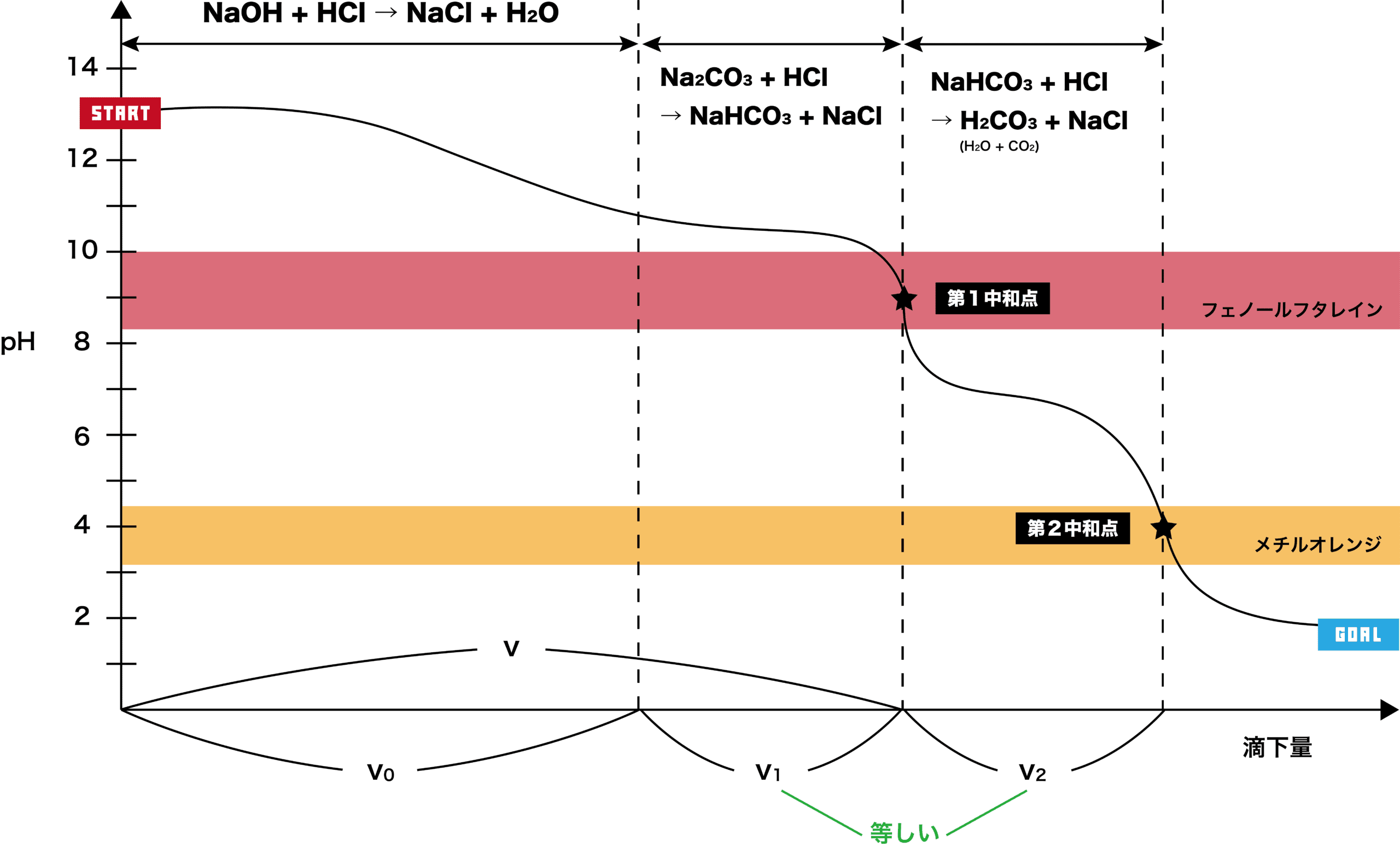
- 炭酸ナトリウムNa2CO3の塩酸HClによる二段滴定の滴定曲線は次の通りである。STARTの位置から順を追って解説する。
スタート時
- 炭酸ナトリウムNa2CO3(弱酸+強塩基から生じる塩)の水溶液は強塩基性のため、pHは12より少し上あたりになる。
中和点に達する

- 塩酸HClを滴下すると徐々にpHが低下し、やがて第一中和点に達する。ここまでの段階(第一段階とよぶ)では次のような反応が起こっている。
\[ \mathrm{Na_{2}CO_{3} + HCl → NaHCO_{3} + NaCl} \]
- 炭酸ナトリウムNa2CO3は段階的に中和される。つまり、一気に炭酸H2CO3になることはなく、一旦炭酸水素ナトリウムNaHCO3に変化するに留まる。
- また、強塩基に強酸を加えるため本来中和点はpH=7付近になるはずだが、この滴定の場合(水溶液中で電離して弱塩基性を示す)NaHCO3が生じるため、中和点は若干塩基性よりのpH=8くらいになる。
さらに塩酸を滴下
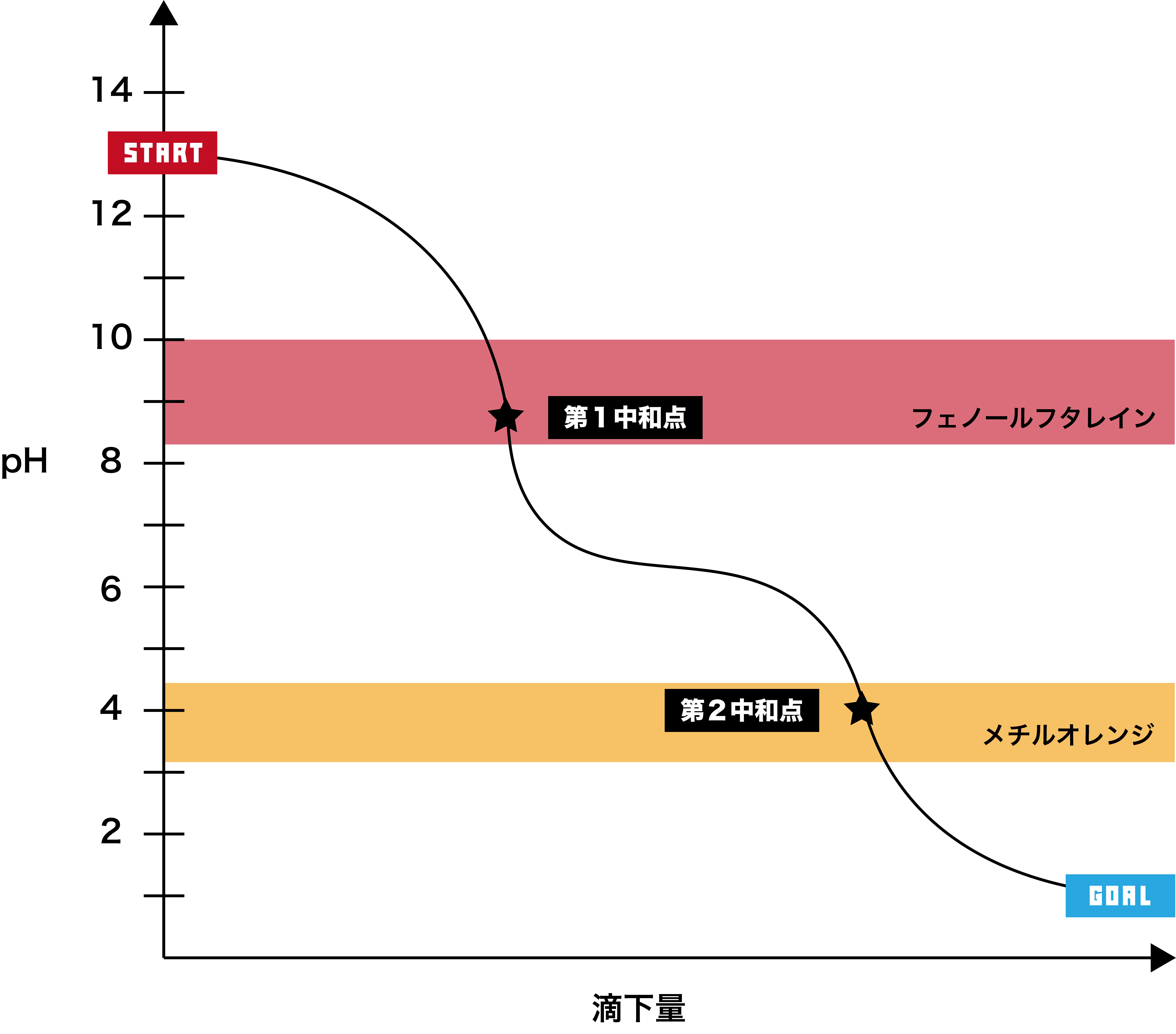
- さらに塩酸HClを滴下していくと、第二中和点に達する。ここまでの段階(第二段階と呼ぶ)では、次のような反応が起こっている。
\[ \mathrm{NaHCO_{3} + HCl → NaCl + H_{2}CO_{3}(H_{2}O + CO_{2})} \]
- 第二段階では、第一段階で生じたNaHCO3が反応する。このとき生成したH2CO3はすぐにH2OとCO2に分解すること、弱塩基性の水溶液に強酸を加えているので中和点のpHは酸性に偏ることは押さえておこう。
- また、第一段階と第二段階の反応式を一度に見ると…

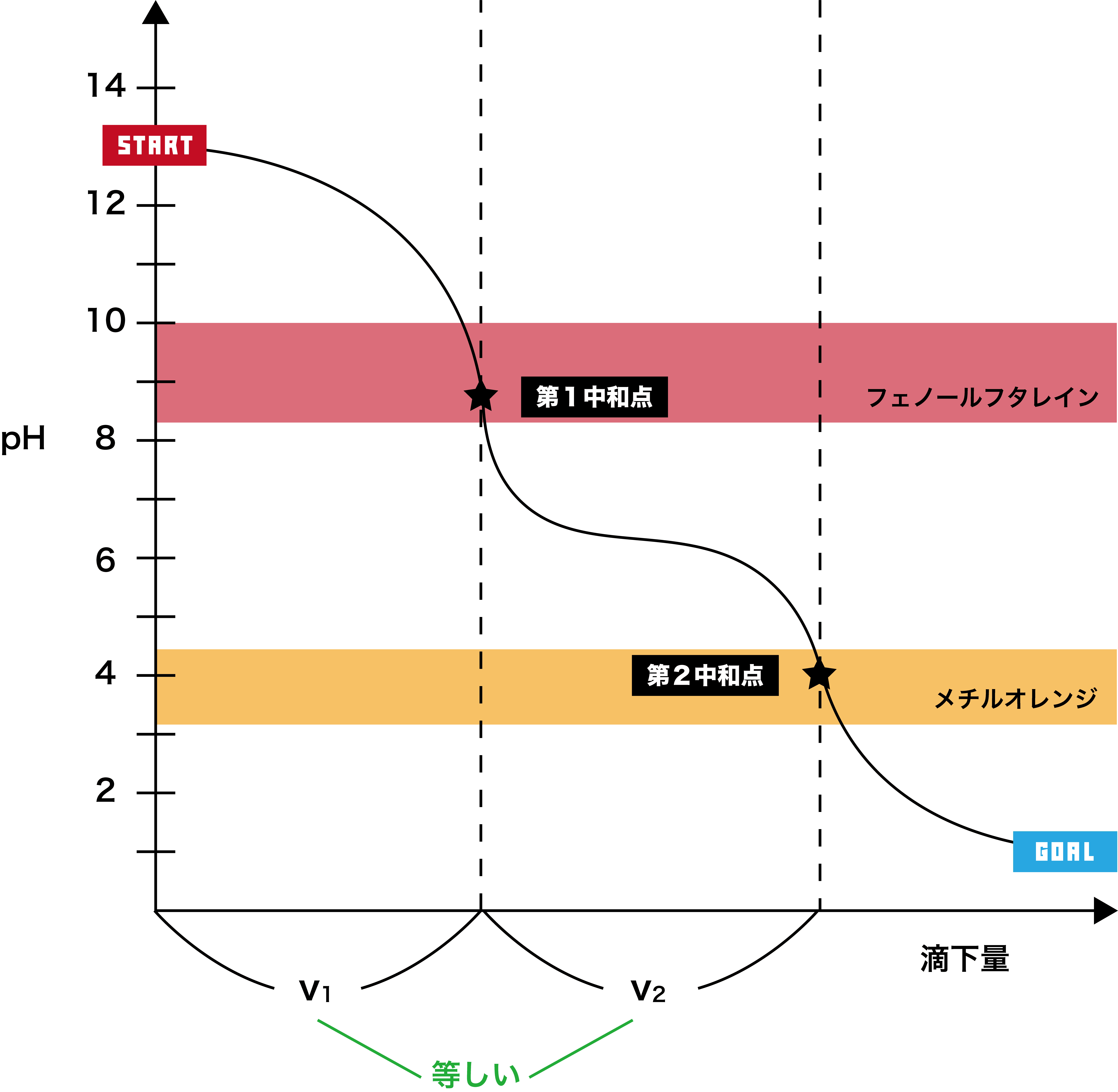
- 全ての物質の係数が1になっているので、(係数比=mol比であることを考慮すると)1molのNa2CO3を二段滴定する場合、第一段階で1mol、第二段階で1molのHClを消費する。
- つまり、第一段階で滴下するHClの量(v1)と第二段階で滴下するHClの量(v2)は等しい。
炭酸ナトリウムと水酸化ナトリウムの混合液の塩酸による二段滴定
- 次に、大学入試で頻出の「炭酸ナトリウムNa2CO3と水酸化ナトリウムNaOHの混合液の塩酸HClによる二段滴定」について解説する。
- 基本的に炭酸ナトリウムNa2CO3は「炭酸ナトリウムNa2CO3の塩酸HClによる二段滴定」の場合と変わらない反応をする。
- 第一段階(第1中和点に達するまでの段階)では、炭酸ナトリウムNa2CO3が炭酸水素ナトリウムNaHCO3に変化する。
\[ \mathrm{Na_{2}CO_{3} + HCl → NaHCO_{3} + NaCl }\]
- 第二段階(第2中和点に達するまでの段階)では、炭酸水素ナトリウムNaHCO3が炭酸H2CO3に変化する。
\[ \mathrm{NaHCO_{3} + HCl → NaCl + H_{2}CO_{3}(H_{2}O + CO_{2}) }\]
- 対して、新しく登場した水酸化ナトリウムNaOHは第一段階で次のように反応する。
\[ \mathrm{NaOH + HCl → NaCl + H_{2}O }\]
- 以上より、第一段階、第二段階の反応をまとめると次のようになる。
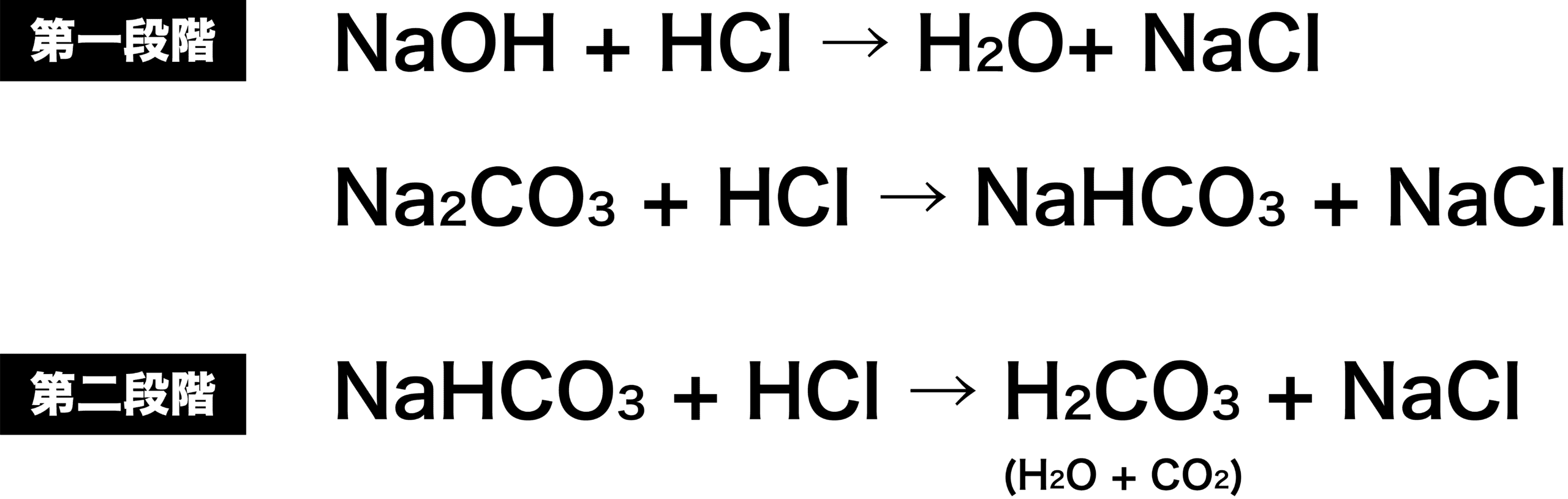
- ちなみに、第一段階の2つの反応は「NaOHとHClの反応」が先に起こる。これは(NaOHが電離して生成する)OHーと(Na2CO3が電離して生成する)CO32ーを比較して、OHーの方が(HClが電離して生成する)H+を受け取りやすいからである。
- 以上の事項を滴定曲線で表すと次のようになる。

- 滴定曲線中において、NaOHの滴定に使用したHClの量はv0、v0とv1を合わせたものをvと表している。第一段階でNa2CO3よりも先にNaOHが反応していること、(「Na2CO3のHClによる二段滴定」で説明したように)v1とv2の量が等しくなっていることを確認しよう。
二段滴定の計算問題
炭酸ナトリウムと水酸化ナトリウムの混合溶液がある。まず、混合溶液20mLにフェノールフタレイン(変色域:pH 8.3〜10)を加え、0.10mol/Lの希塩酸で滴定したところ、終点までに30mLの希塩酸を要した。次に、この滴定後の溶液にメチルオレンジ(変色域:pH 3.1〜4.4)を加え、同じ希塩酸で滴定を続けたところ、終点までにさらに10mLを要した。最初の時点で混合溶液に含まれる炭酸ナトリウム及び水酸化ナトリウムのモル濃度(mol/L)を、それぞれ求めよ。
(1)一回目の中和点までに起こる反応の化学反応式を書け。
(2)二回目の中和点までに起こる反応の化学反応式を書け。
(3)最初の時点で混合溶液に含まれる炭酸ナトリウム及び水酸化ナトリウムのモル濃度(mol/L)を、それぞれ求めよ。
(1)一回目の中和点までに起こる反応の化学反応式を書け。
- 第一段階で起こる反応は次の2つである。
\[ \mathrm{NaOH + HCl → NaCl + H_{2}O \cdots (1)} \]
\[ \mathrm{Na_{2}CO_{3} + HCl → NaHCO_{3} + NaCl \cdots (2) }\]
- 第一段階の2つの反応は「NaOHとHClの反応」が先に起こる。これは(NaOHが電離して生成する)OHーと(Na2CO3が電離して生成する)CO32ーを比較して、OHーの方が(HClが電離して生成する)H+を受け取りやすいからである。
(2)二回目の中和点までに起こる反応の化学反応式を書け。
- 第二段階では次の反応が起こる。
\[ \mathrm{NaHCO_{3} + HCl → NaCl + H_{2}CO_{3}(H_{2}O + CO_{2}) \cdots (3)} \]
- 生成したH2CO3はできた後すぐにH2OとCO2に分解する。
(3)最初の時点で混合溶液に含まれる炭酸ナトリウム及び水酸化ナトリウムのモル濃度(mol/L)を、それぞれ求めよ。

- 問題文で与えられている数値を上の滴定曲線に当てはめると次のようになる。
\[ \begin{align}&\mathrm{v=30mL}\\
&\mathrm{v_{2}=10mL}\end{align} \]
- また、v=v0+v1,v1=v2の関係があるため、次のことがわかる。
\[ \begin{align}&(2)式で反応した塩酸\\
&\mathrm{v_{1}=v_{2}=10mL} \\
&(1)式で反応した塩酸\\
&\mathrm{v_{0}=v-v_{1}=30mL-10mL=20mL}\end{align} \]
- 混合溶液中のNaOHのモル濃度をc(mol/L)とし、(1)式のNaOHとHClについて中和計算をすると次のようになる。
\[ \begin{align}&\underbrace{c\mathrm{(mol/L)×\frac{ 20 }{ 1000 }(L) }}
_{ \text{ NaOHのmol }}
=
\underbrace{\mathrm{0.10(mol/L)×\frac{ 20 }{ 1000 }(L) }}
_{ \text{ HClのmol }} \\
\\
&↔︎c\mathrm{=0.10(mol/L)}\end{align} \]
- また、混合液中のNa2CO3のモル濃度をc'(mol/L)とし、(2)式のNa2CO3とHClについて中和計算をすると次のようになる。
\[ \begin{align}&\underbrace{c’\mathrm{(mol/L)×\frac{ 20 }{ 1000 }(L) }}
_{ \mathrm{Na_{2}CO_{3}}\text{のmol }}
=
\underbrace{\mathrm{0.10(mol/L)×\frac{ 10 }{ 1000 }(L)} }
_{ \text{ HClのmol }} \\
\\
&↔︎c’\mathrm{=0.050(mol/L)}\end{align} \]
二段滴定まとめ
この『二段滴定(原理・例題・計算問題の解き方など)』のページで解説した内容をまとめる。
- 2価の酸や塩基には中和点が2個あることを利用した中和滴定を二段滴定という。
- 高校化学では「炭酸ナトリウムNa2CO3の塩酸HClによる二段滴定」と「炭酸ナトリウムNa2CO3と水酸化ナトリウムNaOHの混合液の塩酸HClによる二段滴定」が頻出である。













