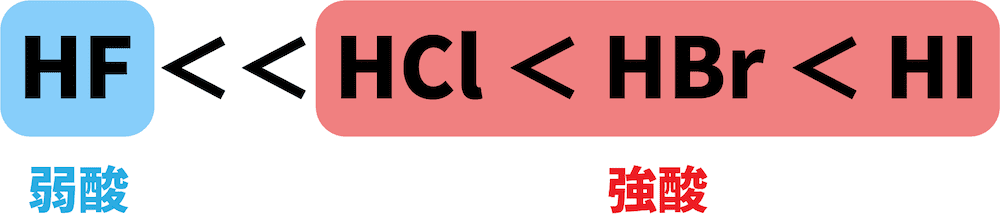MENU
ハロゲン【高校化学・化学基礎一問一答】
常温常圧下、F2は【1(気 or 液 or 固)】体、【2】色である。
解答/解説:タップで表示
解答:【1】気【2】淡黄
常温常圧下、F2は気体、淡黄色である。
参考:ハロゲン単体・ハロゲン化水素の性質・製法
参考:気体の性質(色・臭い・毒性・水溶液の液性など)
参考:常温・常圧時の物質の状態まとめ(気体・液体・固体)
常温常圧下、Cl2は【1(気 or 液 or 固)】体、【2】色である。
解答/解説:タップで表示
解答:【1】気【2】黄緑
常温常圧下、Cl2は気体、黄緑色である。
参考:ハロゲン単体・ハロゲン化水素の性質・製法
参考:気体の性質(色・臭い・毒性・水溶液の液性など)
参考:常温・常圧時の物質の状態まとめ(気体・液体・固体)
常温常圧下、Br2は【1(気 or 液 or 固)】体、【2】色である。
解答/解説:タップで表示
解答:【1】液【2】赤褐
常温常圧下、Br2は液体、赤褐色である。
参考:ハロゲン単体・ハロゲン化水素の性質・製法
参考:気体の性質(色・臭い・毒性・水溶液の液性など)
参考:常温・常圧時の物質の状態まとめ(気体・液体・固体)
常温常圧下、I2は【1(気 or 液 or 固)】体、【2】色である。
解答/解説:タップで表示
解答:【1】固【2】黒紫
常温常圧下、I2は固体、黒紫色である。
参考:ハロゲン単体・ハロゲン化水素の性質・製法
参考:気体の性質(色・臭い・毒性・水溶液の液性など)
参考:常温・常圧時の物質の状態まとめ(気体・液体・固体)
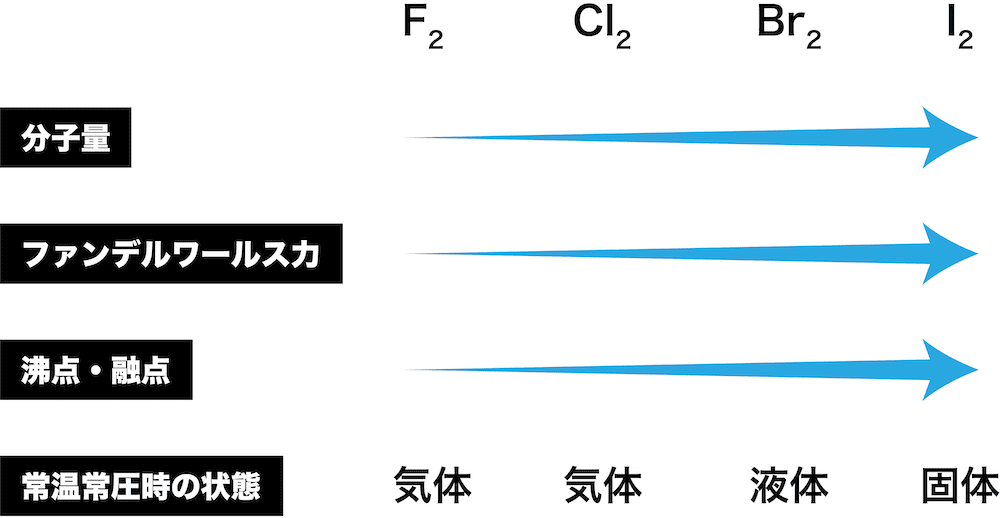
F2,Cl2,Br2,I2を沸点の高い順に並べよ。
解答/解説:タップで表示
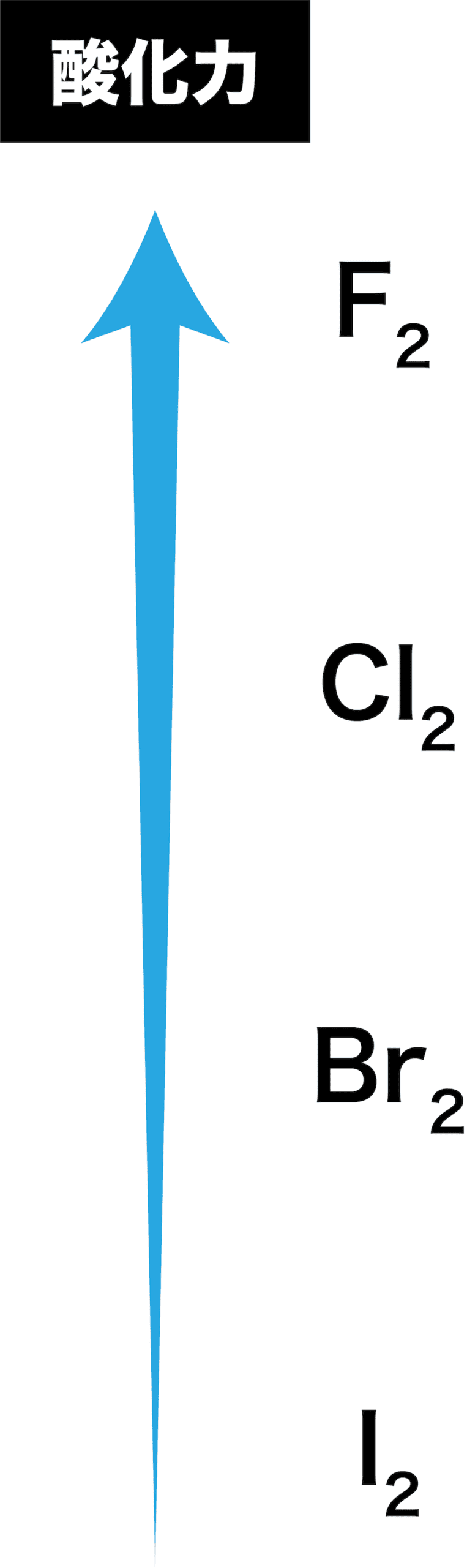
F2,Cl2,Br2,I2を酸化力の強い順に並べよ。
解答/解説:タップで表示
次のうち反応が起こるのはどちらか。
① 2KBr + Cl2 →
② 2KCl + Br2 →
解答/解説:タップで表示
F2,Cl2,Br2,I2のうち、低温や暗所でもH2と爆発的に反応するのは【1】である。
解答/解説:タップで表示
F2,Cl2,Br2,I2のうち、H2Oと反応しないのは【1】である。
解答/解説:タップで表示
Cl2を工業的につくる際は、【1】水溶液の電気分解を行う。
解答/解説:タップで表示
塩素の製法において、2つの洗気ビンは【1(水→濃硫酸 or 濃硫酸→水)】の順でつなぐ。
解答/解説:タップで表示
濃硫酸は【1】性の乾燥剤である。
解答/解説:タップで表示
塩素は【1】置換法で回収する。
解答/解説:タップで表示
ハロゲンと水素からなる化合物を【1】という。
解答/解説:タップで表示
HF,HCl,HBr,HIで、沸点が最も高いのは【1】、最も低いのは【2】である。
解答/解説:タップで表示
HF,HCl,HBr,HIを酸としての強さの順に並べよ。
解答/解説:タップで表示
ハロゲン化水素のうち【1】だけは弱酸、その他は強酸である。
解答/解説:タップで表示
塩化銀AgClは【1】色である。
解答/解説:タップで表示
臭化銀AgBrは【1】色である。
解答/解説:タップで表示
ヨウ化銀AgIは【1】色である。
解答/解説:タップで表示
ハロゲン化物イオンのうち、Ca2+と沈殿をつくるのは【1】である。
解答/解説:タップで表示
フッ化水素酸は、ガラスの主成分である【1】と反応し、ガラスを腐食させる。
解答/解説:タップで表示
HClを実験室でつくる際は、NaClに【1】を加えて加熱する。
解答/解説:タップで表示
酸素O原子を含む酸を【1】という。
解答/解説:タップで表示
塩素のオキソ酸の中で酸としての強さが最大なのは【1】である。