MENU
結合エンタルピー【高校化学・化学基礎一問一答】
問1
気体分子間の共有結合1molを切断するために必要なエネルギーを【1】という。
解答/解説:タップで表示
問2
塩化水素HClの生成エンタルピーを求めよ。ただし、HーH、ClーCl、HーClの結合エンタルピーをそれぞれ432kJ/mol、239kJ/mol、428kJ/molとする。
解答/解説:タップで表示
解答:92.5kJ
STEP
求める反応熱をQkJとし、それを含む熱化学方程式を書く。
求めたいのはHClの生成エンタルピーのため、HClの係数を1とし、他の物質の係数はそれに合わせる。また、求めたい熱量はQkJとする。
\[ \mathrm{\frac{ 1 }{ 2 }H_{2}(気)+\frac{ 1 }{ 2 }Cl_{2}(気) \longrightarrow HCl(気)}~~~ΔH = Q\mathrm{\mathrm{kJ}} \]
STEP
STEP1でつくった式を元に、エネルギー図を書く。
H2とCl2という2つの物質がまとまってHClという1つの物質になるため、より「バラバラ」であるH2とCl2の方がエネルギーが高い。したがって、より高い位置に書く。
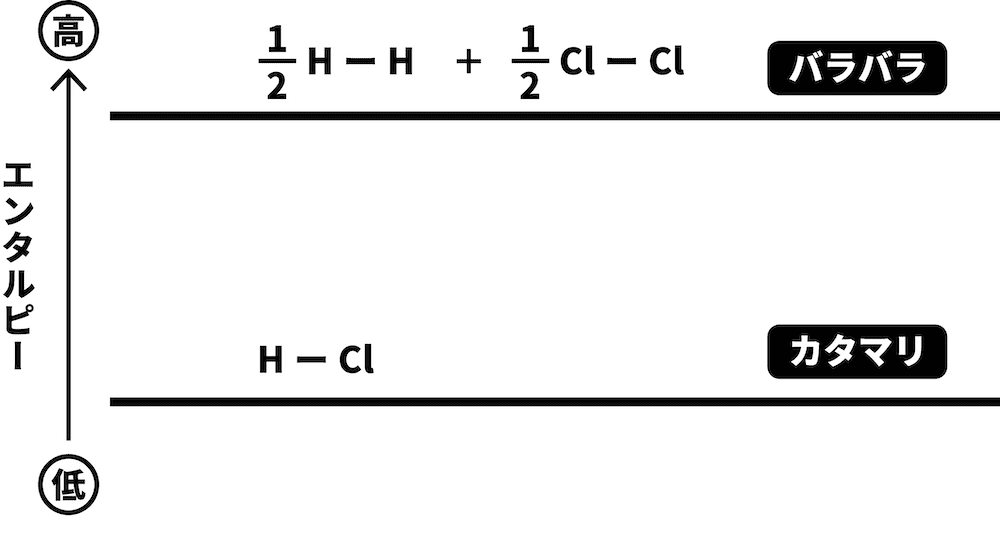
STEP
図に書き込んだ分子を「バラバラ」の状態にし、エネルギー図の上の位置に書く。
H2とCl2が、それぞれH原子とCl原子になった場合を考える。
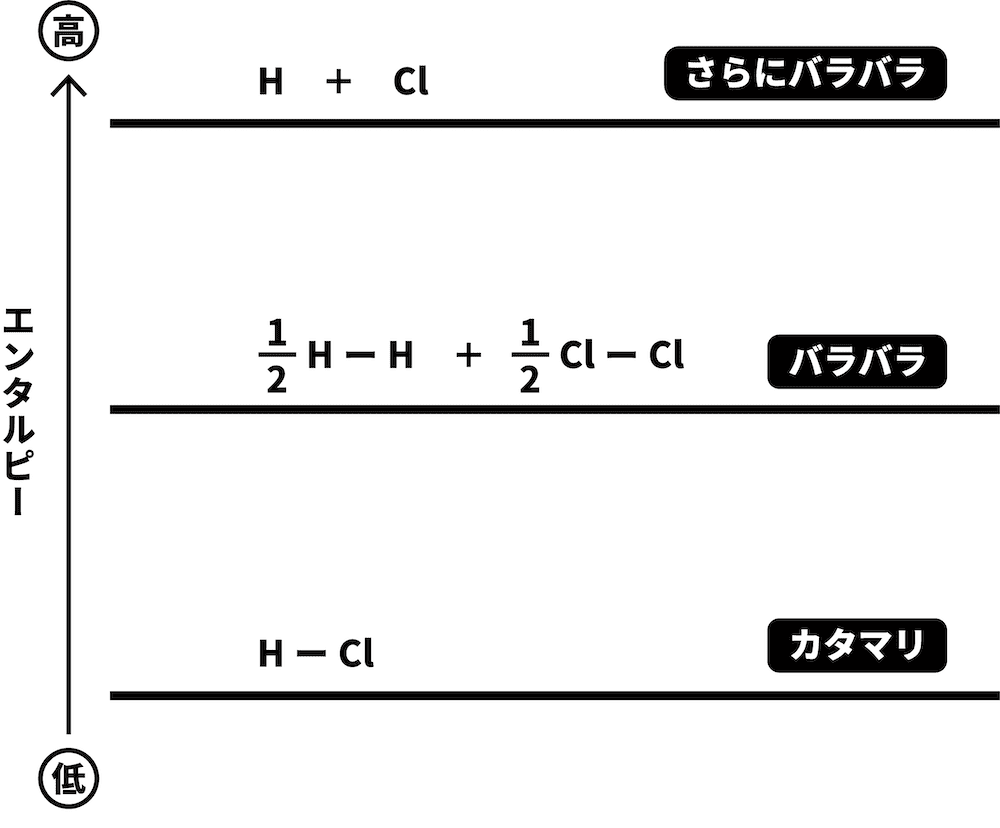
STEP
それぞれの結合を切るために必要なエネルギーを書き込む。
問題文に書いてあったHーH、ClーCl、HーCl結合の結合エネルギーを図中に書き込む。
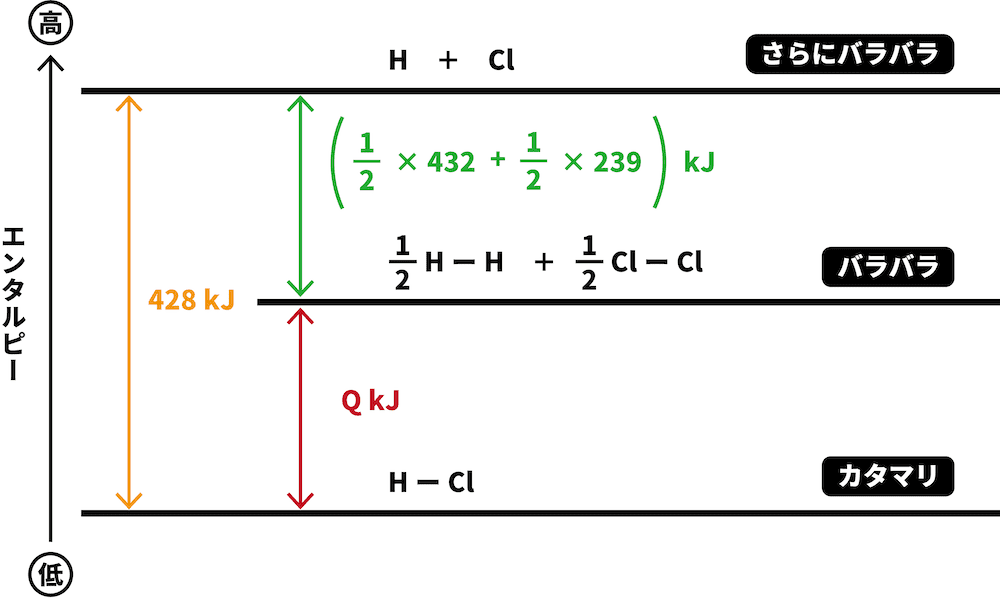
係数がついていた場合は、それをかけるのを忘れないように注意する。
STEP
ヘスの法則を利用して方程式を作成し、それを解く。
ヘスの法則により、化学変化に伴う反応エンタルピーは、反応前後の状態で決まり、反応経路によって変化しない。
参考:ヘスの法則(定義・反応エンタルピーの計算問題の解き方)
これを利用することで、次の式をたてることができる。
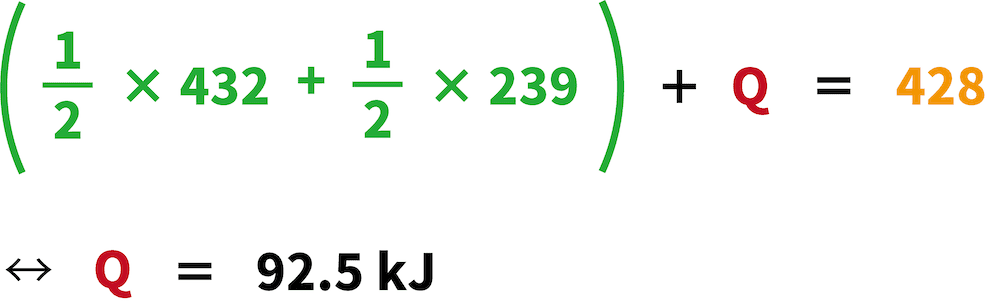
これが塩化水素HClの生成エンタルピーである。














