MENU
塩化ナトリウム型構造【高校化学・化学基礎一問一答】
塩化ナトリウム型構造(NaCl型構造)に含まれるNa+の数は【1】個である。
解答/解説:タップで表示
解答:【1】4
塩化ナトリウム型構造(NaCl型構造)に含まれるNa+のうち、格子の各“辺”にあるものは、Na+を4分割した状態になっている。
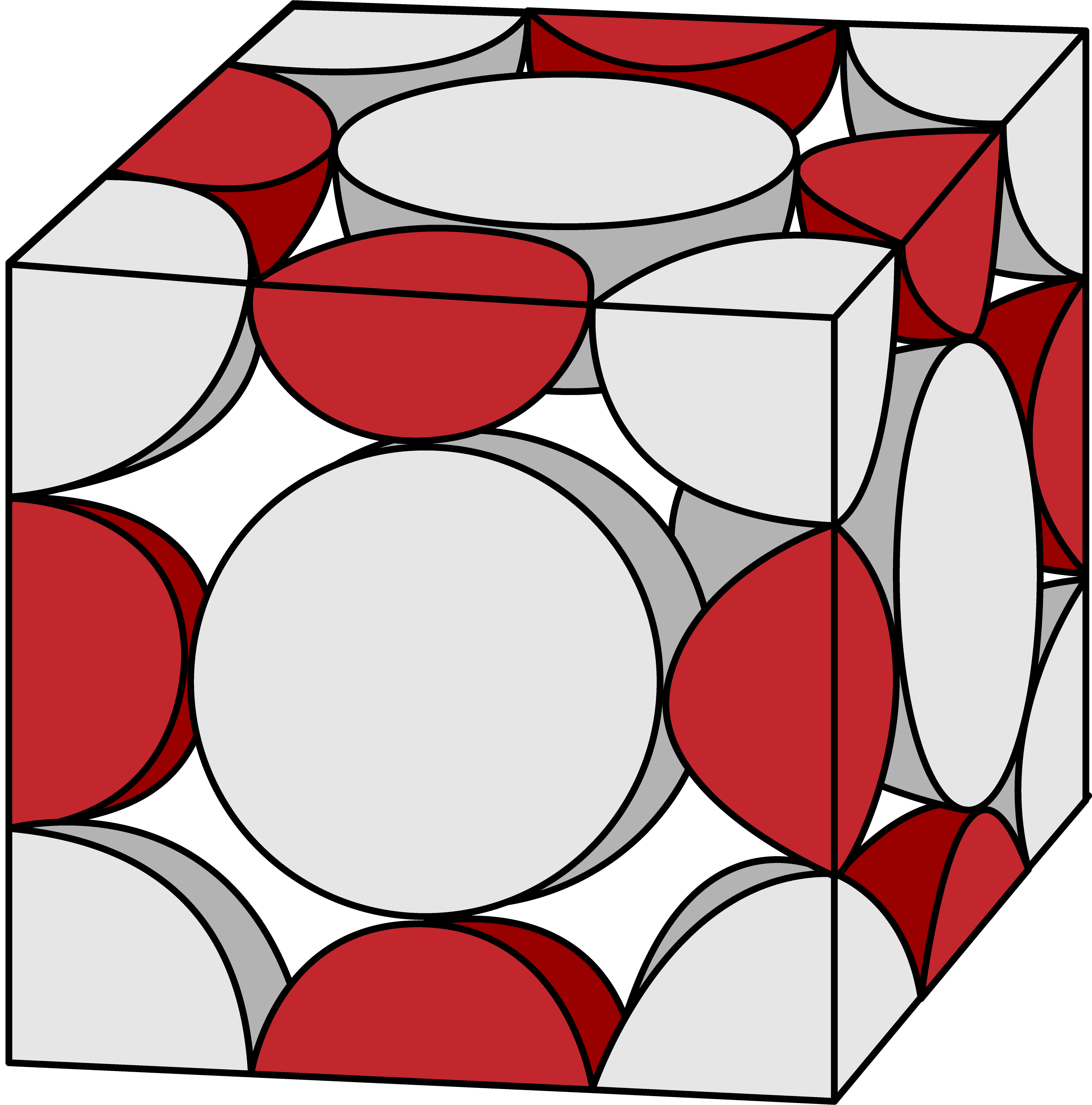
4分割(1/4)したものが辺の数分=12個あるので…
\[
\frac{ 1 }{ 4 }×12=3
\]
辺にあるNa+の数は合わせて3個である。また、塩化ナトリウム型構造(NaCl型構造)に含まれるNa+のうち、格子の中心にあるものは丸々1個である。
以上より、塩化ナトリウム型構造(NaCl型構造)に含まれるNa+の数は4個である。
\[
3+1=4
\]
塩化ナトリウム型構造(NaCl型構造)に含まれるClーの数は【1】個である。
解答/解説:タップで表示
解答:【1】4
塩化ナトリウム型構造(NaCl型構造)に含まれるClーのうち、格子の各頂点にあるものはClーを8分割した状態になっている。
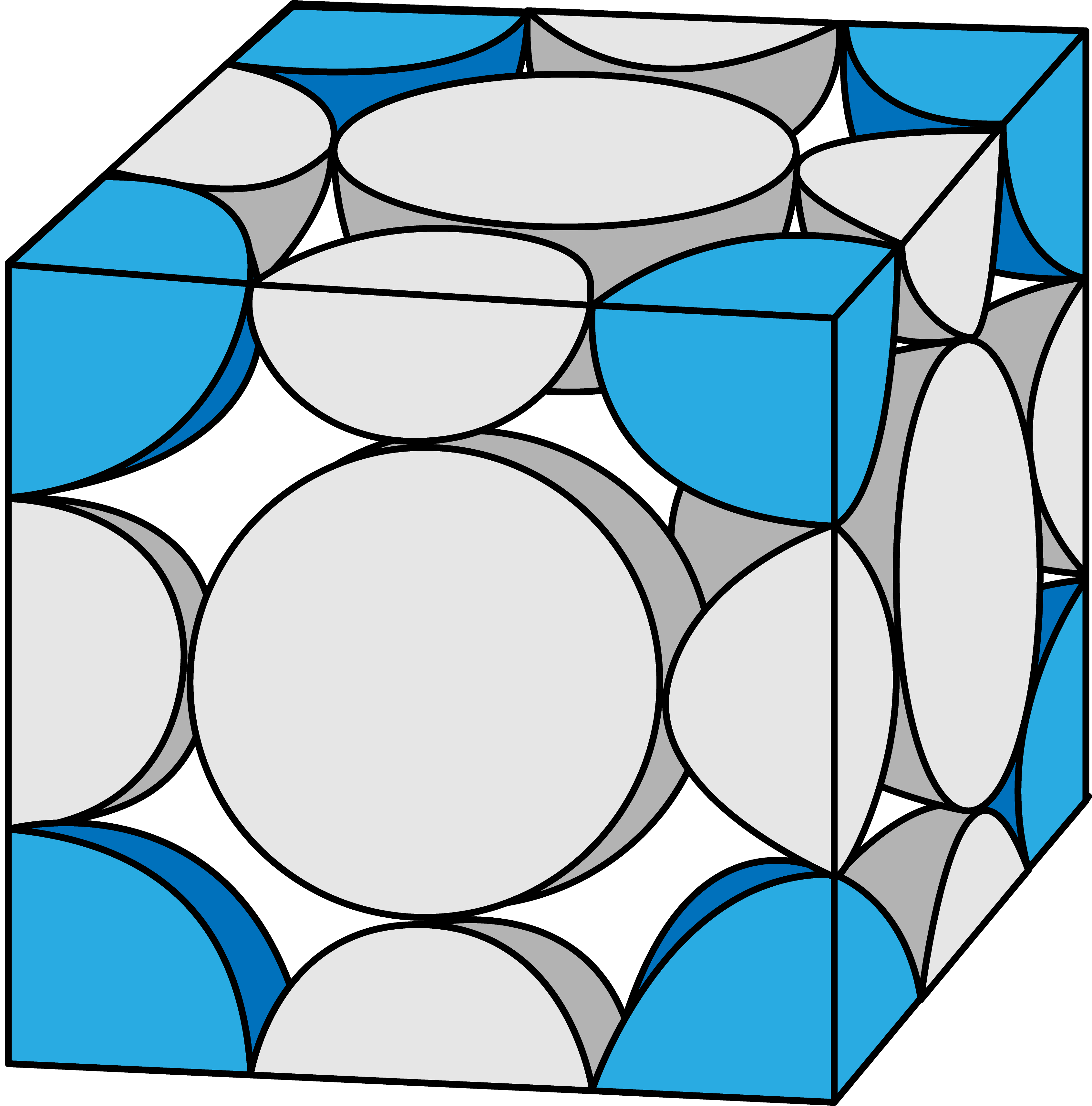
したがって、8分割(1/8)したものが頂点の数分=8個あるので…
\[
\frac{ 1 }{ 8 }×8=1
\]
頂点にあるClーの数は合わせて1個である。
塩化ナトリウム型構造(NaCl型構造)に含まれるClーのうち、各“面”の中心にあるものは、Clーを2分割したものになっている。
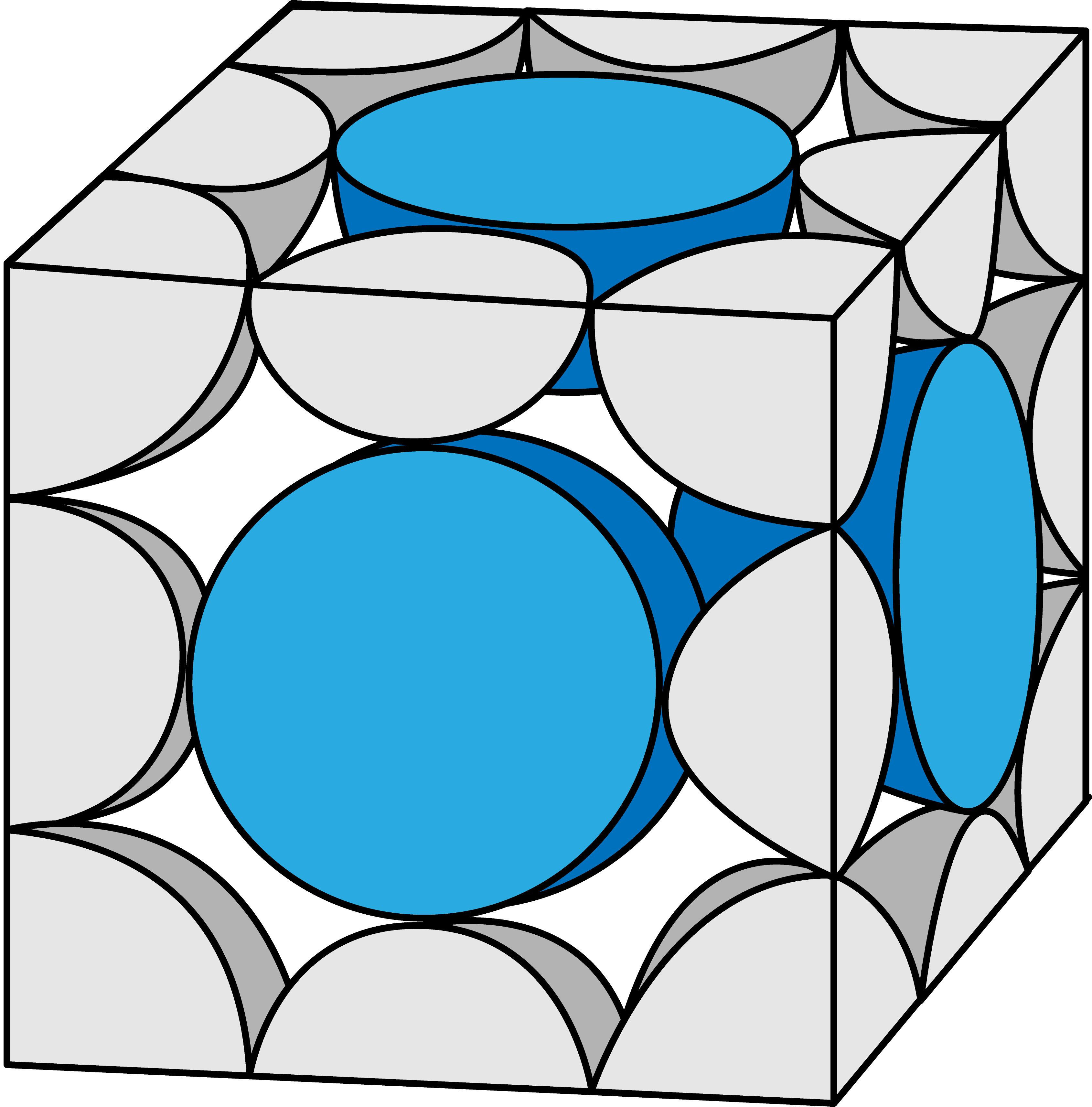
したがって、2分割(1/2)したものが面の数分=6個あるので…
\[
\frac{ 1 }{ 2 }×6=3
\]
面の中心にあるClーの数は合わせて3個である。
以上より、塩化ナトリウム型構造(NaCl型構造)に含まれるClーの数は4個である。
\[
1+3=4
\]
塩化ナトリウム型構造(NaCl型構造)の各イオンの配位数は【1】である。
解答/解説:タップで表示
解答:【1】6
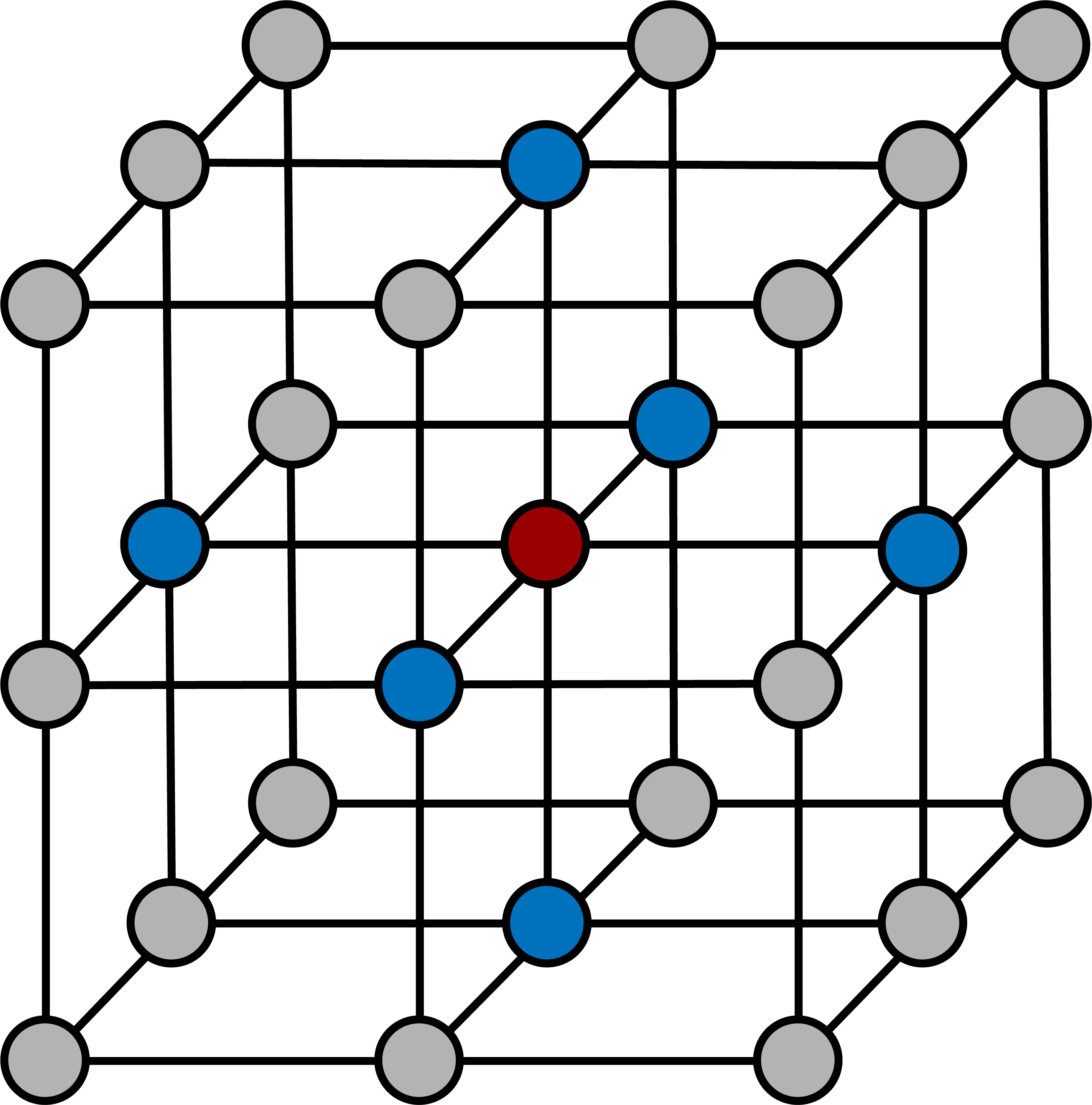
塩化ナトリウム型構造(NaCl型構造)では、中心のNa+は周りの6個のClーと接しており、同様にClーも周りの6個のNa+と接している。
したがって、塩化ナトリウム型構造(NaCl型構造)の各イオンの配位数は6である。
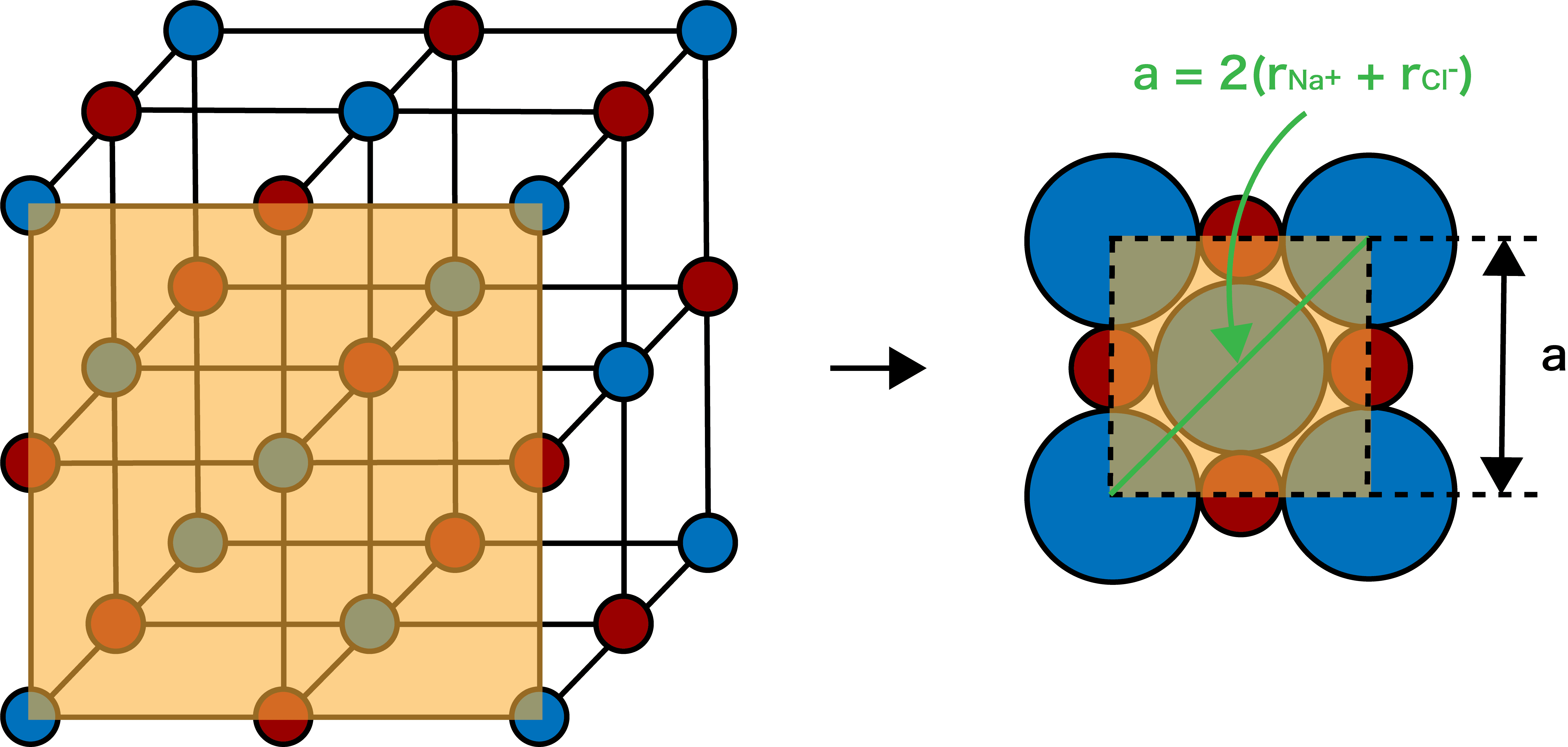
イオン半径rと単位格子一辺の長さaの間には次の関係がある。
\[ \mathrm{a=【1】(r_{Na^{+} }+r_{Cl^{-}}) }\]
解答/解説:タップで表示
解答:【1】2
Na+・Clーのイオン半径をそれぞれrNa+・rClー、単位格子一辺の長さをaとし、塩化ナトリウム型構造(NaCl型構造)の面の部分に注目すると…
塩化ナトリウム型構造(NaCl型構造)の限界イオン半径比は0.41〜【1】である。
解答/解説:タップで表示
解答:【1】0.73
塩化ナトリウム型構造(NaCl型構造)の限界イオン半径比は0.41〜0.73である。
参考:【塩化ナトリウム型構造】イオン結晶の配位数・半径・限界半径比まとめ
参考:限界イオン半径比(定義・求め方・配位数との関係など)














